Adipose-Derived Mesenchymal Stem Cells Reprogram M1 Macrophage Metabolism via PHD2/HIF-1a Pathway in Colitis Mice
脂肪来源的间充质干细胞在结肠炎小鼠中,细胞通过PHD2/HIF -1a途径重编程M1巨噬细胞的代谢
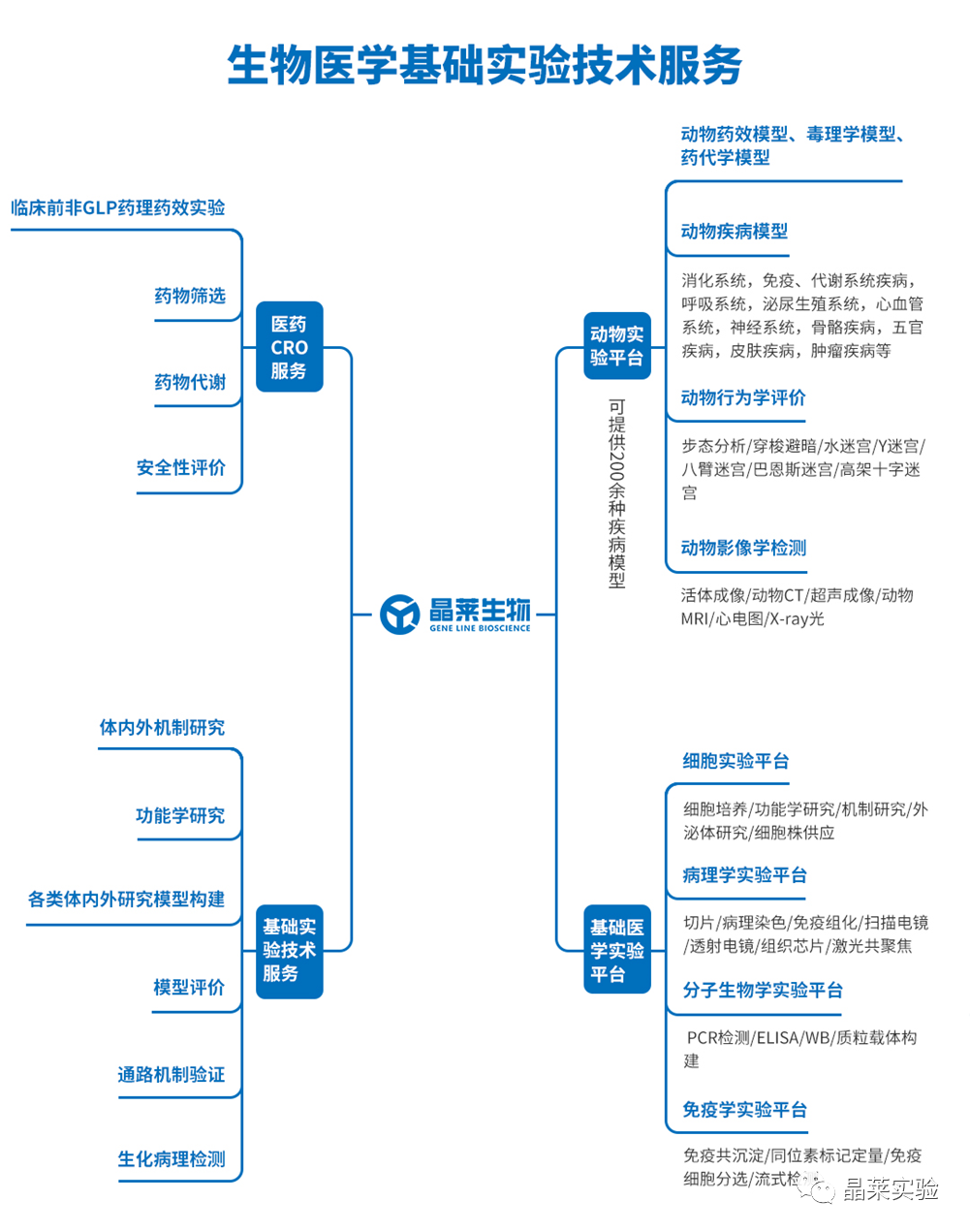
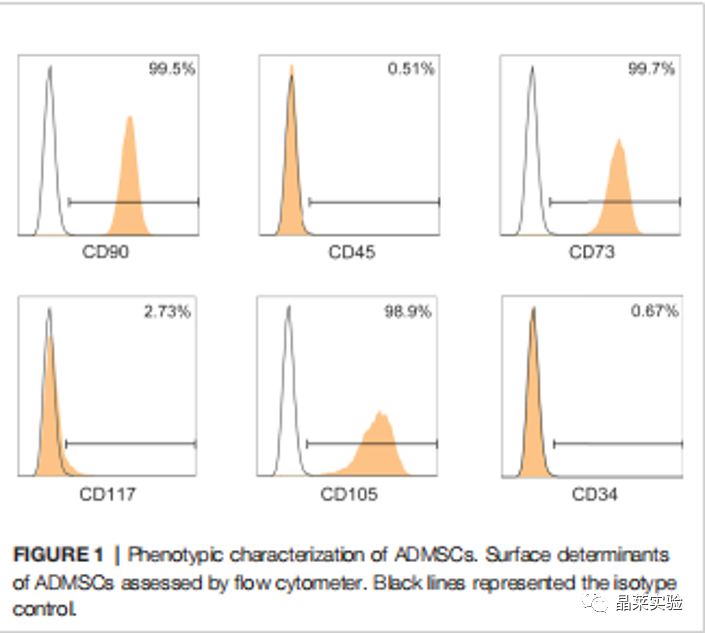
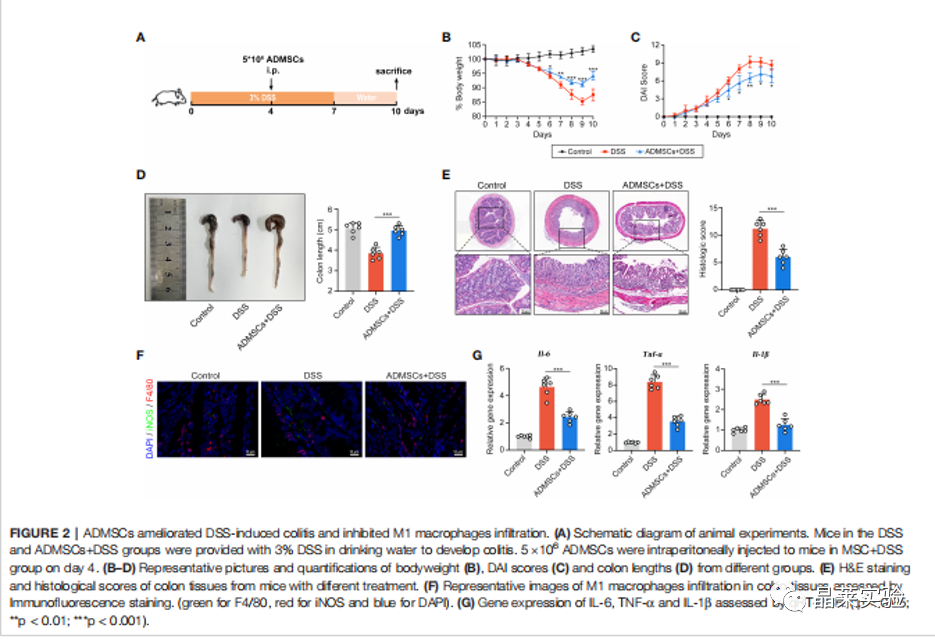
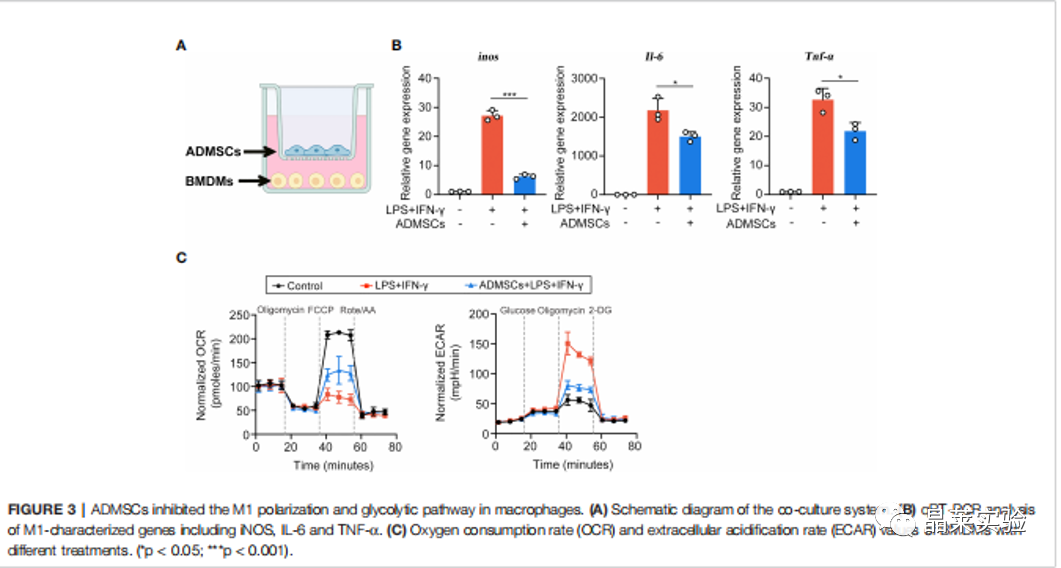
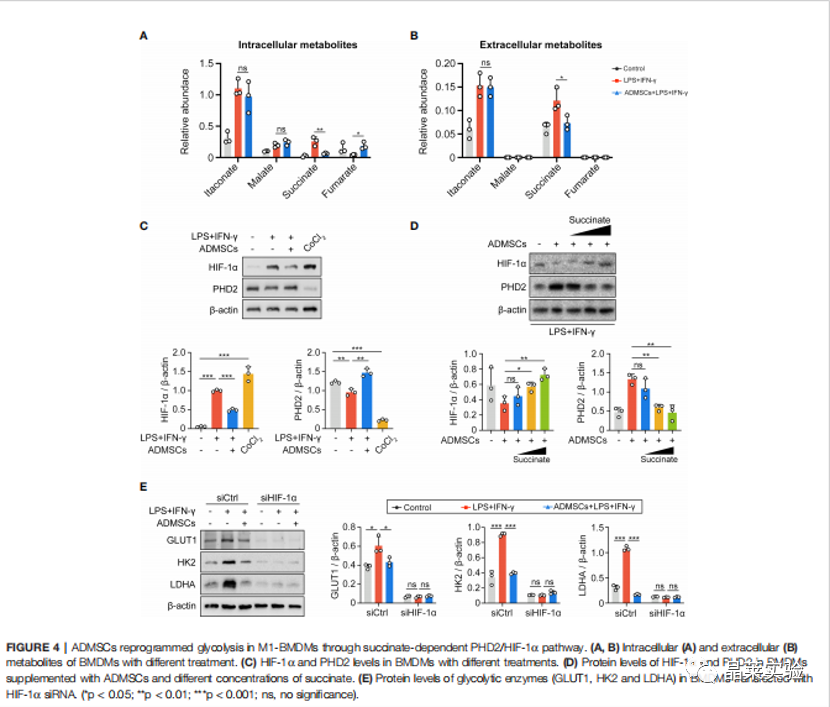
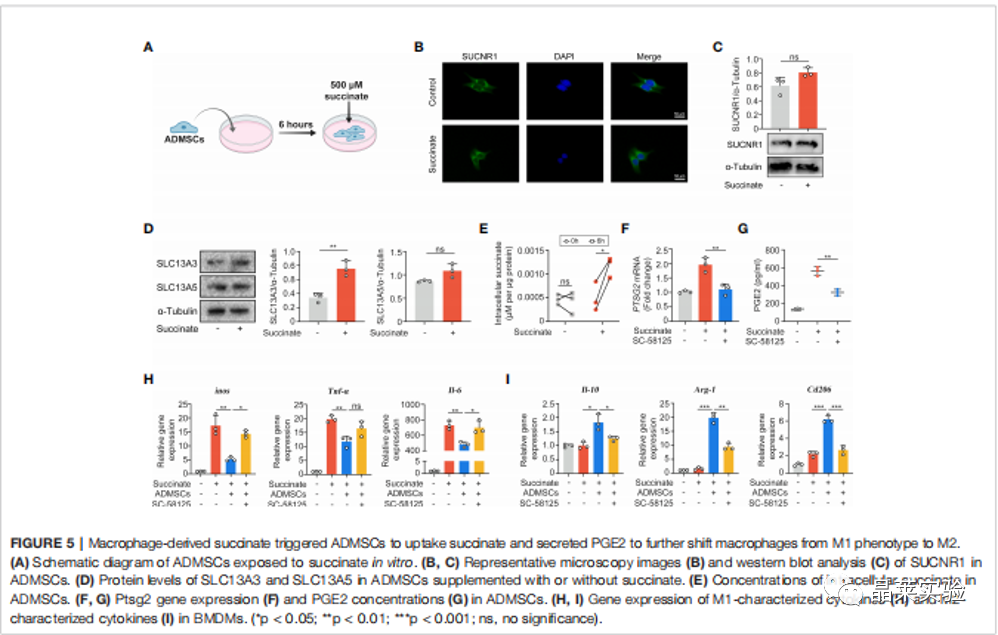
期刊名:FRONT IMMUNOL; 2022年影响因子:6.756 研究背景 1、溃疡性结肠炎(UC)是一种在世界范围内发生的慢性炎症性肠病, 特征是直肠和结肠的表面黏膜炎症有限。促炎巨噬细胞(M1巨 噬细胞)的不过滤有助于肠道炎症的发生。间充质干细胞(MSCs)移植是一种很有前途的治疗策略,但其确切的机制尚不清楚。 2、肠道巨噬细胞在建立和维持肠道免疫稳态中具有重要作用。活化的巨噬细胞有两种主要表型,M1巨噬细胞和M2巨噬细胞。M1巨噬细胞具有促炎功能,因为它们可以分泌各种促炎细胞因子、趋化因子和 炎症介质。而M2巨噬细胞主要参与抗炎反应和组织修复。多项研究表明,UC患者和结肠炎动物模型的结肠组织中M1巨噬细胞的百分比增加。在炎症环境下, 这些巨噬细胞被激活到特定的表型,从而加重了肠道炎症反应,加速了UC的进展。 3、细胞代谢随着巨噬细胞的激活而发生显着变化 。糖酵解是 M1 巨噬细胞的主要能量事件,其中葡萄糖转化为丙酮酸,伴随着 ATP 的产生。过量的糖酵解会导致糖酵解代谢物的积累,从而发挥促炎作用。抑制糖酵解及其代谢物可以抑制巨噬细胞 M1 极化,调节炎症反应并恢复免疫稳态。 缺氧诱导因子1a(HIF1a)是决定葡萄糖是通过氧化磷酸化(OXPHOS)或糖酵解消耗的关键因子。然而,在常氧条件下,HIF1a被快速羟化,然后被脯氨酸羟化酶结构域 2(PHD2)降解,PHD2的羟化酶活性受到缺氧和某些分子等多种因素的调节。这些证据为UC的发病机制和治疗提供了新的视角。 4、间充质干细胞(MSCs)移植是一种安全且有前途的基于细胞的UC治疗策略。间充质干细胞被MSCs移植到宿主后,可以通过归巢到损伤组织原位修复受损细胞,也可以通过分泌抗炎细胞因子和趋化因子恢复免疫稳态。 5、局限性:获得骨髓间充质干细胞的方法相当有限,且具有侵袭性。脂肪来源的间充质干细胞(ADMSCs)是一 种从脂肪组织中分离出来的骨髓间充质干细胞。来自腹部 、大腿和臀部的皮下白色脂肪组织是ADMSCs分离最常见的组织来源。与其他类型的骨髓间充质干细胞相比, ADMSCs具有可及性大和组织来源丰富的优点。 多项研究表明,ADMSCs通过发挥抗细胞凋亡和抗炎作用的,可以缓解消化性溃疡和急性损伤。然而,ADMSCs是 否能治疗UC及其潜在的机制尚不清楚 。 研究意义: ① 在本文献中,发现ADMSCs移植移植减轻了dss诱导的结肠炎症,并抑制了M1巨噬细胞的浸润。具体来说, ADMSCs通过减少琥珀酸积累和增加PHD2来发挥这种抑制作用,以防止M1巨噬细胞过表达HIF1a,从而重新编程M1巨噬 细胞的糖酵解途径。 ② M1巨噬细胞分泌的琥珀酸则触发ADMSCs反过来分泌PGE2,从而进一步使巨噬细胞从M1表 型向M2转移。研究结果为UC的治疗提供了一个新的视角。 科学问题 ADMSCs是否能治疗UC及其潜在的机制是什么? 文章框架&技术路线 研究结果及分析 1、ADMSCs的特征: 根据MSC特征和鉴定标准评估ADMSCs的免疫表型。MSCs生物标志物CD90、CD73和CD105在ADMSCs中呈阳性,而白细胞标志物CD45、CD117和CD34均为阴性 。 2、ADMSCs移植可改善dss诱导的结肠炎,并抑制M1 巨噬细胞极化 (1)饮用DSS水溶液可导致小鼠体重持续下降,而ADMSCs移植可显著缓解由 DSS诱导的体重减轻(图2B)。 (2)ADMSCs移植也降低了 DAI评分测量的结肠炎严重程度指数(图2C)。 (3)结肠炎小鼠的另一个典型的形态学改变是结肠长度的减少。发现ADMSCs+DSS组小鼠的结肠长度与对照组小鼠接近,而DSS组小鼠的结肠长度显著减少(图2D)。 (4) 为了更准确地评估结肠炎的严重程度,进行了组织病理学染色和分析。与DSS组相 比,ADMSCs+DSS组小鼠的结肠组织在黏膜侵蚀、隐窝破坏 和炎症细胞浸润方面的组织学评分较少,表明ADMSCs治疗 后结肠炎症显著缓解(图2E) (5)考虑到肠道炎症的发生需要 M1巨噬细胞作为抗原提呈细胞,进一步研究了M1巨噬细胞的百分比(F4/80+诱导型一氧化氮合酶+)的免疫荧光染色法进行检测。值得注意的是,与对照组小鼠相比,结肠 F4/80的百分比+诱导型一氧化氮合酶+在dss处理的小鼠中 ,巨噬细胞显著增加,而在ADMSCs移植后,其比例降低(图 2F)。同时,M1巨噬细胞分泌的促炎细胞因子在ADMSCs处理 后也减少了(图2G)。 这些结果表明,ADMSCs可改善dss诱导 的结肠炎小鼠结肠炎症,抑制M1巨噬细胞极化。 3、ADMSCs通过重编程巨噬细胞中的糖酵解途径来抑制M1的极化 (1)利用ADMSCs和骨髓来源的巨噬细胞(BMDMs)共培养的体外系统,探讨了ADMSCs对M1巨噬细胞发挥抑制作用的潜在机制(图3A)。 (2)在与ADMSCs共培养前,在LPS和IFN-Y 刺激下极化为M1表型。与体内实验结果一致,BMDMs与 ADMSCs共培养时,M1特征的促炎细胞因子iNOS、IL-6和 TNFa的基因表达显著降低,证实ADMSCs在体外也能抑制M1 极化(图3B)。 (3)M1巨噬细胞发挥增强糖酵解,以满足其ATP需求。文献评估了BMDMs的OCR和ECAR值,作为 其OXPHOS和糖酵解的读数。与m1极化的bmdm相比,具有显著性 在与ADMSCs共培养的BMDMs中,OCR增加,ECAR减少,表明 ADMSCs可以抑制BMDMs中的糖酵解途径,减少细胞内ATP的 产生,从而抑制M1极化(图3C) 4、ADMSCs通过琥珀酸依赖的M1巨噬细胞中的 PHD2/HIF1a通路重编程糖酵解 (1)为了进一步研究其潜在的机制,评估了BMDMs的细胞内和细胞外代谢物的含量。在M1-BMDMs中,胞内和胞外的衣康酸和 琥珀酸均随着糖酵解的增强而增加,但只有琥珀酸在ADMSCs处 理后下降,而衣康酸保持不变(图4A,B)。因此,推测 ADMSCs 通过抑制细胞内和细胞外琥珀酸的积累,重新编程M1- BMDMs的糖酵解。 (2)HIF1a是决定葡萄糖是通过OXPHOS或糖酵解消耗的关键因素。当M1-BMDMs与 ADMSCs共培养时,当M1BMDMs共培养时,HMF-1a水平降低( 图4C)。 (3)发现与ADMSCs共培养可以提高PHD2的水 平,而PHD2可以介导HIF1a蛋白的降解,而添加琥珀酸可以 降低PHD-2的水平(图4D)。 (4)糖酵解酶,包括GLUT1、HK2、 LDHA等。在糖酵解中非常重要,因为它们可以促进细胞内葡萄糖的快速摄取和转化。文中发现ADMSCs降 低了m1极化的BMDMs中GLUT1、HK2和LDHA的水平,当短干扰 RNA(siRNA)使HIF-1a沉默时,ADMSCs对糖酵解酶的抑制作用被消除了(图4E)。 5、巨噬细胞来源的琥珀酸触发ADMSCs摄取琥珀酸并分泌pge2,进一步将巨噬细胞从M1表型转移到M2。 (1)鉴于琥珀酸是一种重要的细胞间信号分子,进一步探讨了琥珀酸是否能反过来调节ADMSCs的生理过程。琥珀酸 的主要受体,琥珀酸受体1(SUCNR1),当药物在体外暴露于琥珀酸时没有统计学变化(图5A-C)。 (2)当琥珀酸处理 ADMSCs时,参与琥珀酸转运的SLC13A3和SLC13A5的水平显 著增加,与细胞内琥珀酸浓度的增加一致(图5D,E)。 (3)前列 腺素e2(pge2)是ADMSCs分泌的主要免疫调节因子。测定了ADMSCs培养基中pge2的浓度和前列腺素内过氧 化物合酶2(Ptgs2)的基因表达。在琥珀酸处理后,ADMSCs 中Pge2的浓度和Ptgs2的基因表达均增加,而SC- 58125(Ptgs2阻断剂)的预刺激挽救了琥珀酸诱导的增加(图 5F,G)。 (4)进一步研究了pge2对巨噬细胞极化的影响。这些ADMSCs 琥珀酸预处理后,m1特征细胞因子(iNOS、IL-6和TNF-a)的 基因表达减少,m2特征细胞因子(IL10、Arg1和CD206)的基 因表达增加,而所有这些改变均被SC-58125挽救(图5H)。 这些结果表明,ADMSCs分泌的pge2可以使M1巨噬细胞向M2 表型转移。 文献结论 ADMSCs移植通过重编程巨噬细胞的代谢过程来抑制其M1极化。同时,M1巨噬细胞分泌的代谢物则触发ADMSCs分泌抗 炎细胞因子。我们的研究结果为UC的治疗和MSCs与巨噬细胞之间的相互作用提供了一个新的视角。 文献总结 优点: ADMSCs移植通过重编程巨噬细胞的代谢过程来抑制其M1极 化。同时,M1巨噬细胞分泌的代谢物则触发ADMSCs分泌抗 炎细胞因子。文献的研究结果为UC的治疗和MSCs与巨噬细 胞之间的相互作用提供了一个新的视角。 缺点: 文章结果显示,在ADMSCs治疗后,SUCNR1没有显著差异。文献中推测结肠炎小鼠的SUCNR1信号通路可能是通过增强SUCNR1蛋白活性而激活的,而不是如Gilissen等报道的蛋白水平。SUCNR1信号传导的机制仍有待进一步研究。 文献中涉及的实验技术 关于晶莱 晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),组建了数十名来自全球知名高校的硕博研究生研发团队。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型,为生物医药公司、高校、医药搭建了多管线研发服务平台。 晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。

与国500+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。