
Extracellular vesicle-mediated delivery of circDYM alleviates CUS-induced depressive-like behaviours
细胞外囊泡递载circDYM缓解小鼠抑郁样行为

期刊:Journal of Extracellular Vesicles
发表时间:2022-01-11
影响因子:17.337
研究背景
重度抑郁症(MDD)是世界范围内最普遍的精神疾病,严重限制了患者的心理社会功能和生活质量,已成为仅次于癌症的人类第二大“杀手”。目前临床抗抑郁药物存在起效慢、个体差异大、不敏感等。因此,开发透过血脑屏障靶向脑部的新型抗抑郁药物迫在眉睫。
细胞外囊泡(EVs)是由多种细胞释放的脂质双层膜包裹的纳米级颗粒。可通过传递蛋白质和核苷酸到邻近或远处细胞发挥作用。由于其免疫原性低、毒性低,并能通过血脑屏障,可成为免疫治疗、再生医学和药物输送领域的一种新的治疗方法。
CircRNAs是一类不具有5’ 末端帽子和3’ 末端poly(A)尾巴、并以共价键形成环形结构的非编码RNA分子。circRNAs可以参与调节蛋白表达,DNA甲基化修饰和多肽翻译等。在抑郁症患者和动物模型中,circRNAs表达异常。其中CircDYM (mm9_circ_0007509),在MDD患者和小鼠抑郁模型中低表达

文章框架&技术路线
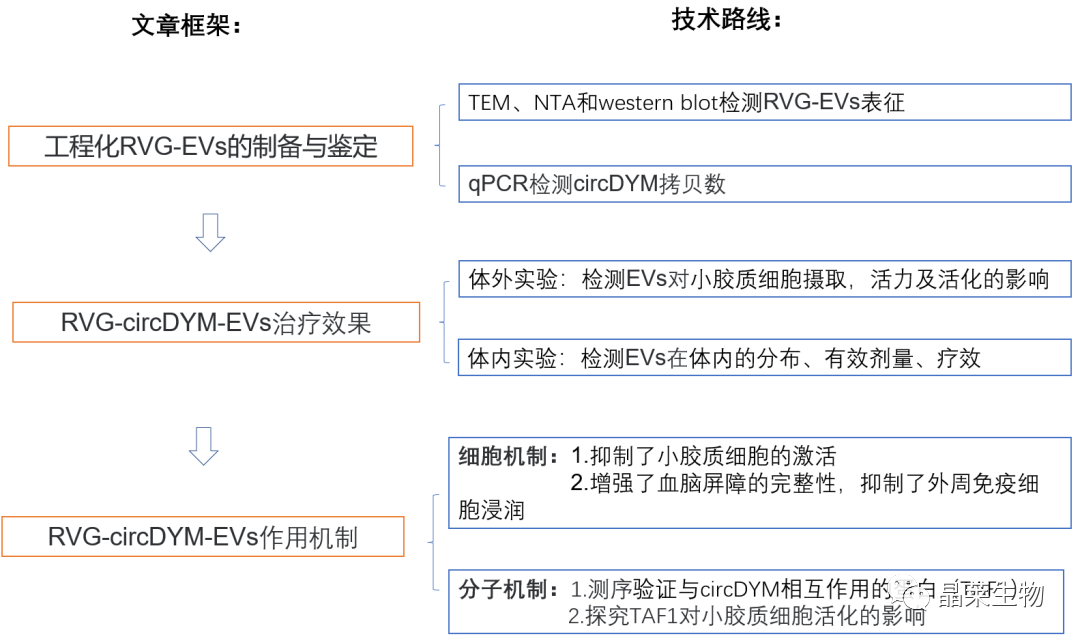
研究结果及分析
1. 工程RVG-EVs的制备和表征
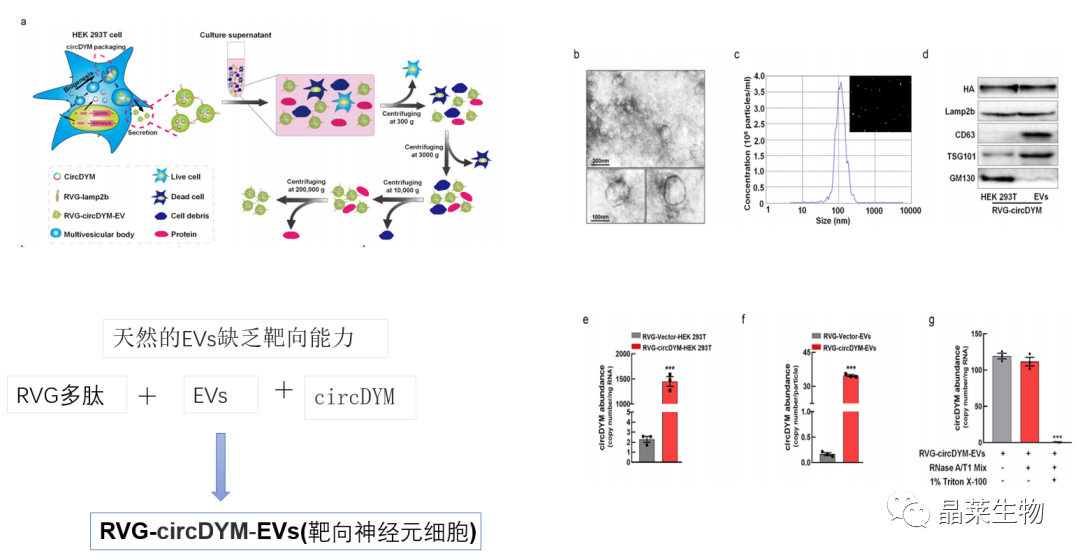
工程RVG-EV的制备和表征。
2. RVG-circDYM-EVs在体外抑制了原代小鼠小胶质细胞的激活
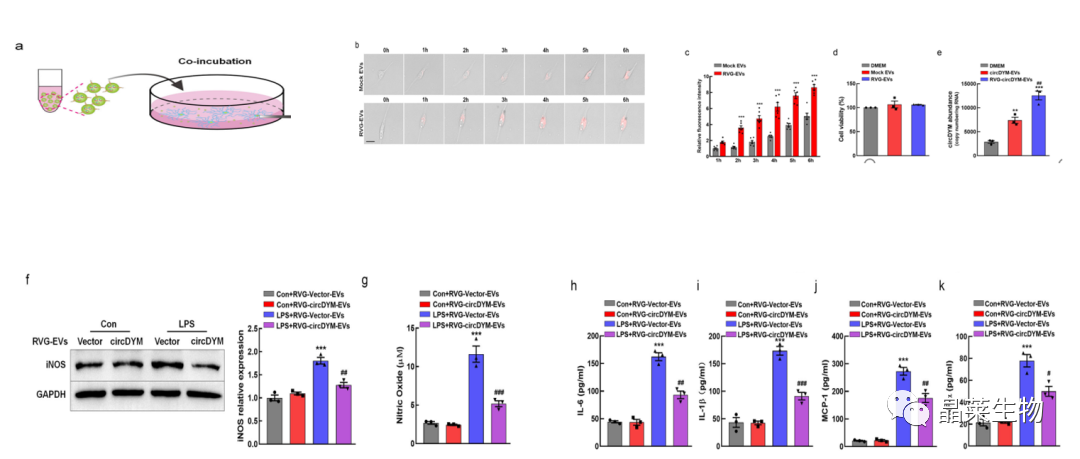
之前有研究表明circDYM通过调节小胶质细胞活化参与MDD过程。
a-e:RVG-EVs与小胶质细胞共培养,能被细胞摄取并且无明显毒性作用;
f-k:LPS诱导后,RVG-circDYM-EVs后能明显抑制小胶质细胞活化和降低炎症因子水平。
为了研究RVG-circDYM-EVs在体外的作用,成功制备了模拟EV、Vector-EV、circDYM-EV、RVG-Vector-EVs或RVG-circDYM-EVs,然后与原代小鼠小胶质细胞共孵育。
3. DiR标记的RVG-EVs在体内的生物分布
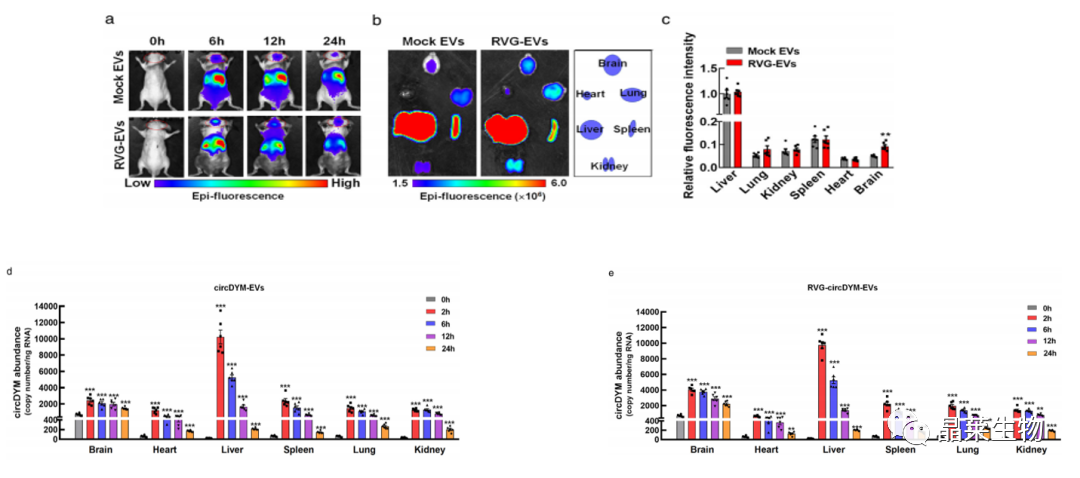
a-c:尾静脉注射RVG-EVs后在小鼠体内的荧光强度和荧光分布;
d-e.:不同时间点小鼠各器官中circDYM的表达水平。
接下来试图追踪RVG-EVs在体内的生物分布。将DiR标记的模拟EV或剂量为200μg的RVG-EV通过尾静脉注射到小鼠中,并采用体内成像系统(IVIS)。
4. RVG-EVs可以有效地将circDYM传递到大脑中
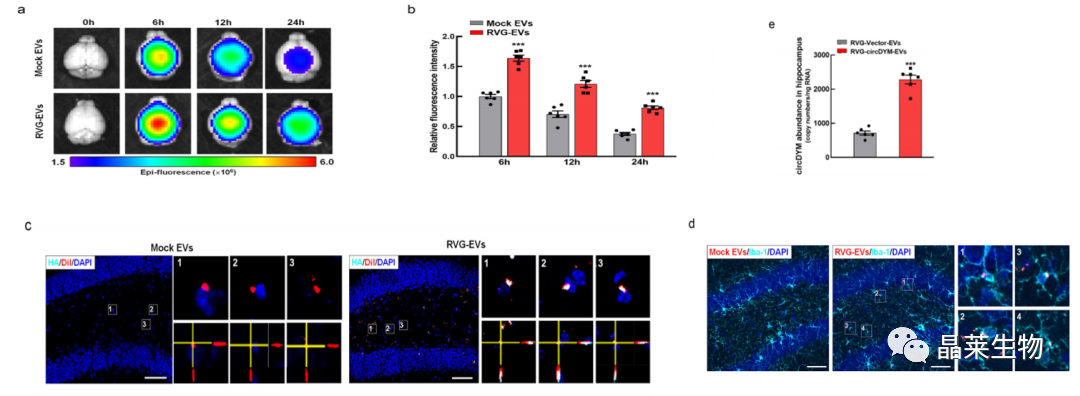
a-b:活体成像观察EVs在大脑荧光的情况;
c:HA标记RVG融合蛋白与Dil标记EVs在小鼠海马共定位;
d:Dil标记EVs与小胶质细胞免疫荧光标记物(Iba-1)在小鼠海马的共同定位证明RVG-EVs有效靶向小胶质细胞;
e:RVG-circDYM- EVs给药24 h后,海马组织circDYM水平显著升高。
为了确认RVG-EVs靶向大脑的能力,使用IVIS监测DiR标记的模拟EV或200μg剂量的RVG-EV进入大脑。
5:不同剂量的RVG-circDYM-EVs对CUS小鼠抑郁样行为的影响
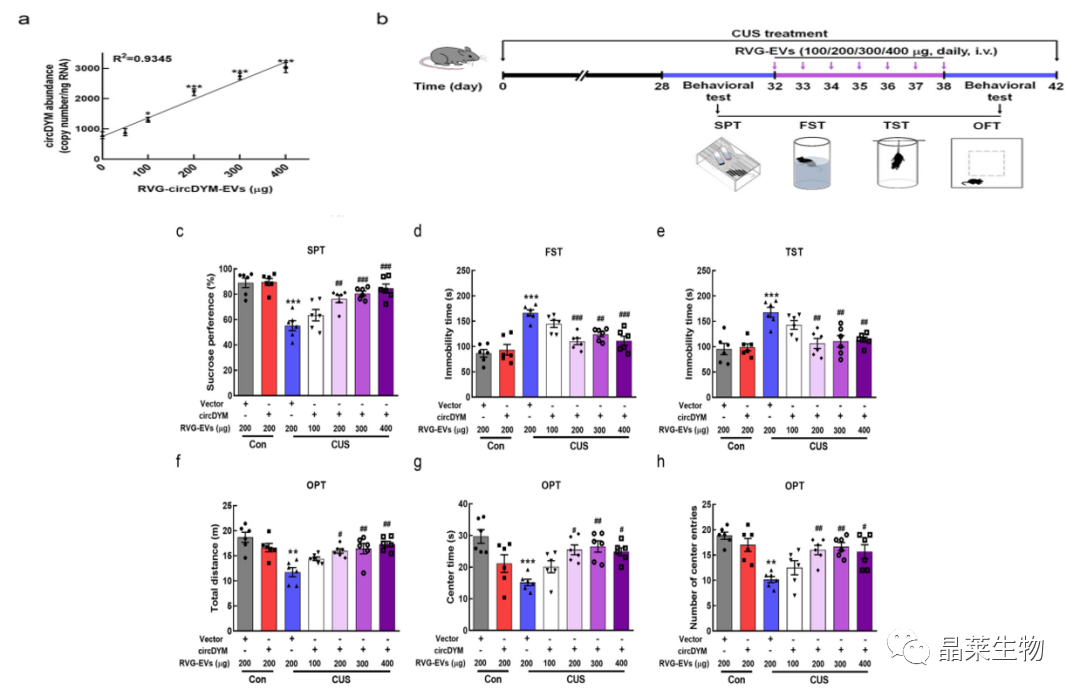
a:RVG-circDYM-EVs以剂量依赖的方式增加circDYM拷贝数;
b-h:RVG-circDYM-EVs给药后,改善小鼠的抑郁样行为,其中200 μg 是最低的有效剂量。
进一步研究工程RVG-EV在体内递送circDYM的效率,将小鼠静脉注射一次不同剂量的RVG-circDYM-EV,并在24小时后测定大脑中的circDYM水平。
6. RVG-EVs介导的circDYM的传递减轻了CUS小鼠的抑郁样行为
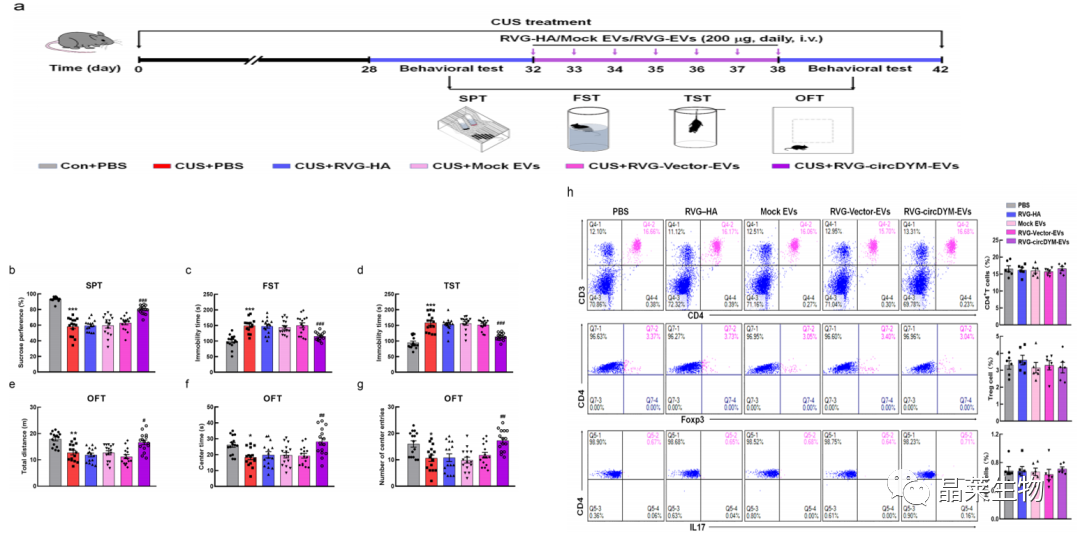
a:为了排除RVG多肽和的EVs影响,增加了RVG组和mock-EVs组;
b-g:行为学检测排除了RVG多肽或Evs具有减轻小鼠抑郁行为的作用;
h:流式检测小鼠外周血CD4+T细胞、调节性T (Treg)细胞和Th17细胞的表达水平。
基于上述,排除了RVG-HA或模拟EV有助于缓解小鼠抑郁行为的可能性。
7. RVG-EV介导的circDYM的传递减弱了小胶质细胞的激活
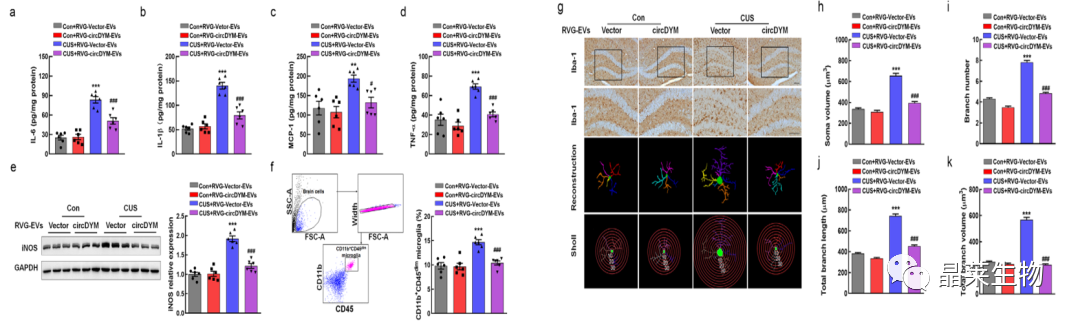
a-d:ELISA检测海马组织中促炎细胞因子表达水平;
e-k:检测海马区小胶质细胞的体细胞大小、分支数量、分支长度、分支体积和活化情况。
由于RVG-circDYM-EV治疗可有效缓解CUS小鼠的抑郁样行为,接下来探索了该过程所涉及的细胞机制。
8. RVG-EVs介导的circDYM的传递减少了CUS诱导的血脑屏障损伤和外周免疫细胞的浸润
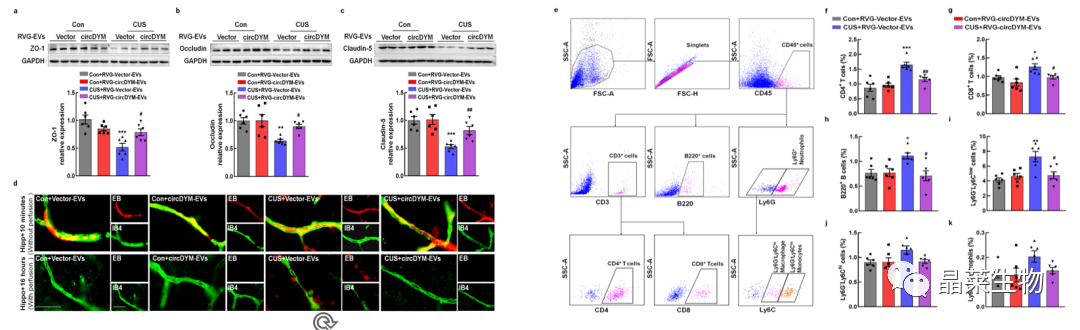
a-c:WB检测脑组织紧密连接蛋白表达;
d:伊文思蓝(EB)检测血脑屏障(BBB)通透性;
i. 流式检测脑组织免疫细胞比例。
RVG-circDYM-EVs增强了血脑屏障的完整性,抑制了外周免疫细胞的浸润。
9. CircDYM直接与TAF结合,调节小胶质细胞的激活
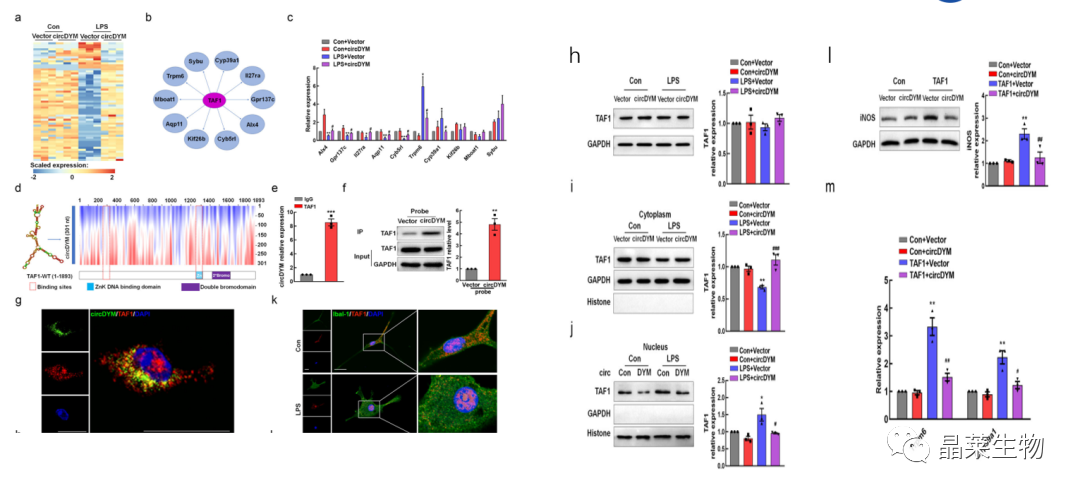
TAF1:转录因子TATA框结合蛋白关联因子1。
a-g:测序,生信分析、RIP、RNA pulldown、FISH证实circDYM与TAF1相互作用、小胶质细胞的细胞质中共定位;
h-j:WB和IF检测circDYM对TAF1的表达和分布影响:circDYM增加了细胞质中的TAF1水平,降低了其在细胞核中的水平;
l:过表达circDYM可减弱TAF1对小胶质细胞活化。
为了确定参与神经炎症的分子机制,在circDYM过表达的原代小鼠小胶质细胞中进行转录组分析。
这些结果表明TAF1可以通过其下游靶基因Trpm<>和Cyp<>a<>调节小胶质细胞活化。
文献结论
工程RVG-EVs可以将circDYM靶向递送到小鼠大脑中,并且显著改善了CUS小鼠模型的抑郁样行为,抑制小胶质细胞活化。
文献总结
创新点:
1.通过构建携带circDYM的细胞外囊泡(RVG-circDYM-EVs),高效地将circDYM通过血脑屏障递载至小鼠脑部,有效地缓解了小鼠抑郁样行为。
2.研究发现circDYM可以通过与转录因子TAF1结合,抑制小胶质细胞的活化,抑制中枢神经炎症,从而达到治疗效果。
文献使用的实验技术

关注公众号,了解更多!
