
脑出血(ICH)是指非外伤性脑实质内血管破裂引起的出血,占据全部脑卒中疾病的20%~30%,脑出血急性期死亡率高达30%~40%。脑出血发病年龄趋于年轻化,严重危害了人们的身心健康。脑出血发病的原因有很多,主要和脑血管的病变有关,同时和高血脂、糖尿病、高血压、血管的老化、吸烟等因素密切相关,是脑血管类疾病中发病急、致死、致残率高的一类脑血管疾病。
实验室动物模型的种类有很多种,常用的有啮齿类、鱼类、灵长类等,研究人员根据所要研究的不同方面选择适合的受试动物。
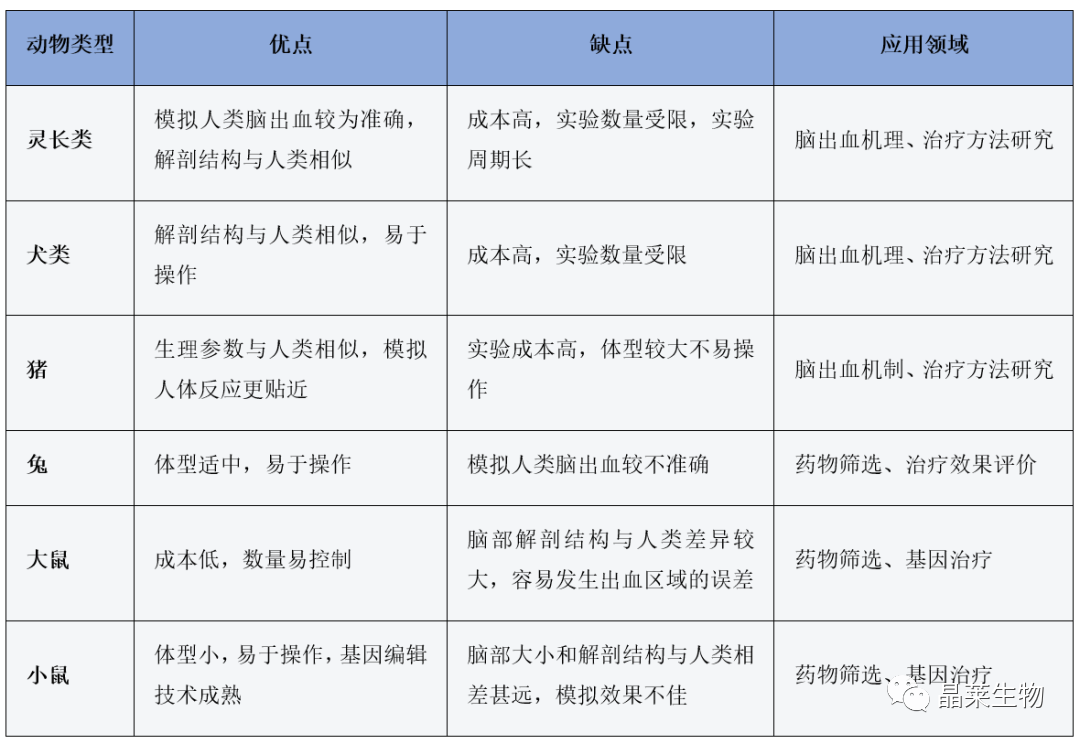
大鼠脑出血动物模型经过科研人员多年的探索,形成了多种不同途径的制作方法,而目前比较常用的大鼠脑出血模型主要包括自体血注入脑出血模型、胶原酶注射脑出血模型、微球囊充盈脑出血模型、自发性(高血压性)脑出血模型等4种脑出血动物模型。
不同脑出血动物模型对比
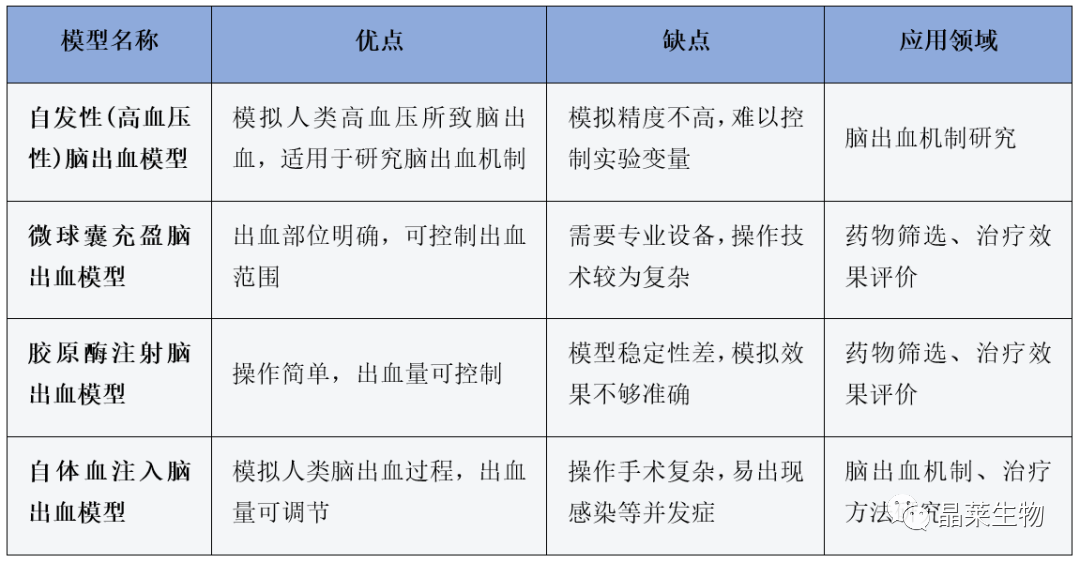
不同脑出血动物模型发病机制及机制蛋白
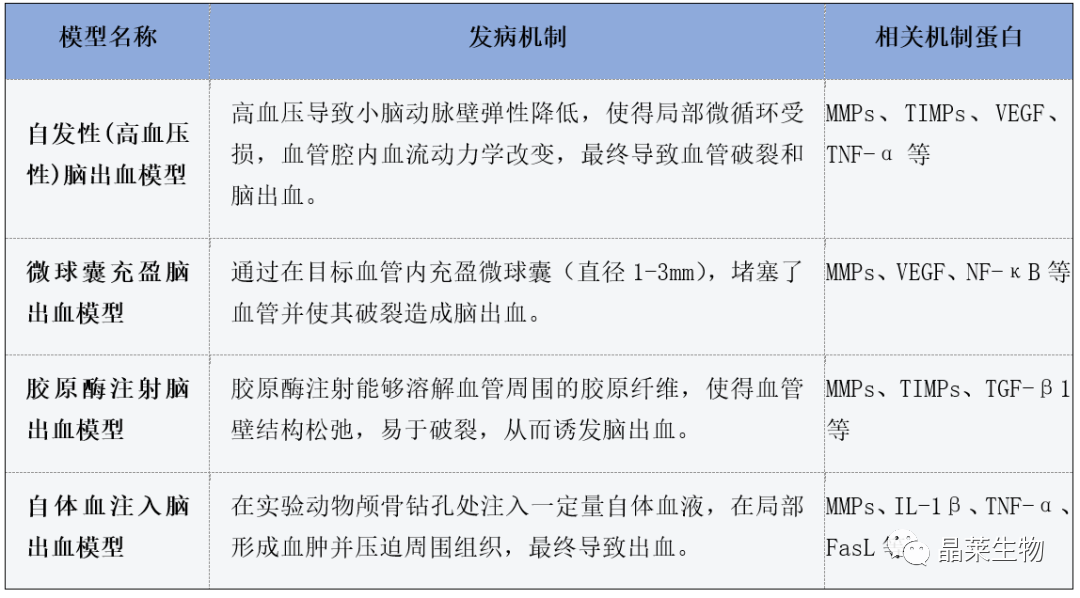
每种脑出血模型的发病机制和相关机制蛋白都不同,也有其独特的特点。在进行相关实验时,不仅需要根据目的选择合适的模型种类,还需要对各种机制蛋白进行分析和评价,以揭示其在脑出血过程中的作用和机制。
自体血注入法制备脑出血模型是目前应用最广泛的一种脑出血模型制备方法,主要是运用注射动物自身(非肝素化)自体血的方式,形成局部脑出血模型。
接下来以此模型为例,从造模方法、操作技巧、注意事项各个方面进行详细的说明。
1. 模型造模
在尾动脉穿刺取血,行二次注血法,具体操作如下:在室温条件下,大鼠用10%水合氯醛腹腔注射麻醉(300mL/kg),将大鼠俯卧位固定于脑立体定位仪上,使门齿沟平面比耳尖线平面低2.4mm,此时前囟和后囟基本保持在同一平面上。固定时先固定耳尖线,听到水平针穿破骨膜的声音后,再移位至正中,接着固定门齿于门齿沟上。
常规备皮消毒头皮正中,在消毒部位正中剪一小口,分离皮下组织,用30%双氧水腐蚀颅骨腱膜及颅骨外膜,暴露前囟及冠状缝,在前囟前0.6mm中线旁3mm处,用电钻钻直径1mm的圆孔,深度达硬脑膜表面,不损及脑组织。用微量注射器取不抗凝自体尾动脉血55μL,然后将微量注射器固定于立体定位仪的上方,将针尖沿钻孔膜垂直进针,深度约6mm,以10μL/min速度缓慢注射20μL血液后静置5Min,再以同样的速度注射剩余的35μL,注射完成后,针尖静置10min后缓慢退针。留针期间用酒精棉球包扎鼠尾端伤口。
退针后,用医用无菌骨蜡封闭骨孔,无出血后缝合头部皮肤,创伤处用碘酚消毒,并喷以青霉素以防感染。
2. 造模技巧
2.1取血方法
实验中多采用的取血方法有:大鼠内眦取血、断尾取血、尾动脉穿刺抽取、股动脉穿刺抽取、心脏穿刺等方法。
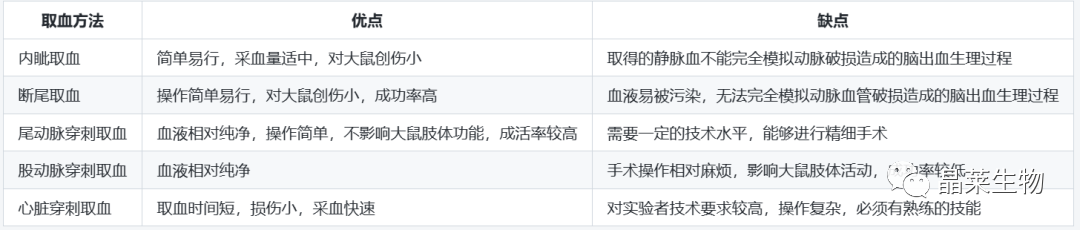
2.2 实验时间
选择造模时间尽量选择冬季,夏季易发生感染,较冬季成活率低。
2.3 麻醉
麻醉时,采用新鲜配置的水合氯醛进行麻醉,尽量做到麻醉量一次到位,否则大鼠手术过程中会出现挣扎,严重影响定位精准度,如剧烈挣扎无法进行手术操作再补麻药时,补充剂量很难拿捏,很容易造成过量麻醉死亡,无形之间增加了实验成本。
2.4 固定
每次使用立体定位仪前,务必校准调零,定位大鼠过程中,一定要将大鼠头部牢固固定,防止手术过程中因大鼠挣扎而使定位不精准、血肿部位有偏差,但同时也要注意不要因固定过紧影响大鼠呼吸,造成大鼠缺氧死亡。
3. 手术过程中操作注意
3.1 钻孔之前
在定位完成后钻孔之前,用黑色记号笔在进针点标记“十”字符号,“十”字交点即为钻孔处,因手术过程中大鼠会出现皮下出血,若出血过多会掩盖已经准确定位的进针点,所以为了避免该情况的发生而影响实验进程,最好定位后标记,节省时间。
3.2 钻孔时
使用电动颅骨钻时,右手持仪器,一定要用左手托着右手,因大鼠颅骨相对较薄,容易钻透,手下稍有落空感即已经钻透。如不用左手抵住,右手悬空,钻透后由于惯性作用会使右手插入脑组织,导致脑组织严重受损,影响实验模型的均衡性同时也对大鼠脑组织造成不可逆的损伤。
3.3 注入自体血时
如果实验采用自体注血法,取血操作应熟练迅速,以免血液凝固,难于注入。注入自体血和胶原酶的过程中,注入的速度一定要缓慢、均匀,该环节也是造模成败的关键环节,如操作不当或注入速度过快而引起脑内压力迅速增高,血肿冲破脑室,严重者可直接致死。
退针过程中操作务必缓慢,并且保证注入后让大鼠静止10min,待血肿形成后缓慢推针,以免注入的自体血或胶原酶沿针道反流或流入蛛网膜下腔,造成模型之间存在差异,影响实验结果。
3.4 术后感染的预防
术后缝合部位碘酒消毒,并腹腔注射青霉素或庆大霉素以防感染,提高模型的成活率,有助于实验能顺利开展。
不同类型的脑出血模型适用于不同的实验需求。在选择实验动物和模型之前,应根据实验目的和需求,综合考虑成本、实验周期、实验数量控制、模拟精度等因素。
关注公众号,了解更多!
