脓毒症(sepsis)是指由感染引起的机体器官功能障碍并且伴有多种细胞因子和炎性介质的诱导、合成和释放的综合征
其发病机制异常复杂,可进一步转变为脓毒性休克 (Septic Shock)、严重脓毒症( Severe Sepsis) ,也是导致多器官功能障碍综合征( Multiple Organ Dysfunction Syndrome, MODS) 的重要原因。
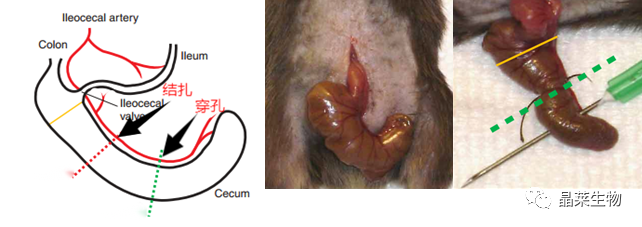
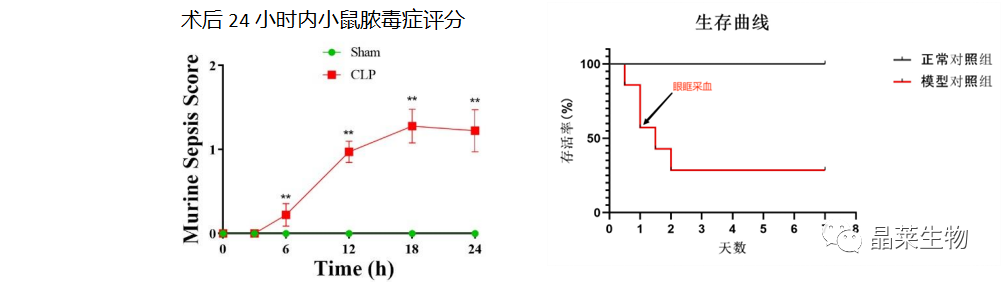
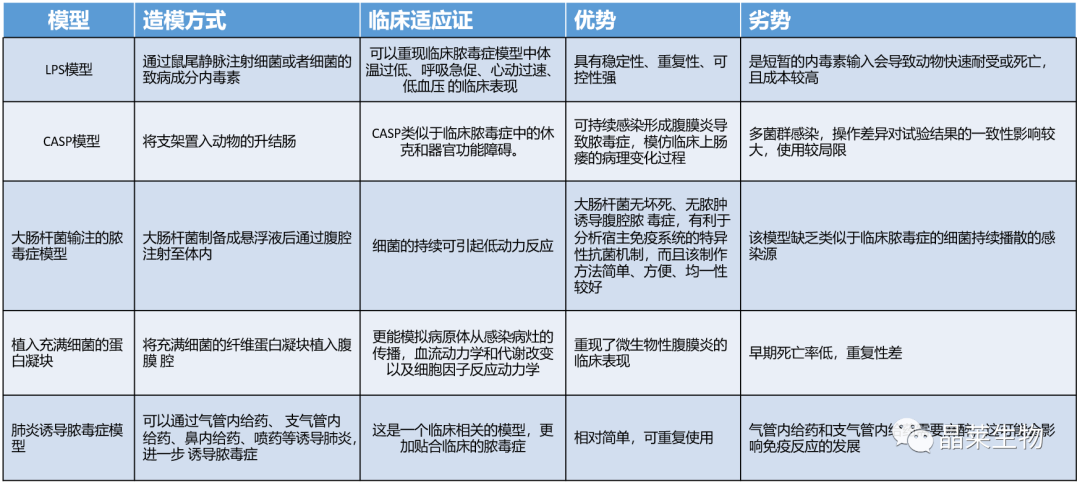
目前的各类文献报道中的常见的脓毒症模型有: (1)内毒素(LPS)模 型; (2)盲肠结扎穿孔(CLP)模 型; (3)结肠支架植入腹膜炎(CASP); (4)大肠杆菌输注的 脓毒症模 型; (5)植入充满细菌的蛋白凝块; (6)肺炎诱导脓毒症模型。 1. 造模原理 CLP模型通过将盲肠结扎穿孔,使腹腔内少量持续溢入混有多种细菌的肠内容物,重现了多菌性腹膜炎的临床特点,同时可呈现出促炎和抗炎免疫反应的激活、 持续的炎性反应、早期高动力和晚期低动力循环状态、 多器官功能障碍及细胞因子反应的类似动力学变化。且通过控制结扎盲肠的长度及穿孔所用针头大小、穿孔数目等因素可调控脓毒症模型动物的死亡率,适于评估腹腔内感染。 2. 操作方法 ①动物分组:C57BL/6雄性小鼠(25-30 g),动物适应性生长一周,随机分为 2 组,对照组和模型组,模型组采用盲肠结扎穿刺法,对照组不做任何处理。 ②用异氟烷麻醉小鼠,用电动剃毛刀去除腹部毛发,并用碘伏对该区域进行消毒。 ③用手术刀纵向切开皮肤中线,识别腹部肌肉组织的白线(中间白色筋膜),并对其进行解剖,以进行肌间切开和筋膜层和腹膜层的切开,使用钝解剖钳定位盲肠,分离盲肠并将其外部化,将小肠和大肠的其余部分留在腹膜腔内,在大多数情况下,盲肠位于腹部左侧。 ④在指定位置对盲肠进行结扎,以获得所需的严重程度等级。 ⑤盲肠穿孔前,将盲肠内容物轻轻推向盲肠远端,在盲肠穿孔时,轻轻吸出任何截留的空气或气体。在结扎和盲肠尖端之间的中间,在肠系膜到反肠方向上,通过单穿和全穿的方式对盲肠进行穿孔。5ml塑料注射器针头 ⑥拔出针头后,从肠系膜和抗肠系膜穿透孔中挤出少量(液滴)粪便,以确保通畅。 ⑦将盲肠重新定位到腹腔中,而不会将盲肠中的粪便扩散到腹壁伤口边缘 ⑧通过简单的连续缝合闭合腹膜、筋膜和腹部肌肉组织。使用金属夹或简单间断缝线缝合皮肤。 3. 结果 ① 小鼠一般状况,接受CLP的动物在手术后的初始阶段看起来很健康,但在CLP后12小时左右,它们开始表现出败血症的临床症状,表现为不适、发烧、发冷、长毛、全身无力和总运动活动减少。致命性始于CLP后18-24小时,表明在上述条件下的CLP代表了急性败血症的快速致死模型。 ② 与对照组相比,脓毒症组大鼠肾小球结构紊乱,球-囊间隙扩大,肾小管细胞水肿; 肝细胞出现 轻度水肿,汇管区有炎性细胞浸润。脓毒症组鼠肝脏和肾脏的病理学评分以及血清 ALT、AST、 BUN、Cr 浓度均高于对照组。 ③ 小鼠脓毒症评分(MSS)标准:从外观、意识水平、活动、对刺激的反应、眼睛、呼吸质量六个方面给术后小鼠评分。 ④ 小鼠炎症反应指标检测:白细胞计数(WBC)、中性粒细胞百分比(NEU %)、 淋巴细胞计数、血小板计数是临床判断炎症反应和免疫状态的主要血常规指标,此外研究发现中性粒细胞/淋巴细胞(NLR)对脓毒症的诊断也有重要的参考价值。 ⑤ 小鼠一般观察:与假手术组小鼠相比,模型组小鼠逐渐出现背毛竖起、精神萎靡、运动迟缓、拒捕反应减弱、眼睛不能全睁、分泌物增多、 呼吸费力等一系列小鼠脓毒症症状。 ⑥ 小鼠炎症反应指标:CLP 组小鼠白细胞计数、淋巴细胞计数和血小板计数均显著减少,中性粒细胞百分比和 NLR 均明显增加。 ⑦ 生存率:对照组鼠全部存活 。CLP组术后重度在3天全部死亡,中度在7天内存活率为50%。 4. 注意事项 ①使用乳胶手套、面罩和手术服作为操作员的防护设备,并保持手术现场的合理无菌。 ②实验必须符合国家和机构关于将动物用于研究目的的规定。 ③用镊子捏脚趾监测麻醉强度。充分的麻醉应导致四肢无反应(例如,四肢无屈曲)。 ④用手术刀纵向切开皮肤中线,注意不要穿透腹膜腔。初次切开后,使用小剪刀延长切口并进入腹膜腔(小鼠,1.5-2厘米;大鼠,3-4厘米)。 ⑤分离盲肠,不要破坏或损坏间质血管。穿孔的时候小心避免刺破血管。 ⑥确保不要结扎回盲瓣,以保持肠道的连续性。结扎的位置决定了脓毒症的强度。 ⑦确保挤压盲肠内容物的量是有限的(小液滴),并且在所有动物中都是相同的,以确保一致性。 ⑧通过保暖使动物复苏。 ⑨每只动物的CLP程序可以由经验丰富的使用者在10分钟内完成,后续的术后护理和数据收集需要额外的时间。 5. 风险评估 ① 死亡率比较高,需要考虑多做动物模型,或者控制一下实验中导致死亡的因素或操作。 ② 在 CLP 手术操作过程中还有许多值得考虑的因素,盲肠结扎长度及穿刺针的大小、数量,使用不同型号的针头,盲肠内容物挤出的量等都会影响成模率。 ③ 鼠类有时太小而不能同一个体连续采血或取组织, 监测血流动力学等操作的技术要求比较高 。 1. 造模原理 脂多糖 ( LPS), 亦称为内毒素, 革兰氏阴性菌细胞壁的一种成分,其毒性成分主要为类脂A,是诱发脓毒症的关键因子。LPS诱导 (腹腔 单次注射 )鼠脓毒症,是脓毒症的重要致病因素,LPS 可以导致机体发生复杂的免疫与炎症反应,生成大量的炎症因子,共同刺激分泌促凋亡蛋白,可引起 肾小管坏死与肾小管细胞的大量凋亡,直接或间接导致肾损伤。 2. 操作方法 ①SD雄性大鼠(25-30 g)。 ②配制LPS溶液。 ③腹腔注射 LPS 12mg/kg 建立脓毒症模型,建立模型后 30 min,每隔 2 h 腹腔注射生理盐水 0.5 ml,共三次。 3. 结果 ① 对照组大鼠状态良好,行为活跃,摄食主动,双眼明亮有神,反应灵敏, 大便呈梭形,皮毛顺滑。脓毒症组大鼠精神萎靡,行动迟缓,摄食减少,双眼 无光,反应迟钝,大便为稀便,皮毛竖立,建立脓毒症模型成功。 ② 模型组鼠水迷宫定位航向实验及空间探索实验结果,在第 4、5、6 天逃避潜伏期明显延长,穿越平台次数明显减少。模型组鼠避暗实验步入潜伏期、错误次数的变化,第 2、3、4 天步入潜伏期明显缩短, 错误次数明显增多。 ③ 称量体重,模型组鼠体重持续下降且在LPS 24h、36h、48h时有显著差异。测量体温经LPS 造模的鼠体温持续下降,并在LPS-12h体温最低。 ④ 鼠血清炎症因子检测,与空白组比较, 模型组血清炎症因子 TNF-α、IL-6 水平明显升高。 4.注意事项 ①注意观察造模后鼠的一般情况。 ②注意LPS剂量、注射方式、造模时间等对脓毒症模型的影响。 ③所造模注射的脂多糖剂量和生物活性( 即4℃的低温保存条件 ) 也是重要的影响因素 之一。 5. 模型应用 ① 炎症性肠病研究:研究该模型可帮助深入了解脓毒症发病机制。 ② 免疫平衡研究:脓毒症所致免疫抑制的主要发病机制。 ③ 脓毒症相关心肌损伤:使用模型深入研究心肌损伤炎症相关信号通路之间的相关性。 ④ 脑功能障碍研究:脓毒症相关性脑病(SAE)非中枢神经系统感染的研究。 关于晶莱 关注公众号,了解更多!