
铁死亡现在被认为是最广泛和最古老的细胞死亡形式之一,因为尽管最初在哺乳动物系统中进行研究,但在进化上遥远的物种中也观察到铁死亡样细胞死亡,例如属于植物、原生动物和真菌界的物种。
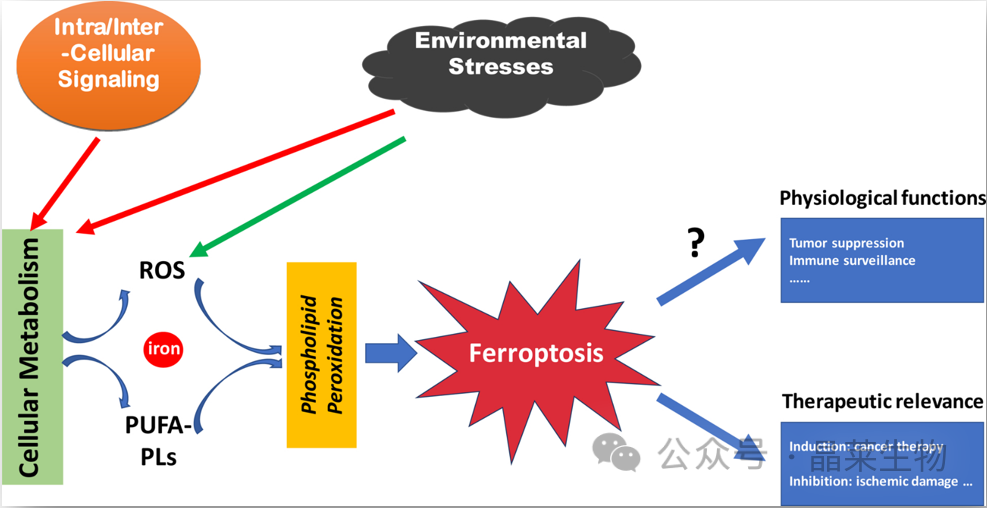
铁死亡概述
铁死亡是通过磷脂过氧化执行的,磷脂过氧化是一个依赖于代谢产物活性氧 (ROS)、含多不饱和脂肪酸链的磷脂 (PUFA-PL) 和过渡金属铁的过程,并且细胞内和细胞间信号转导事件和环境应激可以通过调节细胞代谢和 ROS 水平来影响铁死亡。上图还体现了铁死亡在疾病中的作用及其潜在的生理功能。
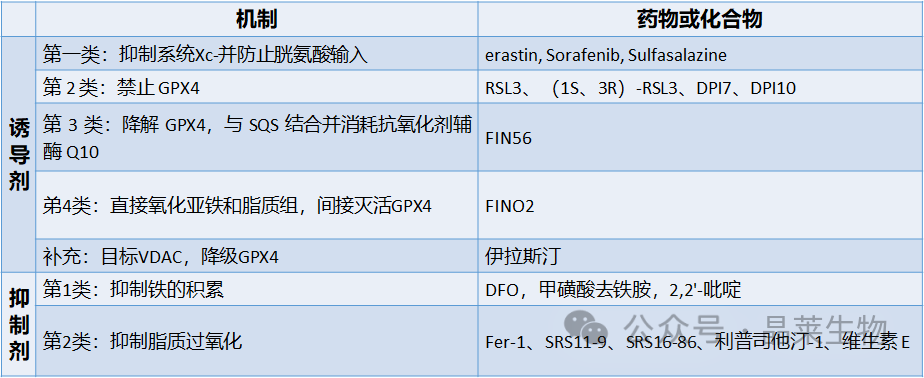
1. 铁死亡抑制途径
近年来研究发现了胱氨酸/谷氨酸反向转运体-GSH-GPX4通路在抑制铁死亡中的作用,目前磷脂氢过氧化物(PLOOHs,一种基于脂质的ROS形式)被确定为是铁死亡的执行者。近期又发现了GPX4非依赖性的铁死亡监控通路。
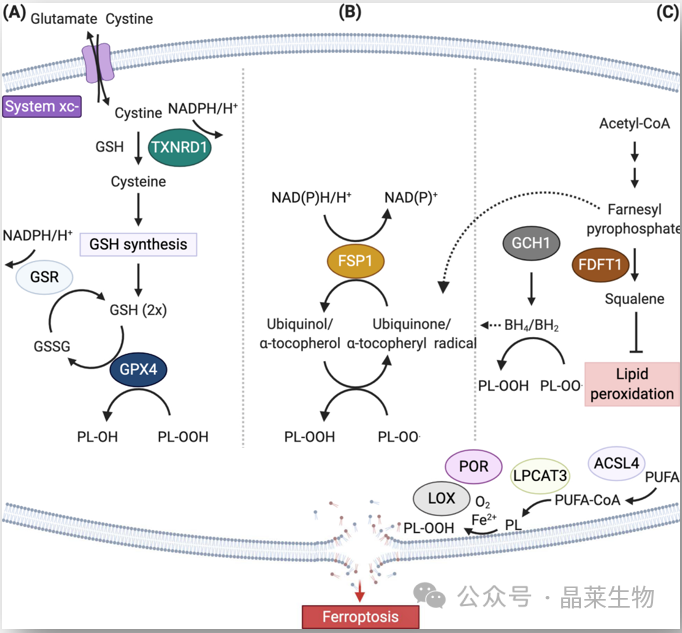
缩写:ACSL4,酰基辅酶A合成酶长链家族成员4;FDFT1,法呢基二磷酸法呢基转移酶1;GCH1、GTP环水解酶1、LOX、脂氧合酶;LPCAT3溶血磷脂酰胆碱酰基转移酶3,POR,细胞色素P450氧化还原酶,PUFA,多不饱和脂肪酸。
A. 典型的铁死亡控制轴( GPX4 调节铁死亡途径)需要通过胱氨酸-谷氨酸逆向转运蛋白摄取胱氨酸,称为系统 xc−、谷胱甘肽 (GSH) 和/或硫氧还蛋白还原酶 1 (TXNRD1) 依赖性胱氨酸还原为半胱氨酸、GSH 生物合成和谷胱甘肽过氧化物酶 4 (GPX4) 介导的磷脂氢过氧化物还原 (PL-OOH) 产生相应的醇 (P-LOH)。氧化谷胱甘肽 (GSSG) 的回收是通过谷胱甘肽-二硫化物还原酶 (GSR) 利用 NADPH/H 提供的电子实现的。
B. 在两个独立的遗传学筛选中,FSP1/泛醌(CoQ+10)系统被发现可以完全防止由GPX4的药理学抑制或基因缺失诱导的铁死亡。与 GPX4/GSH 不同,FSP1 通过在脂质自由基水平上还原泛醇/α-生育酚来防止脂质过氧化和相关的铁死亡。
C. 其他铁死亡抑制机制包括角鲨烯和二氢/四氢生物蝶呤(BH2/BH4)介导的脂质过氧化抑制,其化学机制仍有待证实。
2.磷脂过氧化的机制
脂质过氧化是铁死亡的标志,以非酶促和酶促方式发生(用虚线框标记)。对于后者,脂氧合酶 (LOX) 和/或细胞色素 P450 氧化还原酶 (POR) 已被暗示通过脂质双氧合启动脂质过氧化过程,尽管缺乏明确的遗传证据证明脂氧合酶参与铁蛋白合成过程。脂质过氧化可分为三个阶段,即起始、增殖和终止,如不同颜色的箭头所示。
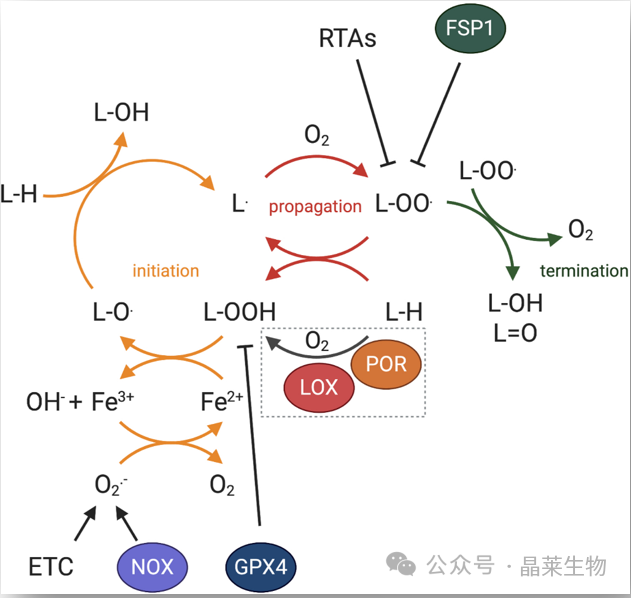
脂质过氧化抑制系统(涉及酶和小分子)作用于脂质过氧化级联反应的不同水平(缩写:ETC,电子传递链;FSP1,铁死亡抑制蛋白1;铁2+、铁、铁3+、三价铁、GPX4、谷胱甘肽过氧化物酶;LOX,脂氧合酶;POR,细胞色素P450氧化还原酶;L•, 脂质自由基;L-H, 脂质;L-O•, 烷氧基自由基;L-OO•,过氧自由基;L-OH,脂醇;L=O,脂羰基,NOX,NADPH氧化酶;哦−氢氧根离子;O2·−、超氧阴离子;RTA,自由基捕获抗氧化剂)。
非酶促的、铁依赖性的芬顿链反应可能对铁死亡至关重要:当 GPX4 被抑制时,PLOOH 可以持续更长时间,引发 Fenton 反应以快速扩增 PLOOHs,这是铁死亡的标志。
3. 细胞代谢和铁死亡
铁死亡中的代谢和细胞信号传导。该图描绘了多种代谢事件(如脂肪生成、自噬和线粒体 TCA 循环)和信号通路(如 E-钙粘蛋白-NF2-Hippo-YAP 通路、葡萄糖调节的 AMPK 信号传导以及 p53 和 BAP1 抑癌基因功能)对铁死亡的调节。
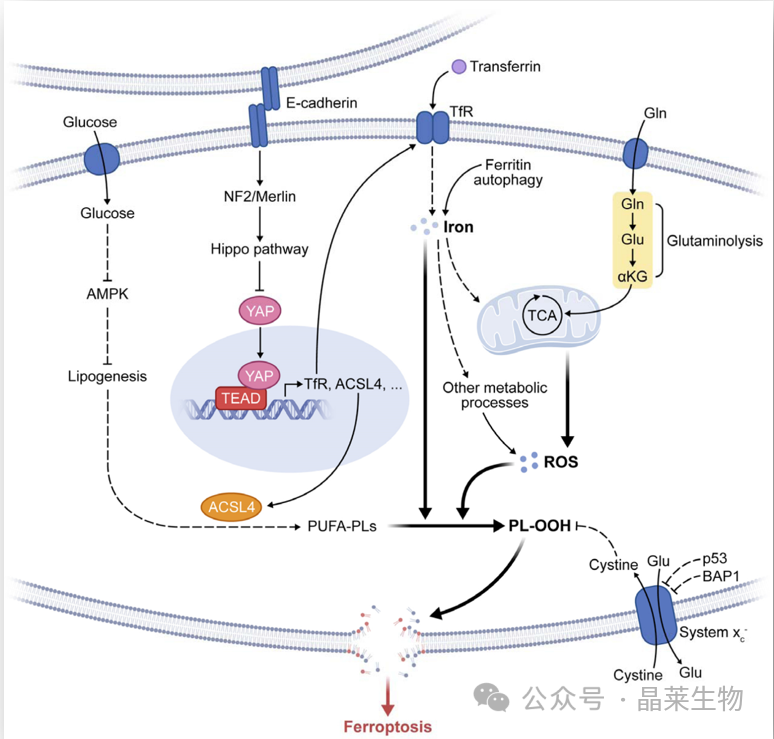
缩写:TfR,转铁蛋白受体;PL-OOH,磷脂过氧化氢;PUFA-PL,多不饱和脂肪酸链磷脂;ROS:活性氧;TCA,线粒体TCA循环;Gln,谷氨酰胺;Glu,谷氨酸;αKG,α-酮戊二酸。
研究发现在氨基酸饥饿(一种触发有效自噬的条件)时,自噬促进了一种快速的非凋亡、非坏死形式的细胞死亡,但仅仅是在细胞处于血清充足的完全培养基的前提下。他们随后发现,这种形式的细胞死亡需要铁载体转铁蛋白和血清中的氨基酸谷氨酰胺,而从细胞培养基中去除胱氨酸则足以触发细胞死亡。因此,这种类型的细胞死亡(即铁死亡)是由半胱氨酸缺乏(类似于erastin)诱导的,并依赖于转铁蛋白。在胱氨酸缺乏的情况下,自噬通过降解铁蛋白(也称为铁自噬)导致细胞内不稳定铁含量上升,从而使细胞对铁死亡敏感,诱导铁死亡。
铁死亡、细胞凋亡、自噬和
坏死性凋亡的特征对比
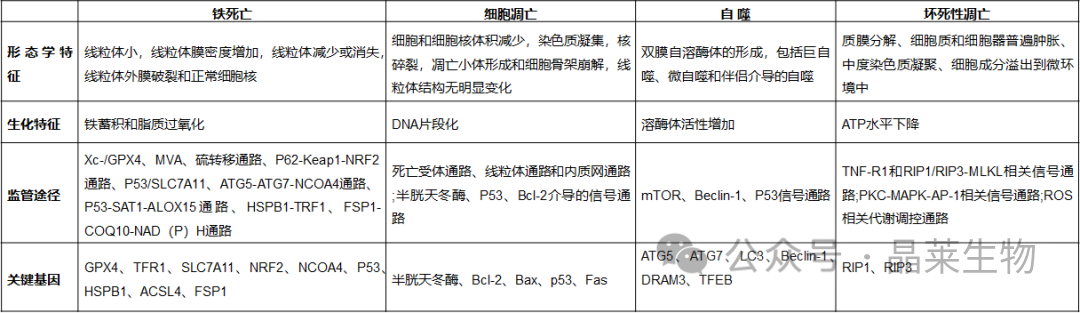
缩写:ACSL4酰基辅酶A合成酶长链家族成员4,ALOX-15花生四烯酸脂氧合酶15,AP-1激活蛋白-1,ATG5自噬相关5,ATG7自噬相关7,辅酶Q10,DRAM3损伤调节自噬调节因子3,FSP1铁死亡抑制 蛋白1,GPX4谷胱甘肽过氧化物酶4,HSPB1热休克蛋白 β-1,Keap1 Keleh样ECH相关蛋白1、MAPK丝裂原活化蛋白激酶、MLKL混合谱系激酶结构域样蛋白、雷帕霉素mTOR哺乳动物靶标、MVA甲羟戊酸、LC3微管相关蛋白1轻链3、NCOA4核受体共激活因子4、NRF2核因子红细胞2相关因子2、PKC蛋白激酶C、RIP受体相互作用丝氨酸/苏氨酸激酶、ROS活性氧、SAT1亚精胺/精胺N1-乙酰转移酶1、SLC7A11溶质载体家族7成员11、系统Xc-半胱氨酸/谷氨酸转运蛋白受体、TFEB转录因子EB、TFR1转铁蛋白受体1、TNF-R1肿瘤坏死因子R1。
参考文献:
1.Ferroptosis: mechanisms, biology and role in disease.Jiang X 1, Stockwell BR 2, Conrad M.Nature reviews. Molecular Cell Biology, 25 Jan 2021, 22(4):266-282
2.Ferroptosis: past, present and future.Jie Li, Feng Cao, He-liang Yin, Zi-jian Huang, Zhi-tao Lin,Ning Mao, Bei Sun & Gang Wang.Cell Death & Disease volume 11, Article number: 88 (2020)
关于晶莱
关注公众号,了解更多!
