
根据经验的积累,小编结合案例对流式检测的常见问题和解决方案做了补充,具体如下:
1. 信号补偿不正确:
检查流式细胞仪上单色阳性对照是否设置正确,以及门控和补偿设置是否正确,确保能捕获所有事件。
2. 补偿过高/增益过低:
使用阳性对照正确设置流式细胞仪,利用补偿确保细胞的荧光信号不被切断,提高增益以增强信号(在合理范围内,应谨慎操作)。
3. 抗体问题:
抗体可能存放太久或没有避光,导致荧光淬灭。此外,一抗和二抗可能不匹配,应确保使用的二抗与一抗来源种属不同。
选择一抗(主要抗体)和二抗(次要抗体或荧光标记抗体)时,必须考虑它们的种属特异性。下面是一个根据不同种属差异选择一抗和二抗的示例表格:
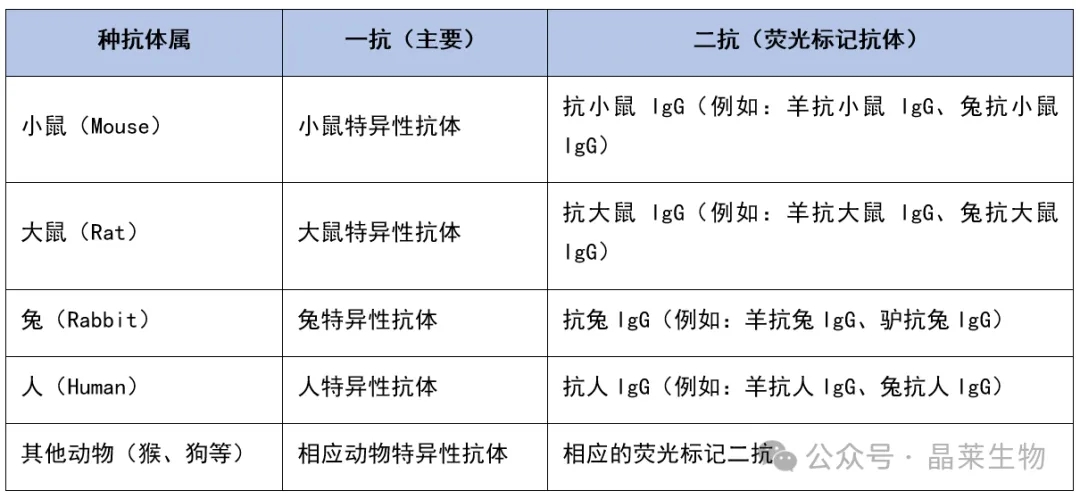
在选择一抗时,需要根据目标抗原和种属特异性来挑选。例如,如果要检测小鼠细胞上的抗原,则应该选择小鼠特异性的一抗。
在选择二抗时,需要确保二抗能够识别一抗的来源。例如,如果一抗是小鼠来源的IgG,那么二抗应该是抗小鼠IgG的。此外,二抗通常带有荧光标记(如FITC、PE、APC等),以便于在流式细胞仪上检测。
1. 抗体工作浓度过高:
摸索抗体最佳使用浓度,做抗体滴定实验,减少每个样本中添加的抗体量,以避免强非特异性结合或高荧光强度。
2. 非特异性结合:
抗体的非特异性结合能力较强,增加FC受体封闭试剂,减少抗体FC段对细胞表面FC受体的非特异性结合。
1. 细胞固定和透化:
不适当的固定和透化条件可能导致细胞结构破坏,从而影响抗原与抗体的结合。因此,应根据所使用的抗体和细胞类型优化固定和透化条件。
2. 细胞存活率问题:
如果样本中存在大量死细胞,可能会影响流式结果。确保样本处理过程中细胞的存活率,并在流式分析时设置适当的门控来排除死细胞。
3. 样本污染:
确保样本在处理和存储过程中无污染,包括细菌、真菌和其他污染物。
在进行多色流式实验时,不同荧光染料之间可能存在颜色重叠的问题。这可能导致信号间的干扰和误读。为了避免这种情况,应选择光谱重叠较小的荧光染料,并使用流式细胞仪的补偿功能来纠正染料间的干扰,根据所要检测指标的表达强弱配置合适荧光强度的荧光素标记抗体。
不同的样本批次之间可能存在差异,如细胞密度、细胞大小、抗原表达水平等。这些差异可能影响流式结果的准确性和可重复性。为了减少批次差异,建议在实验设计中包含相应的对照样本,并使用标准化方法来处理和分析数据。
在流式实验中,非特异性结合是一种常见的干扰因素。这可能导致背景信号升高,影响对抗原表达的准确测量。为了减少非特异性结合,可以使用封闭剂(如FCS、BSA等)来封闭抗体与细胞表面非特异性结合位点,并优化抗体的浓度和孵育时间。
背景噪声是流式实验中另一个需要注意的问题。它可能来自于仪器本身、样本处理过程中的污染、非特异性结合等因素。为了减少背景噪声,需要保证实验环境的清洁和无菌操作,使用高质量的试剂和耗材,并合理设置仪器的参数和阈值。
样本的处理和保存对流式细胞术实验的结果有着显著影响。不正确的样本处理可能导致细胞死亡、抗原丢失或降解。因此,需要遵循严格的样本处理流程,包括正确的采集、运输、保存和标记样本。对于需要长期保存的样本,应使用适当的保存方法和条件,如低温冷冻、添加保护剂等。

晶莱生物

关于晶莱
关注公众号,了解更多!
