
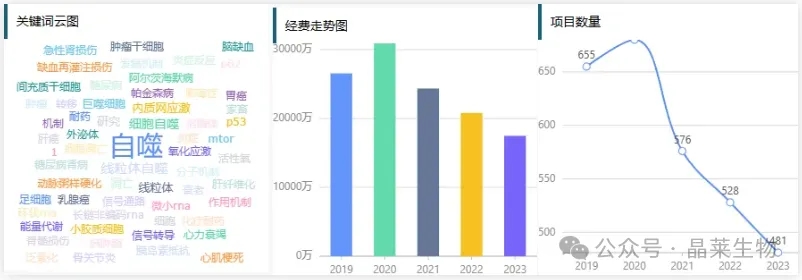
在近3年国自然的中标项目中自噬项目数量每年都有增长,说明国家对自噬研究的重视程度也逐年加强。
自噬(autophagy=self-eating)意为自体吞噬,是真核细胞在自噬相关基因(autophagy related gene,Atg)的调控下利用溶酶体降解自身细胞质蛋白和受损细胞器的过程。自噬可防止细胞损伤,促进细胞在营养缺乏的情况下存活,并对细胞毒性刺激作出反应。自噬包括生理条件下的基础型自噬和应激条件下的诱导型自噬。前者是细胞的自我保护机制,有益于细胞的生长发育,保护细胞防止代谢应激和氧化损伤,对维持细胞内稳态以及细胞产物的合成、降解和循环再利用具有重要作用;但自噬过度可能导致代谢应激、降解细胞成分,甚至引起细胞死亡等。研究表明,自噬能在细胞稳态、衰老、免疫、肿瘤发生及神经退行性疾病等多种生理病理过程中发挥重要作用。
根据包裹物质及运送方式的不同可将自噬分为3种类型:
①巨自噬(macroautophagy):通过形成具有双层膜结构的自噬体(autophagosome)包裹胞内物质,最终自噬体与溶酶体融合。一般情况下所说的自噬是指巨自噬。
②微自噬(microautophagy):通过溶酶体或液泡表面的形变直接吞没特定的细胞器。
③分子伴侣介导的自噬( CMA):具有KEFRQ样基序的蛋白在HSP70伴侣的帮助下,通过LAMP-2A转运体转运到溶酶体。
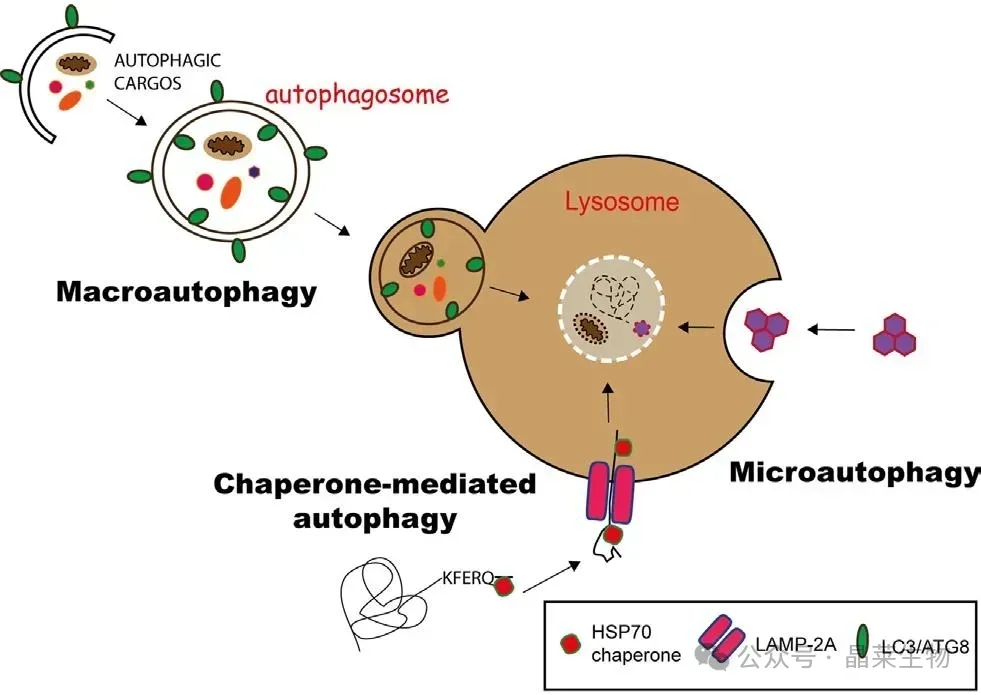
3种自噬途径
自噬机制的降解性自噬反应、自噬阻断
和非自噬功能
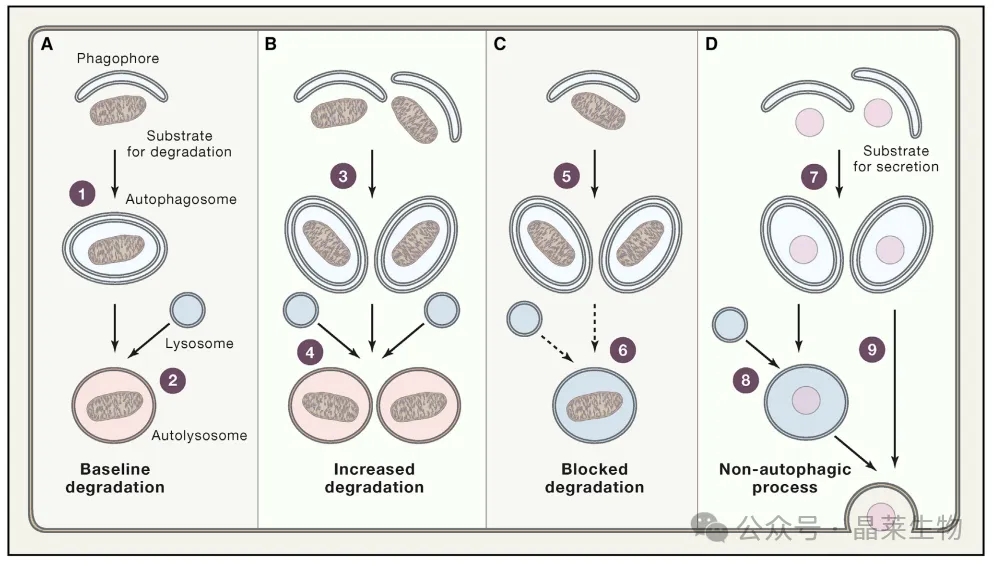
A. 在生理条件下,自噬体以基线速率形成①并成功地与溶酶体②融合,表明自噬支持正常细胞功能的能力。
B. 在存在自噬刺激(如营养剥夺)的情况下,自噬体形成③、自噬体与溶酶体融合和溶酶体降解的速度增加④,导致自噬底物的降解加速。
C. 当溶酶体功能受到抑制⑥时,如溶酶体抑制剂存在时,在没有上游自噬刺激⑤的情况下,自噬体也会积累。
D. 最后,在上游刺激⑦的驱动下,当自噬体内容物注定要分泌时,在⑧或⑨与溶酶体融合时,在没有溶酶体降解的情况下,自噬体室室扩大。
因此,广泛使用的仅基于LC3成熟的检测不仅无法确定与基线相比自噬体室室的扩大(A)是否反映了上游自噬激活与高效溶酶体降解(B)或下游自噬体-溶酶体融合或溶酶体酸化的抑制(C),而且也无法确定上游自噬相关信号模块激活介导非自噬作用的情况(D)。
1. 典型的自噬反应,最好的例证是饥饿驱动的自噬
可以大致分为五个阶段:
① 起始;
② 吞噬细胞成核;
③ 吞噬细胞扩张和底物选择;
④ 自噬体-溶酶体融合;
⑤ 溶酶体底物降解。
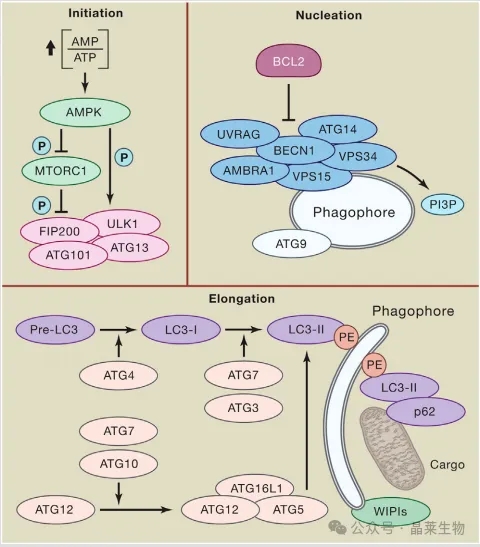
在起始过程中,营养物质可用性降低所带来的生物能量胁迫表现为AMP水平的增加,导致AMPK的激活和随后的①雷帕霉素(MTOR)复合物1 (MTORC1)的机制靶点磷酸化失活和②直接激活磷酸化或间接激活去磷酸化(由于MTORC1抑制)参与起始(如ATG13, ULK1)和成核(如ATG14, AMBRA1, UVRAG,BECN1)。
在这种情况下,ULK1作为包含ATG13、ATG101和FIP200的多蛋白复合物的一部分起作用。ULK1-、AMPK-和mtorc1相关的磷酸化/去磷酸化事件触发吞噬细胞成核(主要在内质网),通过具有III类PI3K活性的超分子复合物产生PI3P,该复合物由VPS34(催化亚基)、VPS15、BECN1、AMBRA1和/或UVRAG组成,再加上含有atg9的囊泡的募集。该复合物的活性受到BCL2的强直抑制,反映了BCL2与BECN1进行物理抑制相互作用的能力。
吞噬体延伸涉及两个泛素样结合系统。一方面,ATG7和ATG10依次作用,催化ATG12-ATG5:ATG16L1复合物的形成。另一方面,ATG4、ATG7和ATG3合作,将lc3样蛋白的前体切割成成熟形式,然后结合到磷脂酰乙醇胺(PE)上,并在WIPI蛋白的支持下招募到自噬体上形成。LC3和LC3同源物使自噬体具有结合自噬底物和/或介导货物选择性的蛋白质的能力(包括p62)。事实上,虽然对营养剥夺的自噬反应相对而言是非选择性的,但自噬的多种其他变体表现出精致的底物特异性。关闭时,自噬体与溶酶体融合产生自溶酶体,通常随后是腔内酸化和随后介导底物降解的溶酶体水解酶的激活。
自噬分子机制的多个组成部分介导非自噬功能,这些功能与细胞膜的重排和运输有关,独立于真正的自噬反应。在这种情况下,不同的超分子实体可以聚集在驱动自噬(A)的III类磷脂酰肌醇3-激酶复合物的组分周围,以差异地调节特定的非自噬功能,包括lc3相关的吞噬(C)、内吞(C)、黑色素生成(D)、细胞分裂(E)和GA-to-ER转运(F)。
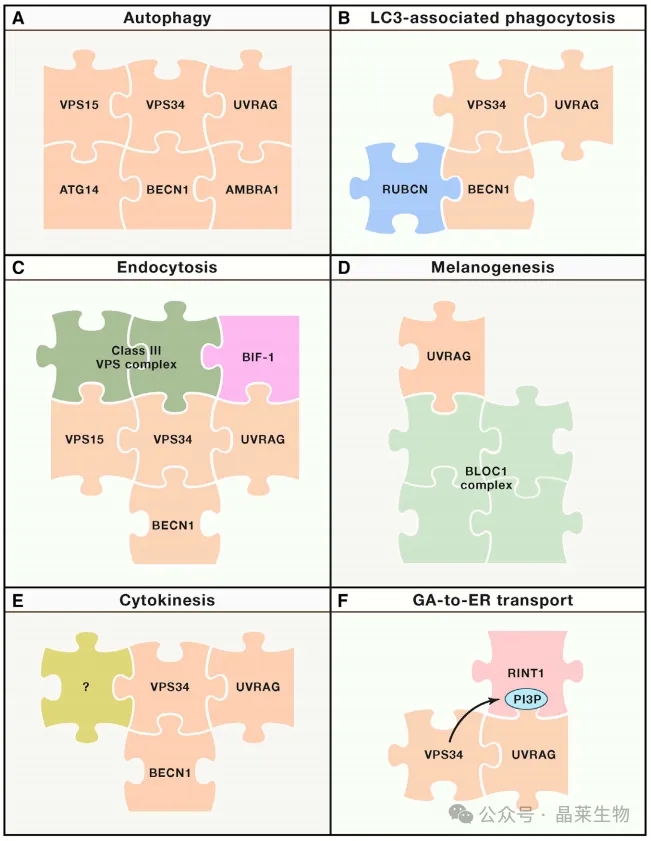
ER:内质网;GA:高尔基体;PI3P: 3-磷酸磷脂酰肌醇.
自噬装置的非自噬功能大量的自噬相关蛋白介导与膜生物学和其他细胞功能相关的非自噬作用。这些蛋白质中的许多在真正自噬反应的早期阶段起作用(例如,起始,成核和延伸)。
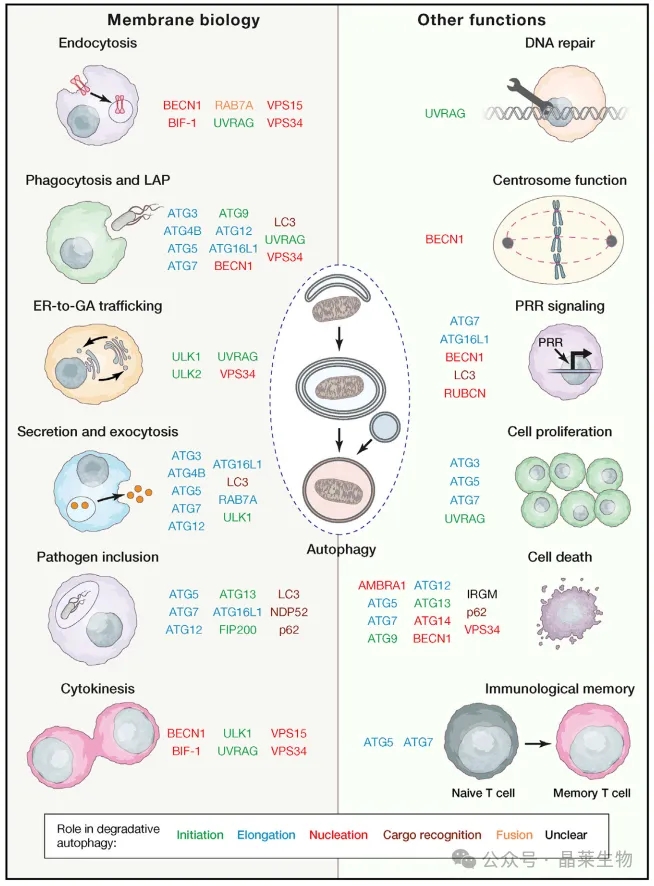
ER:内质网;GA:高尔基体;LAP:lc3相关吞噬;PRR:模式识别受体。
调节LC3或自噬机制的其他成分,以一种不依赖自噬的方式劫持细胞膜进行病毒复制,这是一种非常常见的机制(据估计,36%的自噬相关细胞蛋白质组影响一种或多种病毒的复制,而不考虑自噬降解),除肠病毒外,多种RNA病毒共享这种机制。
1. 透射电镜法
自噬体属于亚细胞结构,普通光镜下看不到,直接在透射电镜下观察自噬不同阶段的形态变化是一种非常直接的方法。

2. 荧光显微镜观察法
LC3全称MAP1LC3 ,贯穿整个自噬过程,是目前公认的自噬标记物。哺乳动物的LC3可分为三种:LC3A、LC3B和LC3C。其中,LC3B应用广泛。
3. Western Blot检测LC3和p62蛋白的表达量
① 利用Western Blot检测LC3-II/I比值的变化评价自噬形成.
② 利用Western Blot检测p62蛋白的表达量也可以评价自噬水平。
4. 基于Keima蛋白的自噬评价
Keima是一种pH敏感型荧光蛋白,利用它在中性和酸性pH中荧光信号不同的特性,可以直观地反映自噬程度。将细胞质的Keima传递到溶酶体可反映非选择性自噬,将Keima融合到特定的蛋白(如融合到线粒体靶向序列—mt-Keima)可用于反映选择性自噬。值得注意是,基于keima的检测不能在固定细胞中进行,因为这种检测完全依赖于溶酶体的酸性。
综上所述,自噬是溶酶体降解细胞质实体的关键过程,与其他几种生物功能高度相关。这种联系不仅反映了真正的自噬反应在维持代谢稳态中的关键作用,也反映了多种自噬相关蛋白介导非自噬功能的能力。
晶莱生物
以上信息来源于文献和网络,如有侵权请联系客服删除。
关于晶莱
关注公众号,了解更多!
