

类器官是一种三维(3D)细胞结构,可来源于胚胎干细胞(ESCs)、多能诱导干细胞(iPSCs)、成体干细胞(SSCs)和肿瘤细胞。
类器官技术是近年来生物医学领域最具突破性的前沿技术之一。作为组织干细胞在体外三维培养所形成的微型器官,类器官在组织结构、细胞类型和功能等方面与来源组织高度一致,为生物医学基础研究、药物研发以及临床精准医疗提供了理想模型,并在再生医学中展现出重要潜在价值。
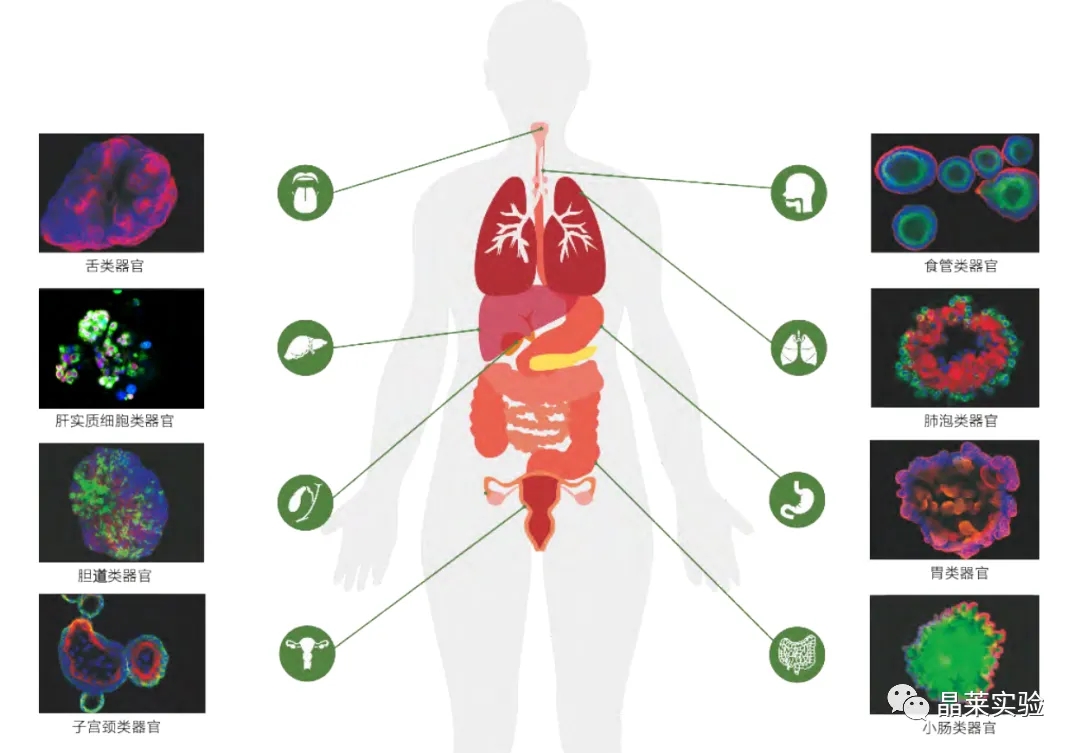
不同正常组织来源的类器官
类器官可从成体组织干细胞培养得到,还可从胚胎干细胞或诱导多能干细胞定向分化得到,它们都利用了干细胞在合适组织微环境中无限扩增的潜力。
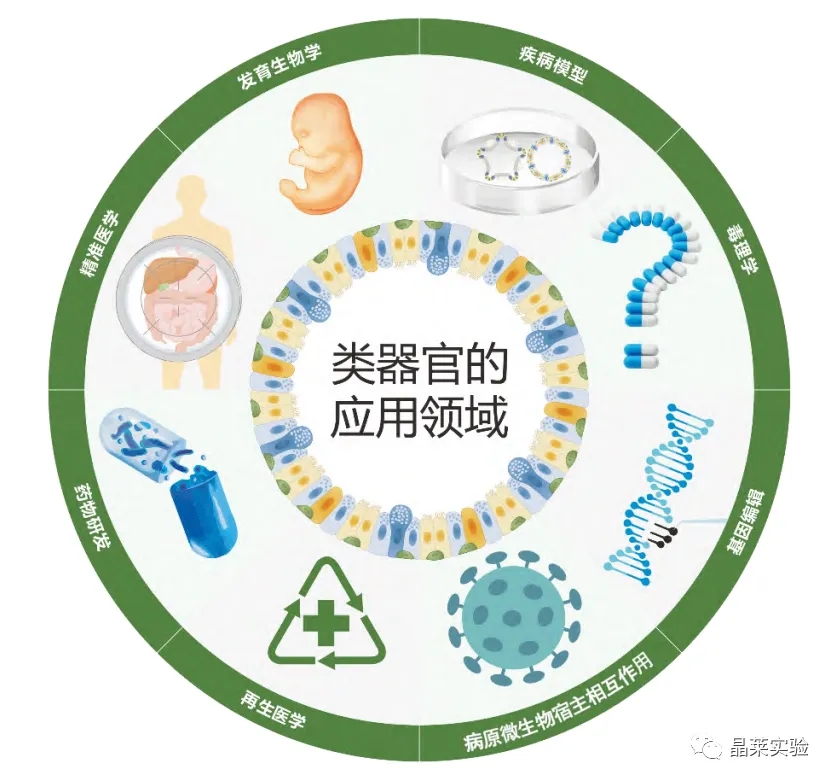
类器官技术的发展促进了对疾病模型、药物研发、精准医学、发育生物学、病原微生物宿主相互作用、毒理学、基因编辑、肿瘤研究以及再生医学的深入研究。
肠道、肝脏、肾脏等器官对药物或环境改变较为敏感,易受到药物毒性作用发生应激和损伤。培养成体组织干细胞或者多能干细胞来源的肠道、
肝脏、肾脏等类器官,能够为新药进入临床前的毒性评价提供体外人源化模型。
尤其对于因患者数量少而无法进行大规模临床试验的罕见遗传疾病,类器官技术可为药物开发提供解决方案。
类器官技术能够在体外快速地测试特定患病组织对不同药物的反应。
利用类器官培养技术,可以从患者来源的肿瘤组织样本中建立肿瘤类器官,并在体外测试肿瘤对于放射治疗或者化学药物治疗、靶向药物治疗、免疫细胞治疗等的有效性。
另外,建立肿瘤类器官样本库,通过基因组测序联合药物敏感性测试的大数据分析,可使得将肿瘤的遗传背景与药物反应联系在一起成为可能。
研究表明研究人员构建了结肠癌患者不同位置肿瘤的类器官,发现各个区位肿瘤所突变都不同,且转录组和甲基化水平也存在差异,而肿瘤类器官可以很好地保留这些肿瘤异质性。
类器官在再生医学领域中的应用是将成体组织干细胞培养得到的类器官移植回体内,修复受损组织。
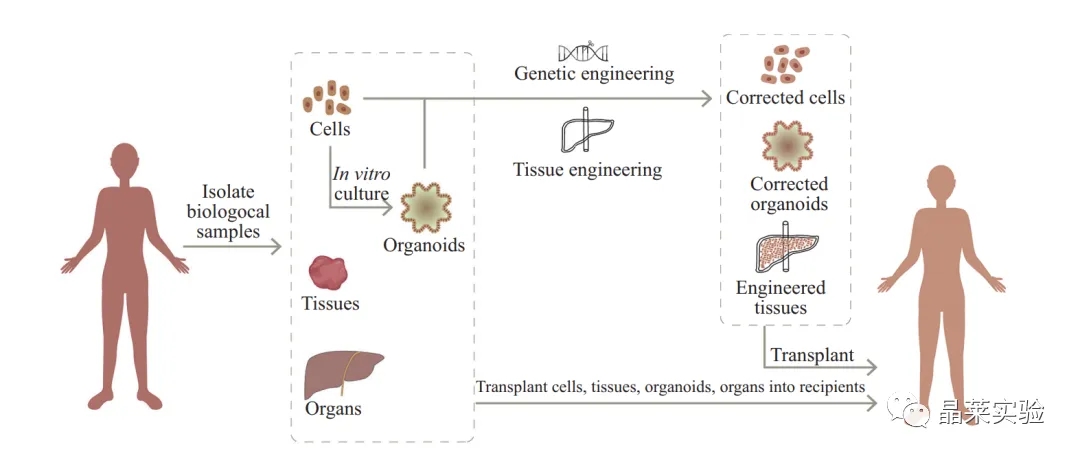
(在再生移植物中, 细胞、组织和器官可以直接从供体分离获得, 类器官可以通过细胞的体外培养获得。细胞、类器官、组织和器官都可作为 移植物用于再生医学。同时, 通过与基因编辑和生物工程技术相结合改造后的细胞和类器官也可用于再生移植。)
通过丰富与完善类器官模型, 提高 类器官模型的复杂程度, 寻找最优化的移植体系, 研究移植物与宿主环境之间相互作用的机制, 明确适 于进行移植的人群范围以及寻找最优的移植部位, 这些将会有助于我们提高移植的成功率, 促进移植 物在宿主体内再现正常的生理功能, 切实改善与恢 复目标组织器官的功能。
多种类器官模 型的建立为再生医学提供了新的移植物来源, 目前 已有肠道、肝脏、视网膜、胰腺、皮肤、肾脏等多 种类器官模型被应用于再生医学领域。
多种多样的类器官模型的建立为再生移植 时移植物的选取提供了新的选择。
常见的肿瘤类器官来源有二,一是肿瘤组织直接培养(肿瘤干细胞属于成体干细胞);二是来源于经基因编辑技术处理的诱导多能干细胞(induced pluripotent stem cell,iPSC)培养成的肿瘤类器官模型。
研究表明从肿瘤组织中建立类器官的方法,具体流程为:获取手术切除组织后,首先去除癌组织中的脂肪及肌肉组织,其次根据组织特点选用胰蛋白酶(和)或胶原酶对组织进行消化,细胞悬液过细胞筛网后用基质胶重悬,最后点注到培养板上并添加相应培养基进行后续培养。
培养基的成分根据不同癌种特点而有所差异,通常都以 DMEM/F12为基础,同时包含以下4类因子:Wnt信号通路激剂、酪氨酸受体激酶的配体、TGF-β信号通路抑制剂和 ROCK 抑制剂。在类器官研究过程中,可以通过传代整个培养皿、使用较早代的类器官和减少传代次数等方式来避免发生克隆漂移。
iPSC 的肿瘤类器官模型的产生效率取决于肿瘤类型以及该肿瘤是否存在特定的致癌突变,且大概率会导致选择性的肿瘤亚克隆生长和肿瘤遗传异质性的丧失,通常只用于研究特定基因突变在肿瘤发生、发展中的作用。
而直接由肿瘤组织培养形成的肿瘤类器官可保留肿瘤异质性,比涉及基因编辑的 iPSC 类器官培养似乎更为实用,来源于肿瘤组织的类器官保持了亲本肿瘤的遗传特性,在肿瘤研究中更有个体代表性。
类器官具有在体外模拟真实器官三维结构、细胞组成和功能的特性,使其在生物医学和再生医学领域拥有广阔的应用前景。
类器官研究在国自然中的热度一直很高,一直以来也有很多的伙伴咨询我们类器官怎么做?类器官的实验技术等等!
关于晶莱
