
铜是一种常见的金属元素,也是一种过渡元素,具有氧化还原活性。在常规的化学反应和生理条件下,还原型Cu+可转变为氧化型Cu2+。铜离子通过提供或接受电子参与多种生化反应。铜离子可与多种蛋白质或酶结合,作为辅助因子或结构组成部分,参与调控能量代谢、线粒体呼吸和抗氧化等多个生理过程。铜离子的含量维持动态平衡,失衡可导致氧化应激和细胞自噬异常等,从而诱发多种铜或铜离子相关性疾病的发生。
10种与铜死亡相关的基因
其中包含7个正调控基因:
铁氧还蛋白1(ferredoxin1,FDX1)、硫辛酸合成酶(LAIS)、脂肪酸转移酶1(LIPT1)、二氢硫辛酰胺脱氢酶(DLD)、二氢硫辛酸转乙酰基酶(DLAT)、丙酮酰脱氢酶E1-α亚基(PDHA1)、丙酮酸脱氢酶E1-β亚基(PDHB)。
3个负调控基因:
金属调节转录因子1MTF1)、谷氨酰胺酶(GLS)、细胞周期蛋白依赖性激酶抑制剂2A(CDKN2A)。
铜在机体内的含量维持相对稳定,含量过低会破坏重要的金属结合酶功能,而过高则会导致细胞功能异常,引起细胞死亡。机体内铜的摄入、排出以及代谢由多种因素共同调控并维持动态平衡,当体内铜稳态被打破,铜代谢异常或铜诱导的细胞死亡会导致一系列疾病的发生。
铜催化氧化应激
氧化应激是体内氧化-抗氧化平衡紊乱所致,主要表现为ROS浓度升高,从而导致正常或肿瘤细胞的死亡。
①铜介导Fenton反应催化合成最活跃的羟基自由基,从而导致肿瘤细胞中的ROS浓度升高,杀死肿瘤细胞,并且一些铜配合物可以通过Fenton反应产生ROS直接氧化和裂解DNA,导致铜对肿瘤细胞产生坏死性凋亡和毒性损伤;
此外铜可以将还原的谷胱甘肽氧化成氧化型谷胱甘肽二硫物(oxidizedglutathionedisulfide,GSSG),导致抗氧化剂谷胱甘肽的耗竭,从而干扰谷胱甘肽相关的抗氧化防御系统(此系统对高活性羟基有很强的清除作用,可保护细胞免受伤害),一旦该系统受到干扰,其对高活性羟基的清除作用就会减弱,从而导致肿瘤细胞凋亡。
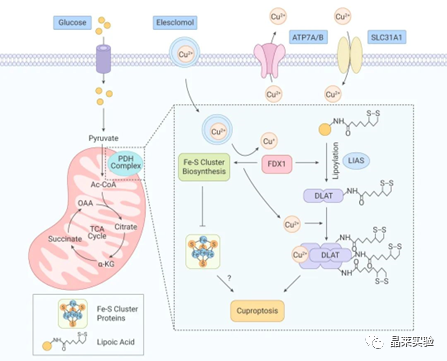
研究表明铜螯合剂伊利司莫(elesclomol,ES),一种高度亲脂性的铜结合分子,它可以螯合细胞外的Cu2+,形成一种以ES-Cu2+复合物的形式,将铜输送到线粒体中发生氧化还原反应并产生氧化应激从而触发肿瘤细胞凋亡。
铜诱导细胞死亡在肿瘤治疗中的相关研究
1. 乳腺癌
有研究表明乳腺癌患者血清中Cu2+含量高于正常人。乳腺癌线粒体中铜伴侣蛋白COX17和SCO2表达上调,这说明乳腺癌细胞比正常细胞对铜向线粒体运输的需求更高。
相关研究表示使用一种耗铜纳米颗粒,此铜络合剂可以靶向线粒体氧化磷酸化,使其活性关闭,从而将代谢从呼吸转为糖酵解,导致ATP生成减少,再加上线粒体膜电位受损和氧化应激增加,从而导致了乳腺癌细胞的凋亡。
人和小鼠乳腺癌细胞系和临床相关的小鼠模型中发现了DSF/Cu2+在体内和体外均通过下调NF-κB干细胞基因通路来阻断放射治疗诱导的非干性乳腺癌细胞的形成,以此来增强放射治疗的疗效。
赖氨酰氧化酶(lysyloxidase,LOX)是铜依赖性的单胺氧化酶,是参与交联胶原蛋白的关键酶,在肿瘤转移过程中起着至关重要的作用,其家族成员LOXL2的上调与乳腺癌的进展密切相关,活化的LOX通过过氧化氢的介导激活FAK/Src信号通路来减少细胞黏附分子,从而使癌细胞转移扩散。
TTM相关的铜耗竭可导致LOXL2水平降低,胶原交联的减少和降解,使转移前的生态位“正常化”,从而促进免疫激活、防止乳腺癌的转移。
2. 结直肠癌
铜与肿瘤微环境中的炎症因子相互作用,炎症因子IL-17通过诱导金属还原酶前列腺跨膜上皮抗原4(sixtransmembraneepithelialantigenoftheprostate4,STEAP4)来推动细胞对铜的摄取,胞内铜离子水平的增加导致E3-连接酶的活化,从而增强白细胞介素-17(interleukin,IL-17)诱导的NF-κB活化,并抑制caspase-3的功能,进而抑制细胞凋亡。
揭示了铜依赖的IL-17-STEAP4-XIAP轴诱导铜摄取,促进了结直肠癌的发生,因此细胞铜代谢状态可能是癌细胞对IL-17刺激反应的关键决定因素。
近年来有研究发现ATP7A在KRAS突变的结直肠癌细胞表面表达上调,以调节KRAS突变细胞中的细胞内铜水平并促进肿瘤生长。
也有研究表明ES促进ATP7A的降解,导致Cu2+滞留在线粒体中,发生氧化还原反应并产生氧化应激诱导铁死亡,引发结直肠癌细胞凋亡。
3. 肺癌
有研究表明生理浓度的Cu2+联合DSF对H292非小细胞肺癌细胞具有选择毒性作用,DSF通过铜的氧化还原循环选择性地增强放化疗诱导的非小细胞肺癌敏感性,并对耐放化疗的低氧细胞以及肿瘤干细胞造成毒性。
通过降低依赖自噬来维持肿瘤KRAS驱动的肺癌小鼠模型中的CTR1,导致细胞内铜水平降低,进而导致自噬发生,抑制肺癌细胞的生长。
有研究表明DSF通过caspase信号通路诱导非小细胞肺癌的细胞凋亡。
4. 前列腺癌
研究发现DSF与铜络合时,诱导了依赖于ROS的激素敏感型和去势抵抗性前列腺癌细胞的凋亡,此外他们还发现雄激素可以增加前列腺癌细胞对铜的摄取,认为DSF/Cu2+能有效地治疗对经典雄激素剥夺治疗耐药的前列腺癌。
此外也有研究发现γ-谷氨酰转肽酶(gamma-glutamyltransferase,GGT)的激活可以诱导二硫代氨基甲酸酯的释放,在表达GGT的前列腺癌细胞中选择性地形成铜配合物,从而产生细胞毒性作用。
相关文献研发了通式为[Cu(PP)(LL)][BF4]的一族铜络合物,其中铜络合物16[Cu(dppe)(2-ap)][BF4]的细胞毒性最强,它能够诱导激素依赖型的前列腺癌细胞ROS的产生,并通过细胞凋亡机制触发细胞死亡。
铜可通过多种方式诱导肿瘤细胞死亡,“铜死亡”作为一种不同于细胞凋亡、铁死亡、自噬和程序性坏死的新型调控性细胞死亡机制在肿瘤治疗领域有着很好的应用前景,但目前铜死亡在哪些癌症中发挥作用尚不清楚,还需要大量高质量的基础研究来证明铜死亡与肿瘤之间的因果关系。
关注公众号,了解更多实验技巧!
