
DSS常被用于诱导结肠炎模型,其诱导机制虽尚未明确。低浓度的DSS能够诱导小鼠慢性溃疡性结肠炎,高浓度的DSS能够诱导小鼠急性期溃疡性结肠炎症状;DSS分子量选择的多样化,不同分子量DSS诱导结肠炎症状不同。
目前的研究主要认为DSS增加肠道通透性、破坏肠黏膜屏障、上调某些细胞因子(肿瘤坏死因子、白介素、干扰素、IL-10和IL-12)、激活某些通路(NF-κB通路和TRPV1通路)或肠道菌群失调等有关。
DSS诱导的UC发生可能与肠道菌群多样性及某些信号通路相关。DSS诱导急性UC模型一般采用自由饮用的方式,具有方法操作简单,持续时间短及易重复等优点。DSS所带来的炎性症状与人类UC相似,可以用于人类结肠炎机制的探究。而DSS诱导慢性UC模型能够很好的模拟人UC的症状和病理改变,但建模周期较长,所需费用较高。
1.慢性结肠炎造模
慢性结肠炎模型则可采用低浓度DSS建立,但给药时间较长。如给予小鼠1%~3%DSS自由饮用数个星期即可。慢性结肠炎模型表现:小鼠结肠明显缩短,上皮增生、黏膜纤维化和淋巴结肿大;小部分动物可见肉芽组织增生和肿瘤样改变。
2.急性结肠炎造模
急性造模一般采用较高浓度的DSS建立,给药时间较短。如给予仓鼠3%~5%DSS自由饮用一周即可。急性期结肠炎模型表现:结肠充血、水肿、变短、变脆、重量长度比增加,出现不同程度的结肠溃疡,黏膜水肿、杯状细胞缺失、隐窝肿胀破坏,黏膜和黏膜下层出现不同程度的炎症细胞浸润,上皮细胞损伤。
1. 案例一:富含布鲁沙托的爪哇布鲁斯卡油改善右旋糖酐硫酸钠诱导的小鼠结肠炎:NF-κB和RhoA/ROCK信号通路的参与。
动物造模:
将动物饲养在标准环境条件下,其中温度,照明条件(12小时光照/黑暗循环)和湿度(23±1℃,40-60%)受到严格控制。这些动物可以自由获得标准饮食和随意饮水。
急性结肠炎由3%(wt/vol)DSS溶解在Balb/C小鼠中随意给予饮用水7天诱导。
所有小鼠随机分为4组:
(1)正常组,接受无DSS的饮用水;
(2)DSS组,给予含3%DSS的饮用水,并在整个实验期间给予大豆卵磷脂悬浮液;
(3)5-ASA组和BJO组,分别接受3%DSS,并分别给予30mg/kg5-ASA和2000mg/kgBJOE;
(4)BE-BJO组,接受3%DSS,分别给予BE-BJO152.5mg/kg/天(低剂量,BE-BJOL),305mg/kg/天(中等剂量,BE-BJOM)或610mg/kg/天(高剂量,BE-BJOH),持续7天。
每天使用数字体重秤测量体重。7天后,禁食12小时并用二氧化碳(CO2)吸入;然后,立即收集血液。
结肠组织被迅速取出,并测量其长度。收集结肠组织进行形态学观察、蛋白质印迹、ELISA和定量实时聚合酶链反应(qRT-PCR)。
总结:
BE-BJO减轻了DSS诱导的体重减轻,疾病活动指数(DAI)增加,结肠缩短,而BF-BJO没有这些保护作用。BE-BJO处理改善了结肠组织形态,抑制了结肠组织中TNF-α、IFN-γ、IL-6和IL-1β的产生和释放,逆转了DSS诱导的ZO-1、occludin、claudin-1和E-钙粘蛋白表达下降,但增加了claudin-2表达。
机制上,BE-BJO抑制了NF-κB亚基p65的磷酸化,抑制了DSS处理小鼠的RhoA活化,下调了ROCK,并阻止了肌球蛋白轻链(MLC)的磷酸化,表明BE-BJO的保护作用归因于抑制NF-κB和RhoA/ROCK信号通路。
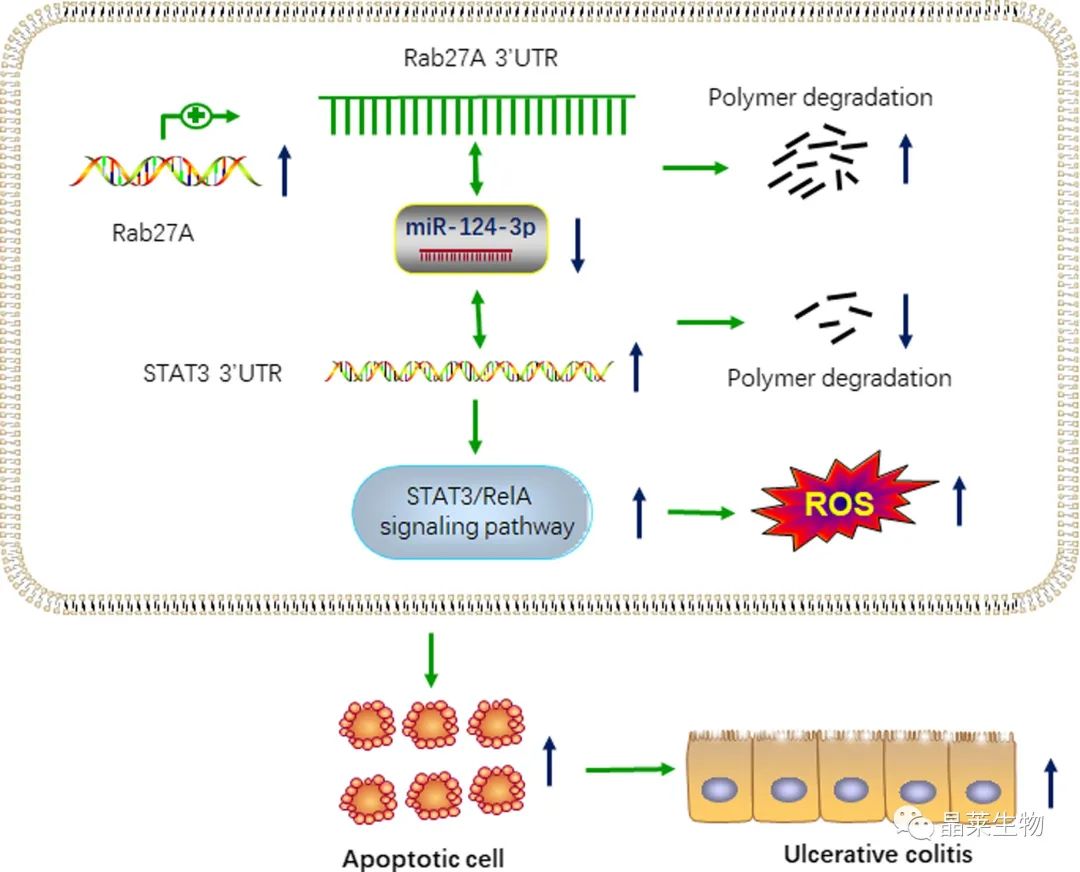
2. 案例二:Rab27A通过调节溃疡性结肠炎中的miRNA-124-3p/STAT3/RelA信号通路促进细胞凋亡和ROS产生。
动物造模:
雄性C57BL/6小鼠[年龄7-8周龄,体重20-22g]定期用2.5%葡聚糖硫酸钠(DSS,MW40-50kDa;MPBiomedicals,美国)在饮用水中1个月,之后收获肠粘膜进行进一步分析。
通过记录结肠长度、炎症细胞浸润和组织学评分等标准参数来评分结肠炎的严重程度。
总结:
Rab27A mRNA和蛋白质表达水平在人类UC患者和DSS诱导的结肠炎小鼠中均增加。
敲低Rab27A抑制了结肠炎细胞的细胞凋亡和活性氧(ROS)的产生。
在机制上,Rab27A可以调节miR-124-3p/STAT3/RelA轴,以促进溃疡性结肠炎的细胞凋亡和ROS产生。
3. 案例三:乳酸杆菌对DSS-诱导的小鼠溃疡性结肠炎的抑制作用
动物造模:
葡聚糖硫酸钠(DSS)使用剂量在2%最为合适,剂量使用过大会导致小鼠诱导肠炎的严重病情,最终导致小鼠死亡;剂量使用过小,会影响小鼠患肠炎的程度,建造模型不成功。葡聚糖硫酸钠(DSS)通过自由饮食摄入到小鼠体内。
(1)预实验动物分组:
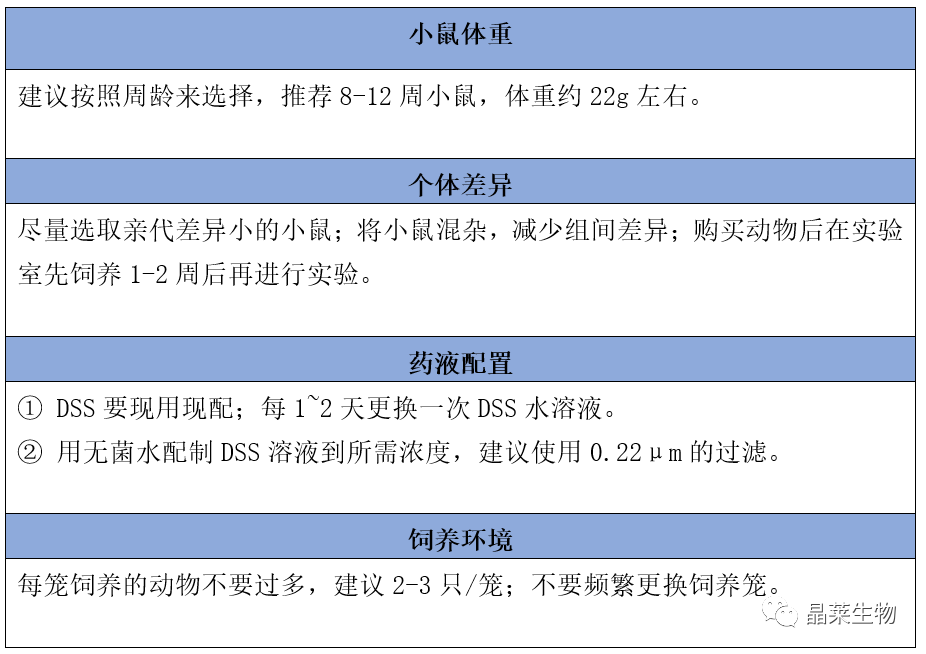
实验小鼠选用Balb/c雄鼠20只,每只小鼠体重大约在20-25g,分为4组,每组5只小鼠,具体分组情况如下:
空白组:不作任何处理
6天组:用2%浓度的DSS诱导6天
7天组:用2%浓度的DSS诱导7天
8天组:用2%浓度的DSS诱导8天
(2)治疗组动物分组:
治疗组小鼠共分为5个组别,每组10只小鼠,饲养21天,每天对小鼠的状态进行记录。
空白组:生理盐水饲喂小鼠21天
组2:2%DSS诱导7天,小鼠对生理盐水进行自由采食14天
组3:2%DSS诱导7天,干酪乳杆菌(L.paracaseiM5-L)灌胃小鼠14天
组4:2%DSS诱导7天,副干酪乳杆菌(L.caseiQ8-L)灌胃小鼠14天
组5:2%DSS诱导7天,鼠李糖乳杆菌(LGG)灌胃小鼠14天
小鼠分组后DSS诱导1周,乳杆菌灌胃2周,21天末自由饮水,禁食12h后,眼球取血,断颈处死。待小鼠四肢张力丧失后固定在鼠台上,迅速取出肝脏,脂肪,脾脏,胸腺,结肠。脾脏及肾脏立即放入冷的生理盐水中漂洗,然后用滤纸吸取多余水分,在微量电子称上称重。肝脏,肾脏称重后一部分放入固定液,剩余部分液氮冷冻保存。
取结肠称重后,在液氮中迅速冷冻,转移到-80℃冰箱长期保存。
总结:
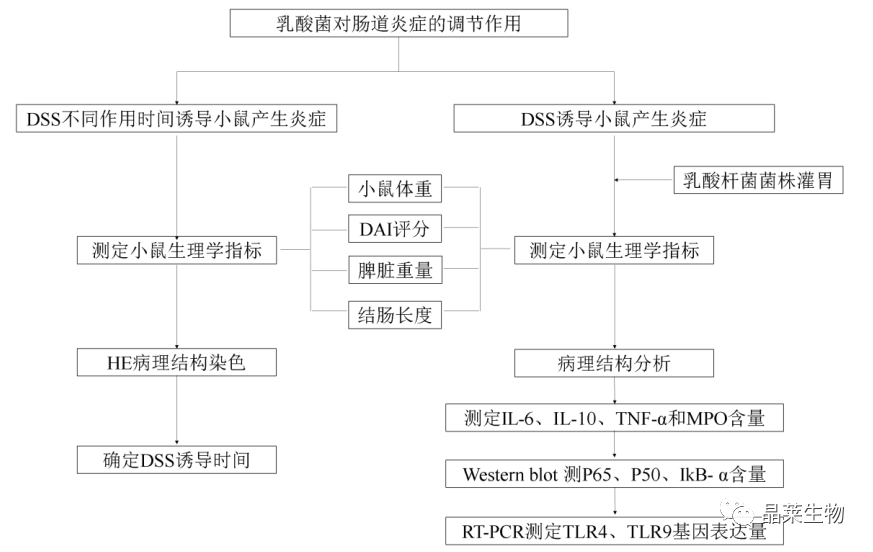
乳酸杆菌作用于IκB-α激酶减少其磷酸化,减弱对P65-P50二聚体的激活,通过下调NF-κB信号通路中P65、P50蛋白的表达来调节肠道炎症。
并且通过用RT-PCR测定TLR4和TLR9的基因表达量,发现乳酸杆菌下调了炎症因子IL-6和TNF-α的含量,与TLR4和TLR9的基因表达量调节效果一致,在基因水平上说明三株乳酸杆菌能抑制DSS刺激小鼠分泌的TNF-α,并且TLR4和TLR9受体在乳杆菌调节肠道炎症时起到关键作用。


综上,可根据自身实验研究目的对DSS种类、浓度、给药时间等变量进行筛选摸索,建立符合实验要求的UC模型。
关注公众号,了解更多!
