
Chemotherapy-elicited exosomal miR-378a3p and miR-378d promote breast cancer stemness and chemoresistance via the activation of EZH2/STAT3 signaling

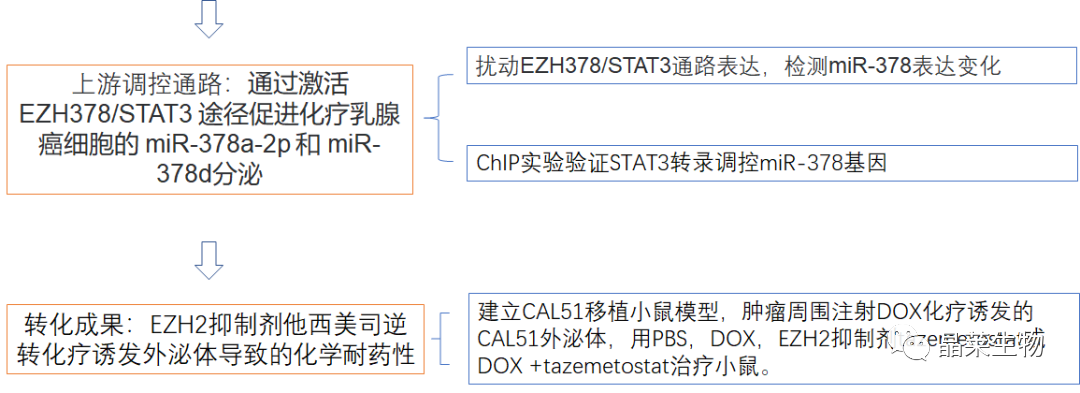
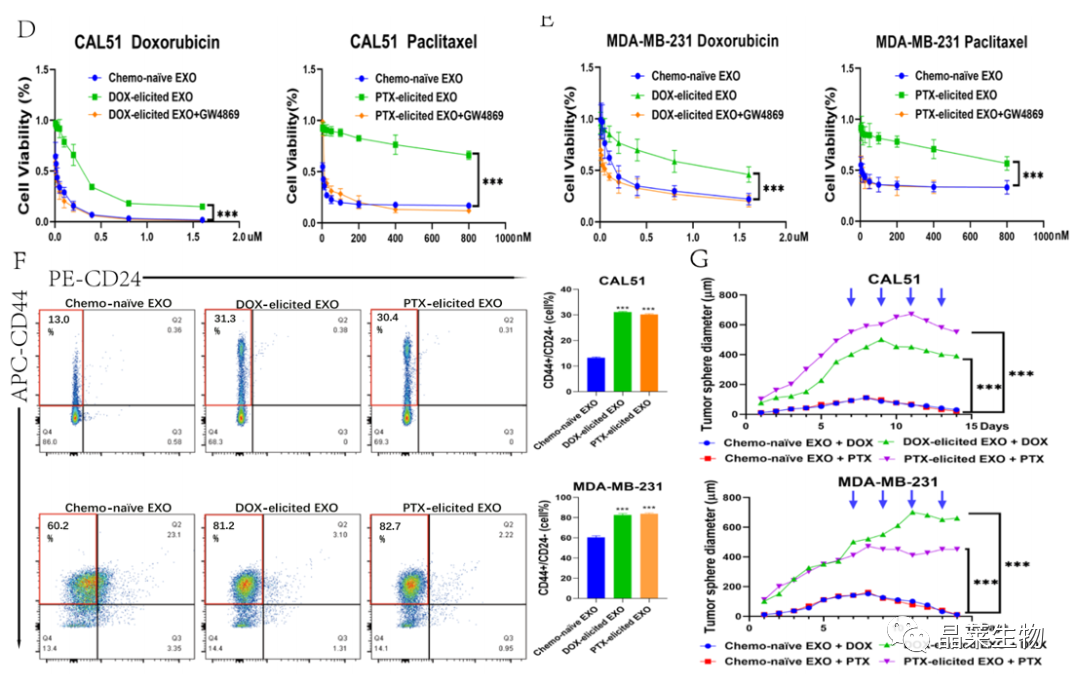
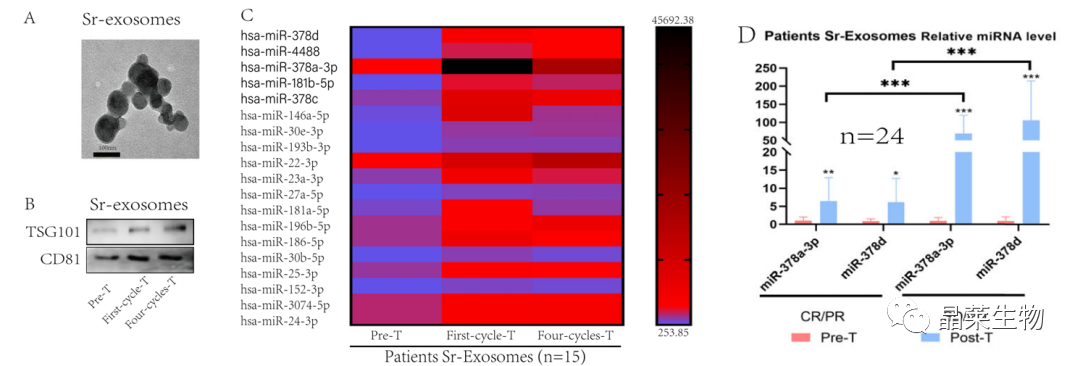
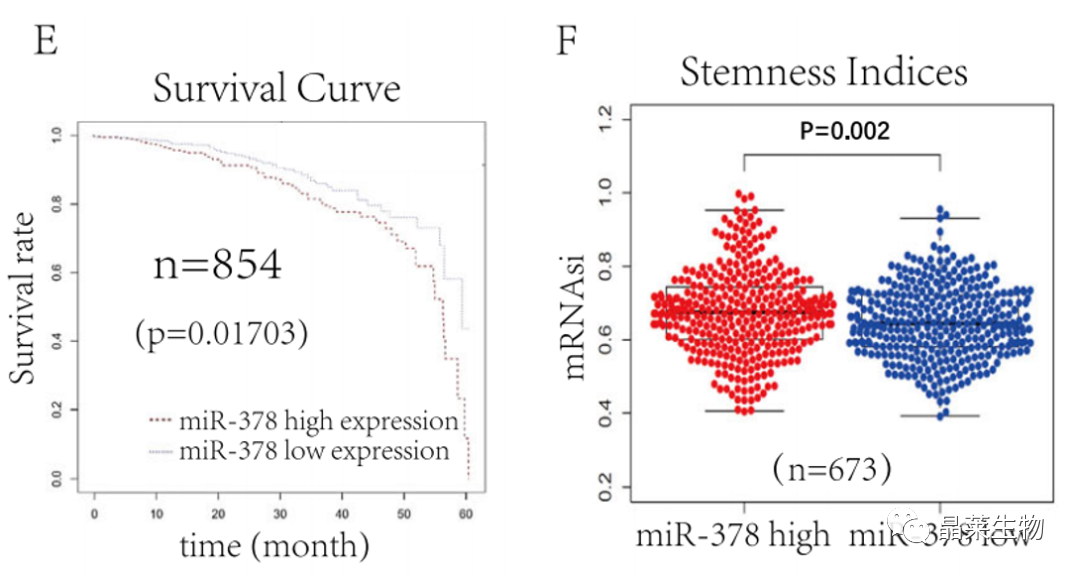
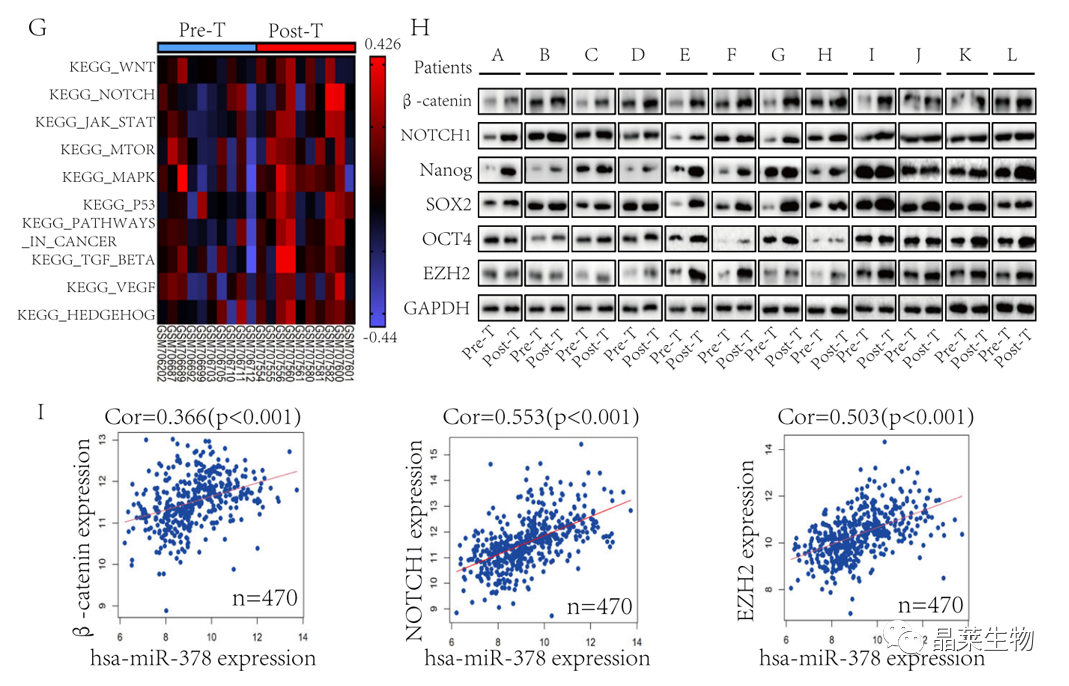
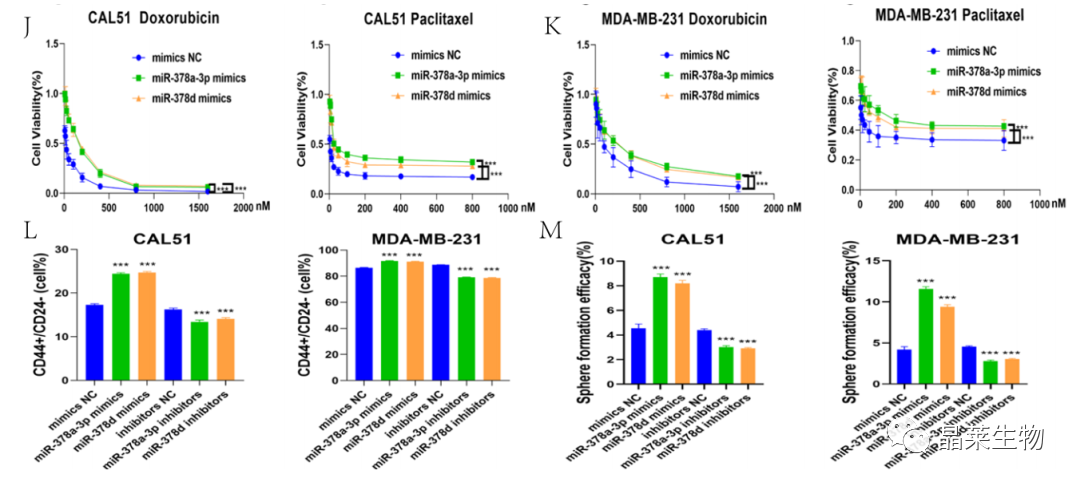
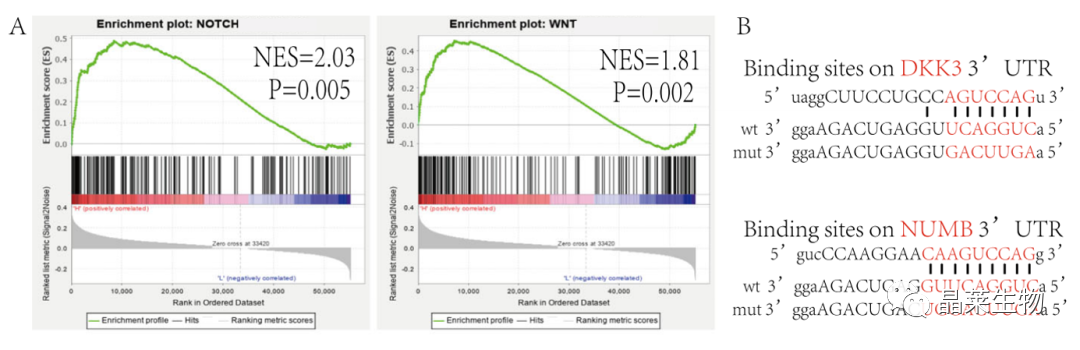
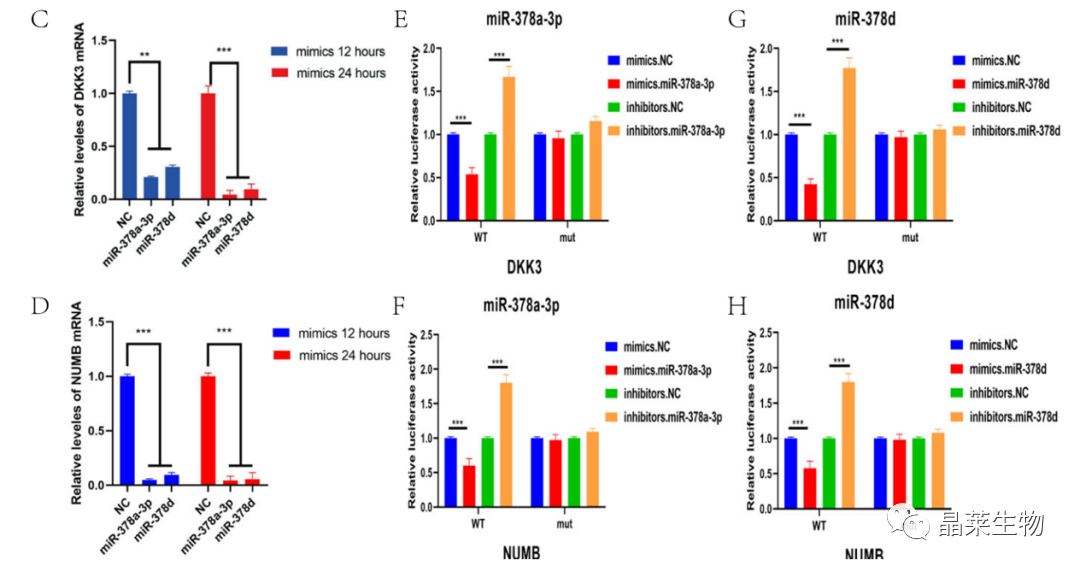
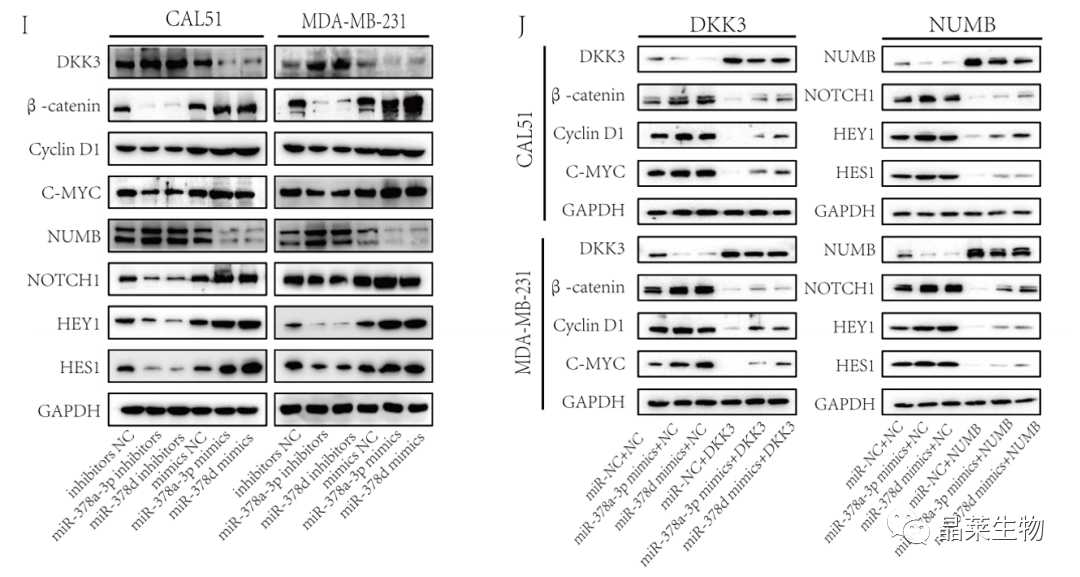
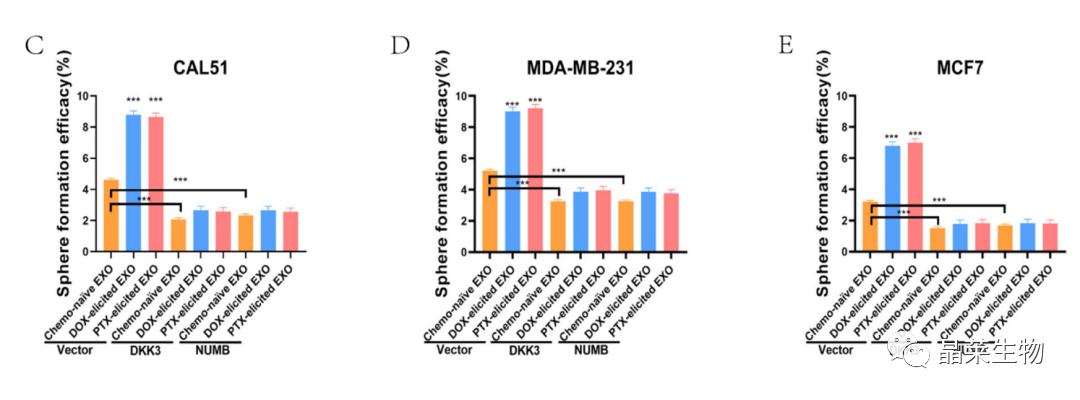
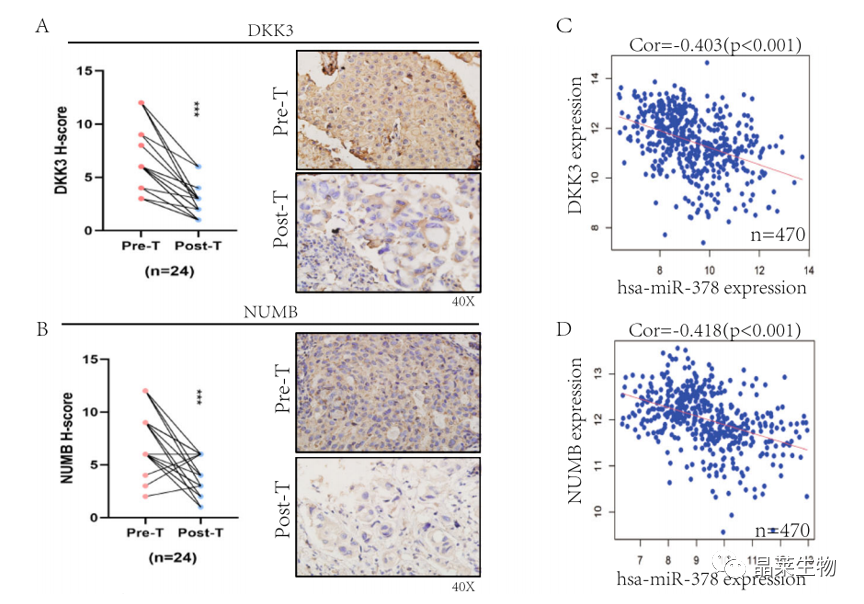
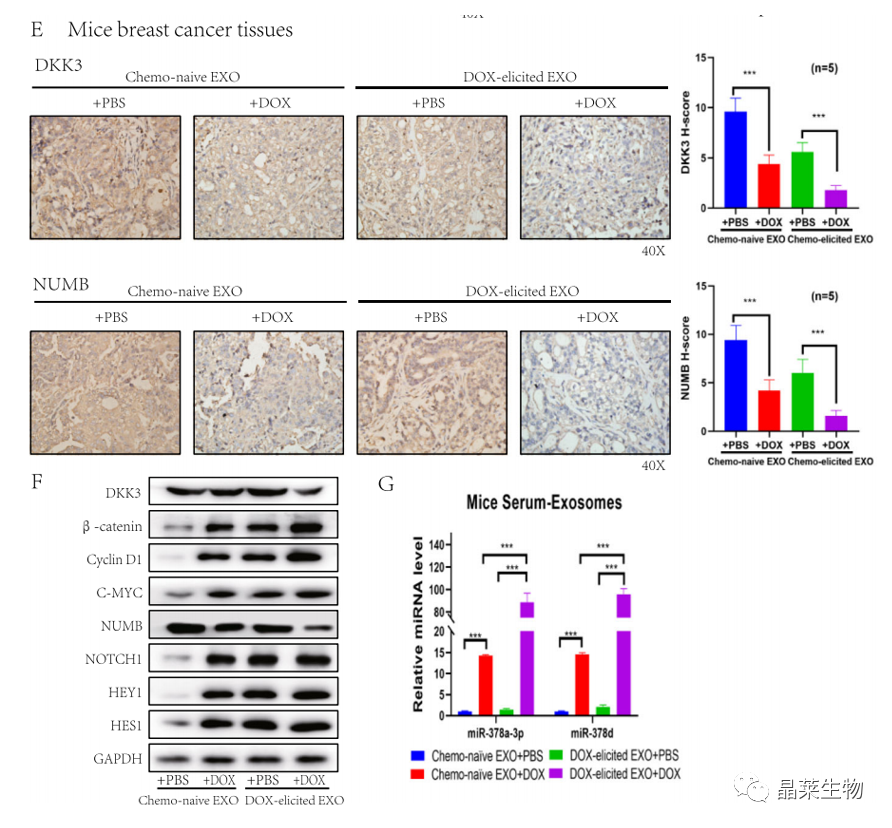
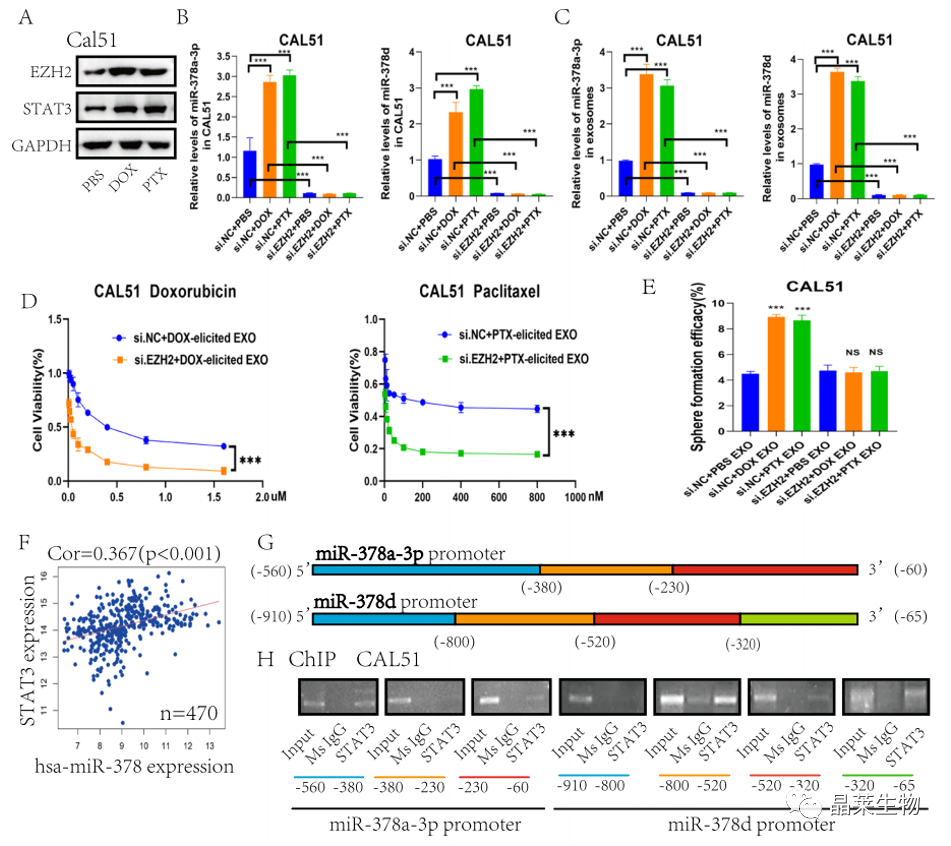
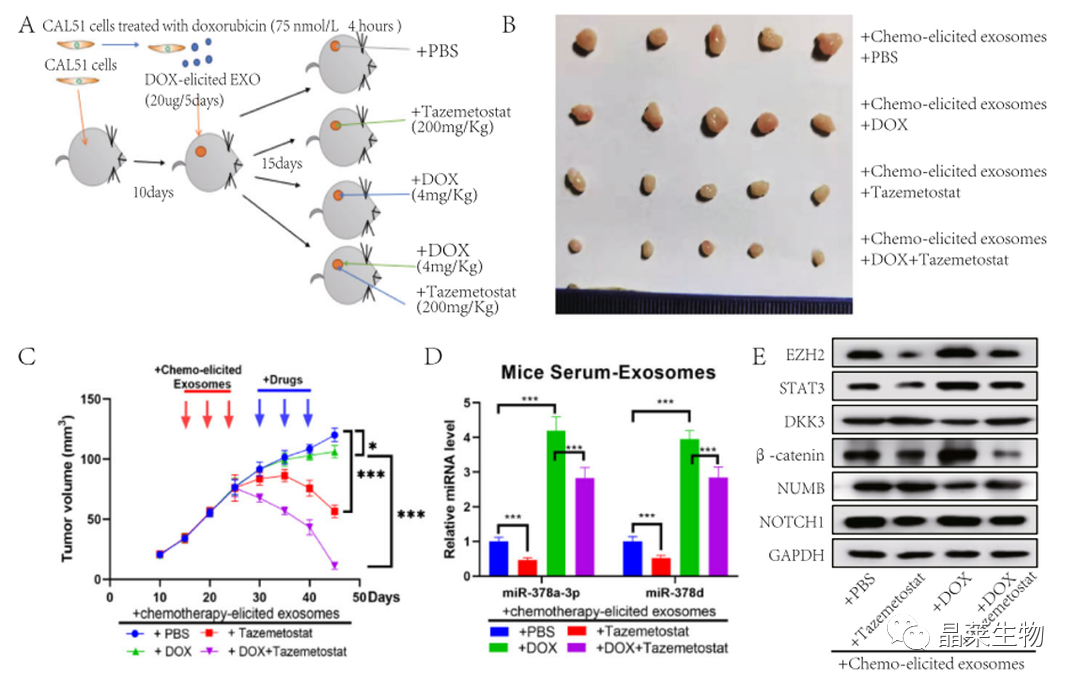
研究背景 乳腺癌是威胁女性健康最常见的恶性肿瘤之一,发病率与死亡率整体呈现上升趋势,2020年全球新发乳腺癌达到226万例,首次超过肺癌成为全球第一大癌症。乳腺癌虽然发病率很高,但如果在较早期发现,治愈的可能性非常高,开展乳腺癌方向的研究有重要的意义。(疾病类型) 新辅助化疗是最常见的针对肿瘤治疗的有效方法(已有治疗手段),用以缩小肿瘤和破坏未检测到的转移细胞,从而促进后续的手术或放疗治疗效果。然而,这种治疗的一个缺点是,它可能不能杀死所有的肿瘤细胞,从而导致残留的细胞对后续化疗的耐药性增加。(临床问题) 外泌体是细胞外囊泡,含有脂质、蛋白质和核酸,在细胞间通讯中发挥重要作用,近年来已成为肿瘤生物学的研究热点。许多最新的研究表明,肿瘤中的耐药癌细胞能够释放外泌体miRNA,直接诱导敏感细胞转化为耐药细胞,或传递与肿瘤微环境中的细胞相互作用的miRNA,以调节该区域的耐药反应。(研究发现及突破口) 最近的研究已经确定肿瘤干细胞(TIC)扩增在介导肿瘤治疗耐药性和转移中的关键作用。EZH2通过诱导TICs的扩增,促进乳腺癌和其他类型的癌症的化疗耐药性。此外,STAT3在乳腺癌化疗耐药性和干细胞自我更新中起着关键作用。(靶点) 然而,化疗诱导的外泌体导致的耐药性具体作用机制和临床相关性尚未被研究。 文献研究的科学问题 化疗诱导的外泌体导致的耐药性具体作用机制? 乳腺癌细胞耐药性发展的有哪些新途径? 研究发现的特异性外泌体miRNA是否可用于癌症早期检测和预后的潜在生物标志物? 文献框架&技术路线 研究结果及分析 1. 1体内验证化疗诱发乳腺癌细胞衍生的外泌体诱导化学耐药性 a.动物实验设计图。 b 小鼠肿瘤图像(n = 20)。 c 肿瘤生长曲线。 1.2 体外验证化疗诱发乳腺癌细胞衍生的外泌体诱导化学耐药性 d,e. DOX化疗诱发外泌体、PTX化疗诱发外泌体对CAL51和MDA231细胞细胞活力的影响。 f.干细胞标志物检测。 g. 细胞成球能力检测。 这些结果表明,DOX化疗诱发的外泌体赋予肿瘤体内化疗耐药性。 2.1 外泌体分离鉴定及miRNA测序 a.从患者血清中分离的血清-外泌体的电镜图。 b.乳腺癌患者血清外泌体中关键富集蛋白CD81和TSG101的蛋白质印迹分析。 c.外泌体 microRNA 的测序分析。 d.测序结果验证。 2.2 基因表达和生存期相关性 e.基于TCGA数据库的低表达或高表达miR-378患者的五年生存率(n = 854)。 f.分析TCGA数据库中378名乳腺癌患者的miR-673表达和相应的新型干性指数。 2.3 基因集变异分析筛选通路及验证 g.基因集变异分析化疗前和化疗后的表达数据(n = 10)。 h.新辅助化疗前后乳腺癌组织中蛋白质表达的蛋白质印迹分析(n = 12)。 i.miR-378的表达水平与乳腺癌中的β-连环蛋白、NOTCH1或EZH2呈正相关。 miR-378a-3p和miR-378d在接受化疗的乳腺癌患者中血清外泌体的表达增加,并与化学耐药性有关。 2.4 miR-378a-3p、miR-378d功能验证 j,k.CAL51和MDA231细胞转染miR-378a-3p或miR-378d模拟物或阴性对照模拟物,然后暴露于DOX或PTX以评估细胞活力。 l,m.在用miR-48a-378p或miR-3d模拟物,抑制剂和相应的正常对照转染后,肿瘤干细胞标志物及成球能力检测。 3.1 miR-378a-3p、miR-378d靶基因预测 a.通过基因集富集分析对miRNA-378表达数据的分析表明,参与WNT和NOTCH途径的基因显著富集。 B.miRanda 预测 miR-378a-3p/miR-378d 在 DKK3/NUMB 的 3′-UTR 内的结合位点。 3.2 双荧光素酶实验验证miR-378靶向NUMB和DKK3的调控关系 c,d.转染miR-3a-51p或miR-378d模拟物的CAL3细胞中DKK378 / NUMB mRNA的相对水平变化。 e–h.发现MiR-378a-3p/miR-378d使用双荧光素酶报告基因测定直接与NUMB/DKK3 3′-UTR结合。 3.3 功能回复实验验证miR-378通过调控NUMB和DKK3通路促进肿瘤干细胞干性 I,J.不同组中DKK3、β-连环蛋白、细胞周期蛋白D1、C-MYC、NUMB、NOTCH1、HES1和HEY1表达的蛋白质印迹分析。 化学诱发的外泌体miR-378a-3p和miR-378d通过靶向NUMB和DKK3调节WNT/β-连环蛋白和Notch干性途径。通过基因集富集分析对miRNA-378表达数据的分析表明,参与WNT和NOTCH途径的基因显著富集。 3.3 功能回复实验验证miR-378通过调控NUMB和DKK3通路促进肿瘤细胞干性 c-e,不同处理后,肿瘤细胞成球能力检测。 miR-378a-3p/miR-378d抑制剂、WNT拮抗剂DKK3和Notch拮抗剂NUMB均抑制化疗诱发的外泌体诱导的干性途径激活。甲、乙CAL51和MDA231细胞与化疗初生外泌体,DOX化疗诱发的外泌体或PTX化疗诱发的外泌体共培养,然后转染miR-378a-3p或miR-378d抑制剂和相应的正常对照 3.4 NUMB、DKK3和乳腺癌进展相关性分析 a,b.新辅助化疗前后乳腺癌患者组织中DKK3和NUMB的免疫组织化学分析(n = 24)。 c,d.miR-378的表达水平与乳腺癌中的DKK3或NUMB呈负相关(n = 470)。 3.5 体内实验验证NUMB、DKK3和乳腺癌进展相关性分析 e.肿瘤中DKK3和NUMB的免疫组织化学分析(n = 5)。 f.DKK3、β-连环蛋白、细胞周期蛋白 D1、C-MYC、NUMB、NOTCH1、HES1 和 HEY1 在肿瘤中的表达的蛋白质印迹分析。 g.收集血清外泌体并分析miR-378a-3p和miR-378d含量。 化疗诱发的外泌体通过在体内诱导WNT/β-连环蛋白和Notch干性途径来促进乳腺癌的化学耐药性。甲、乙无应答组新辅助化疗前后乳腺癌患者组织中DKK3和NUMB的免疫组织化学分析(n = 24)。 4. 激活EZH378/STAT3 途径促进化疗乳腺癌细胞的 miR-378a-2p 和 miR-378d分泌 a.DOX或PTX处理后EZH3和STAT3蛋白表达检测。 b,c.miR-378表达的变化。 d, e.DOX和PTX对CAL51细胞活力及成球能力的影响。 f.miR-378在乳腺癌中的表达水平与STAT3呈正相关。 g,h.ChIP实验证明STAT3蛋白直接结合miR-378 基因。 化学毒性通过激活 EZH2/STAT3 途径促进化疗乳腺癌细胞分泌 miR-378a-3p 和 miR-378d。对PBS,DOX或PTX处理4小时后EZH2和STAT3蛋白表达变化的蛋白质印迹检测。B–E用si转染CAL51细胞。EZH2 或 si。NC48小时,然后4小时DOX或PTX处理。 这些结果表明,化疗刺激EZH2 / STAT3信号通路的激活。此外,STAT3在miR-378a-3p和miR-378d的上游起作用,激活它们的表达,从而影响下游途径。 5. EZH2抑制剂他西美司他逆转化疗诱发的外泌体诱导的体内化学耐药性 a.动物实验示意图。 b 小鼠肿瘤图像(n = 20)。 c.肿瘤生长曲线。 d.不同治疗组血清外泌体中miR-378a-3p或miR-378d的RT-qPCR分析。 e.通路指标蛋白质印迹分析。 这些数据共同表明,EZH2抑制剂tazemetostat可以阻断化疗诱发的外泌体诱导的干性相关信号传导,从而有助于逆转治疗耐药性。 文献结论 化疗激活了肿瘤细胞中的EZH2/STAT3通路,细胞分泌负载高表达miR-378a-3p和miR-378d外泌体。这些miRNA靶向调控DKK3和NUMB表达激活了下游通路WNT/β-连环蛋白和Notch干细胞相关途径,从而诱导化学耐药性。 文献总结 创新点:

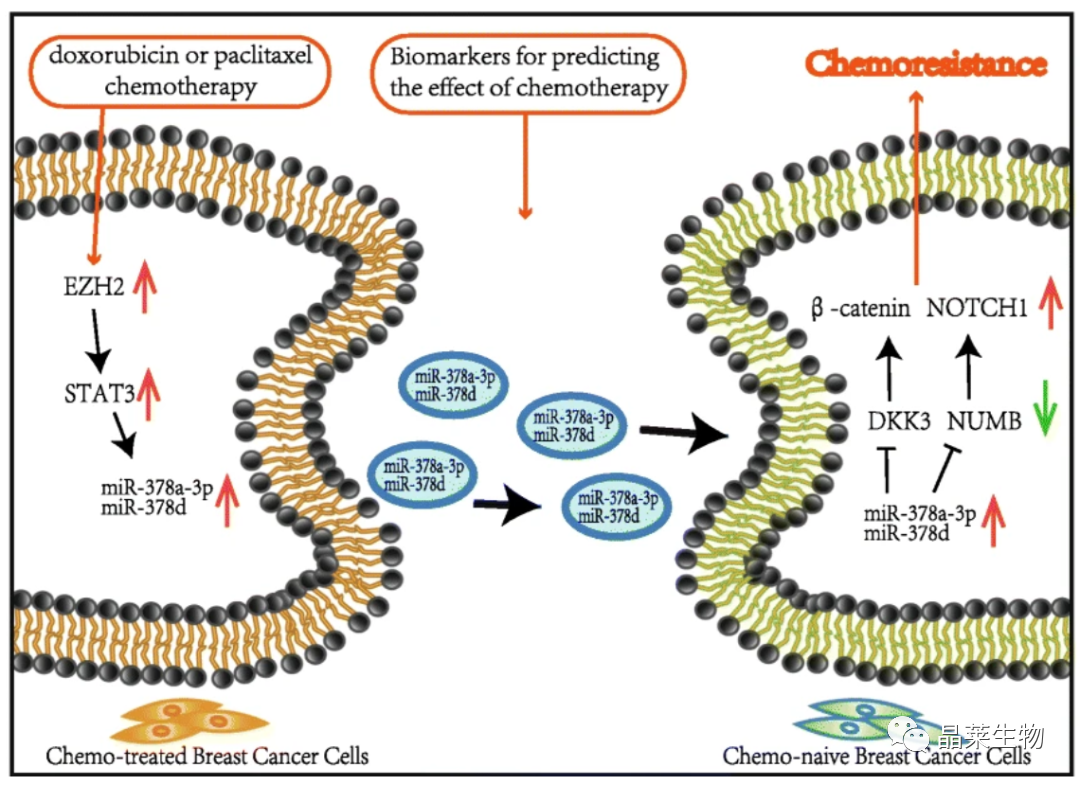
1、揭示了获得性化学耐药性的新机制,即化疗激活BC细胞中的EZH2/STAT3轴,然后分泌富含miR-378a-3p和miR-378d的外泌体。这些外泌体被化疗存活的BC细胞吸收,通过靶向DKK3和NUMB导致WNT和NOTCH干细胞途径的激活,随后导致耐药性。
2、为减少癌细胞耐药性、抗肿瘤复发提供了一种新思路。
文献涉及的实验技术 关注公众号,了解更多!
