

线粒体目前被公认为提供细胞代谢所需 90% 以上 ATP 的“发电厂”。此外,它们还参与细胞代谢和功能的其他方面,参与离子稳态、细胞生长、氧化还原状态、细胞信号传导的调节,因此在细胞存活和细胞死亡机制中起着关键作用。由于线粒体在细胞生死中起着核心作用,它们还参与许多人类疾病的发病机制和进展,包括癌症、神经退行性疾病和心血管疾病、糖尿病、创伤性脑损伤和炎症等。
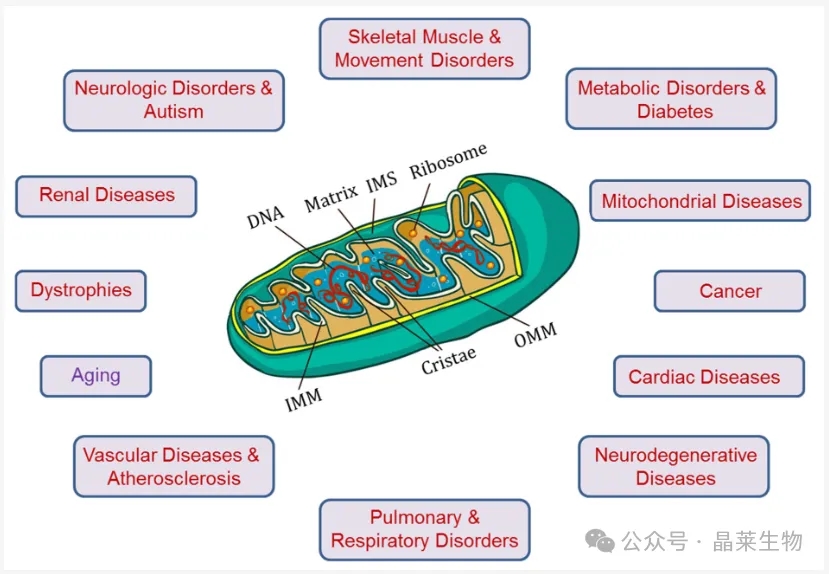
线粒体在疾病治疗中的相关靶点
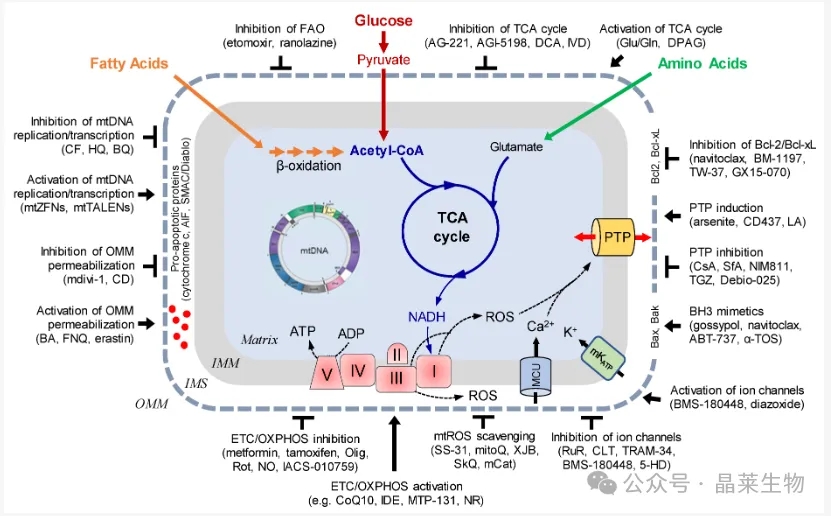
线粒体为肿瘤细胞在其他恶劣环境中的生长和存活提供了相当大的灵活性,例如在营养枯竭、缺氧和癌症治疗期间,所以也是肿瘤发生的关键参与者。
癌症中的线粒体功能取决于肿瘤之间的遗传、环境和组织起源差异。许多经典的癌症标志也会导致线粒体功能改变。
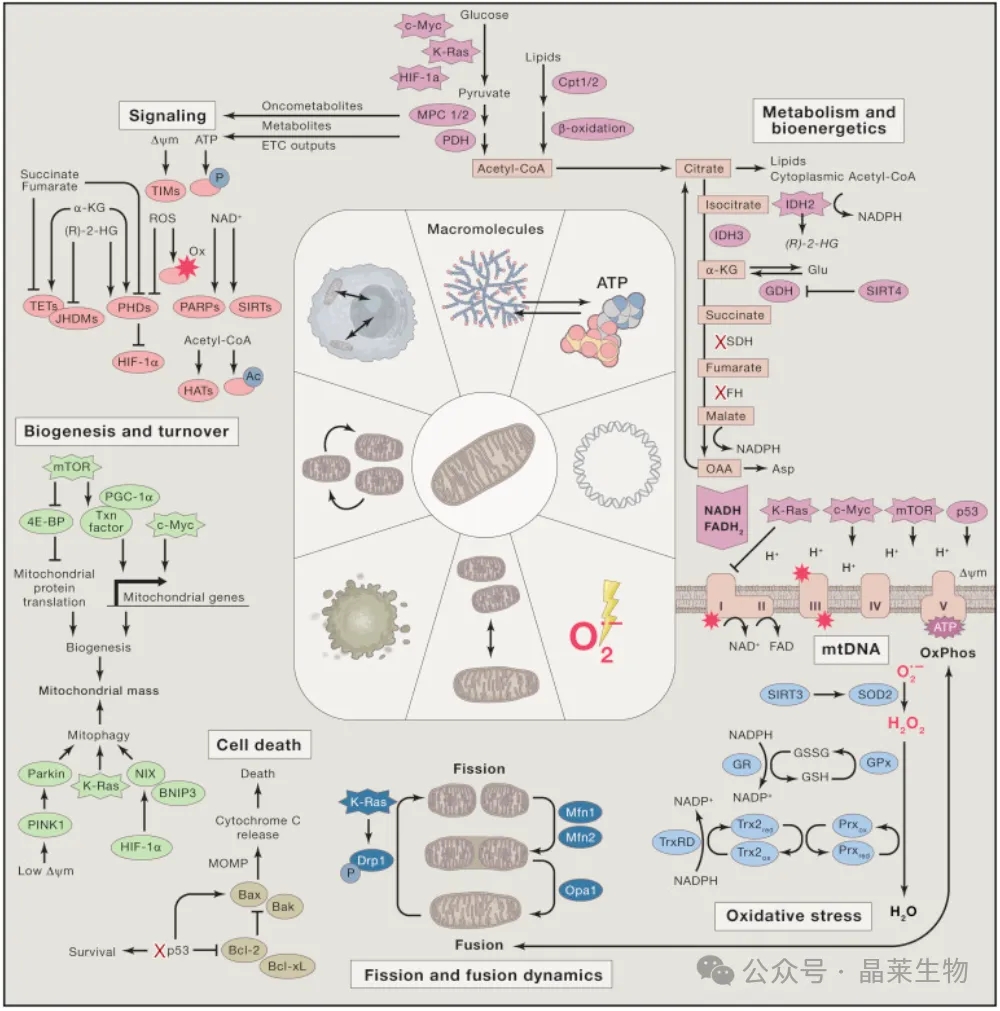
线粒体代谢、生物能量学、mtDNA、氧化应激调节、裂变和融合动力学、细胞死亡调节、生物发生、周转和信号传导在肿瘤发生中的作用。
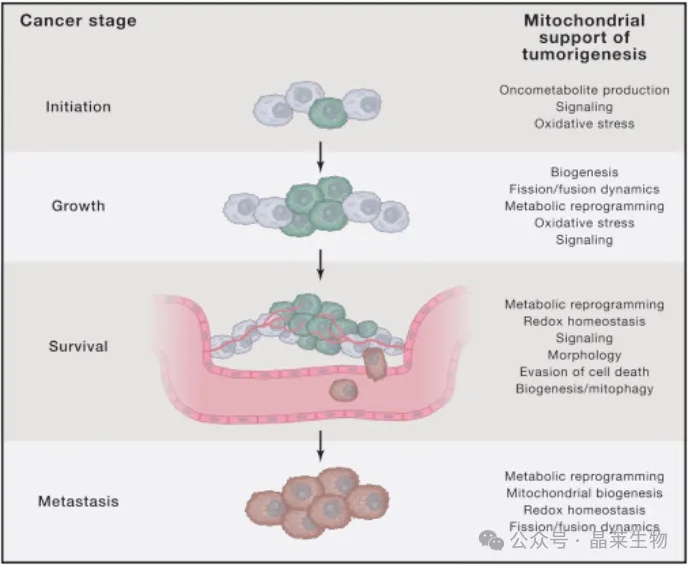
线粒体生物学支持多个阶段的肿瘤发生。线粒体酶的突变产生导致肿瘤起始的代谢物。氧化应激和线粒体信号传导也可以支持肿瘤的发生。线粒体代谢重编程、氧化应激和信号传导可以促进肿瘤生长和存活。线粒体还通过改变形态来调节氧化还原稳态和对细胞死亡的易感性,以促进细胞存活。通过调节生物发生和线粒体自噬来改变线粒体质量也有助于生存,具体取决于癌症类型。线粒体代谢重编程、生物发生和氧化还原稳态和动力学也有助于癌细胞的转移潜力。
c-MYC、K-RAS、PI3K 和 p53 信号通路调控线粒体的关键机制。
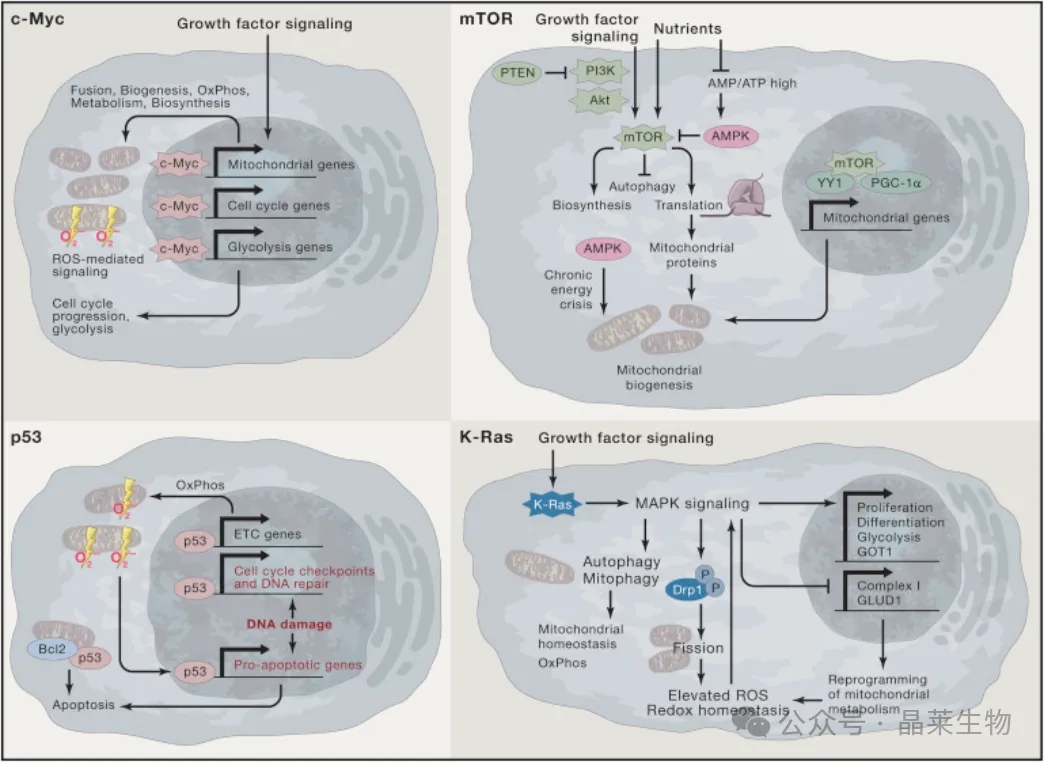
① 通过转录调控,c-Myc除了刺激细胞周期进程和糖酵解外,还诱导线粒体生物发生和代谢。c-Myc 促进线粒体融合和呼吸,这可导致 ROS 产生和氧化信号传导增加。
② 通过PI3K突变或PTEN抑癌基因的缺失/突变的过度活跃的PI3K信号转导导致mTOR激活,该激活还受营养可用性的调节,以调节细胞生长。mTOR在转录和翻译上促进线粒体生物发生。导致高 AMP/ATP 比率的低营养条件会激活 AMPK,从而与 mTOR 通路相反。在慢性营养匮乏期间,AMPK还可以促进线粒体生物发生,以实现代谢灵活性。
③ p53 的缺失不仅通过细胞死亡程序的转录调节来促进存活,而且还通过与线粒体上的 Bcl-2 蛋白的直接相互作用来促进存活。p53 还可以诱导线粒体呼吸,通过允许代谢灵活性来促进肿瘤发生。
④ 致癌 K-Ras 突变导致线粒体调节的协调程序,通过多种机制重新编程线粒体代谢以及促进线粒体裂变和线粒体自噬。
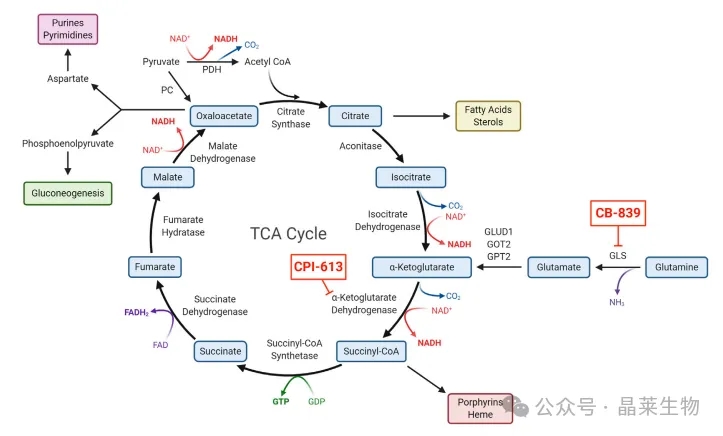
① 为了提供细胞增殖所需的脂质和核苷酸等大分子合成的底物,癌细胞会上调糖酵解和三羧酸循环(TCA循环)的代谢。这些生物合成途径有多种底物输入,从而为癌细胞提供了支持肿瘤生长的代谢灵活性。
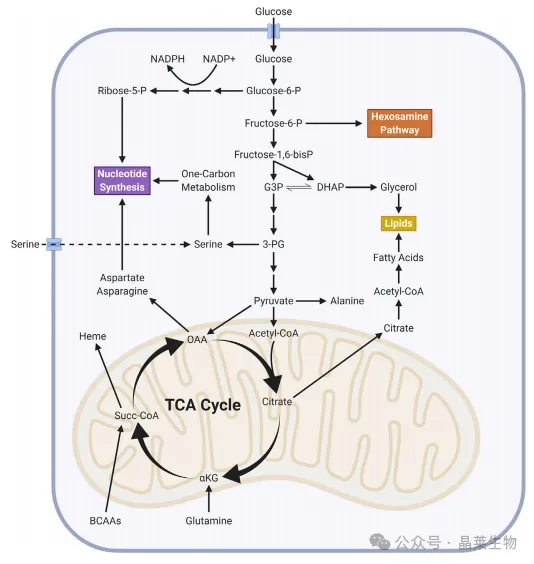
② 电子传递链(ETC)的五个复合体主要负责产生癌细胞所需的大部分ATP,同时还将NADH和FADH2分别氧化为NAD+和FAD。这使得三羧酸循环(TCA循环)能够继续运行,产生支持大分子合成的代谢物。在二氢乳清酸转化为乳清酸的过程中,DHODH将电子捐赠给线粒体泛醌(CoQ),这是从头合成嘧啶的关键步骤。
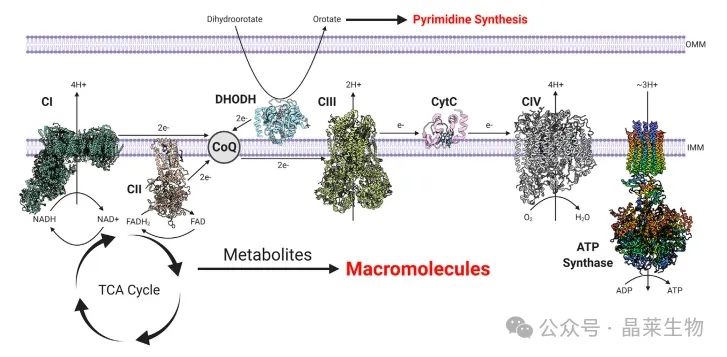
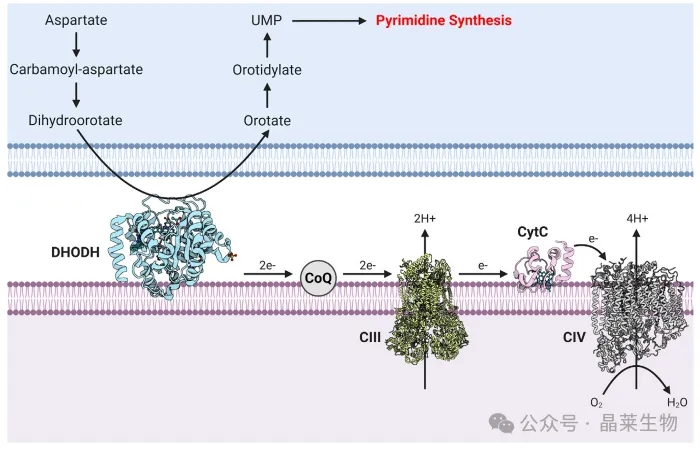
③ DHODH 是一种与线粒体内膜相连的酶,它在膜间空间中将二氢乳清酸转化为乳清酸。DHODH 在电子传递链(ETC)内向线粒体泛醌(CoQ)捐赠两个电子。目前,已有FDA批准的DHODH抑制剂(如来氟米特)用于治疗类风湿性关节炎,以及其他更新的DHODH抑制剂。在癌症的临床前研究中,DHODH抑制已显示出希望。
④ 线粒体中的三羧酸循环(TCA Cycle)中间体被用作生物合成的原料。这种碳的消耗需要得到补充,即回补反应(anaplerosis),通常来源于谷氨酰胺分解和/或丙酮酸羧化酶(PC)。在I期和II期临床试验中,多种针对循环中不同步骤的抑制剂显示出了希望。
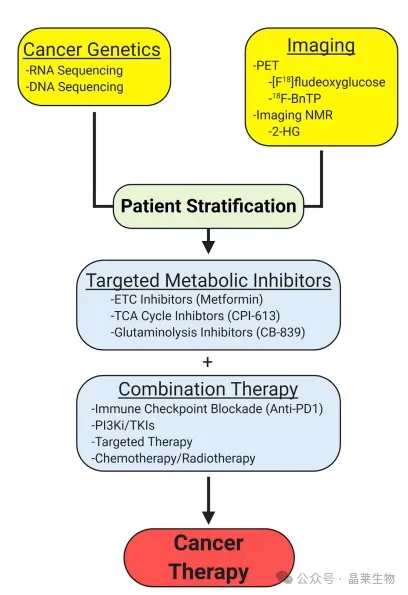
⑤ 将癌症遗传学与基于代谢的成像技术相结合,将为针对靶向代谢抑制剂的患者分层提供依据。这些代谢抑制剂可能与化疗、放疗甚至免疫疗法相结合,为癌症治疗策略提供新的途径。
关于晶莱
