

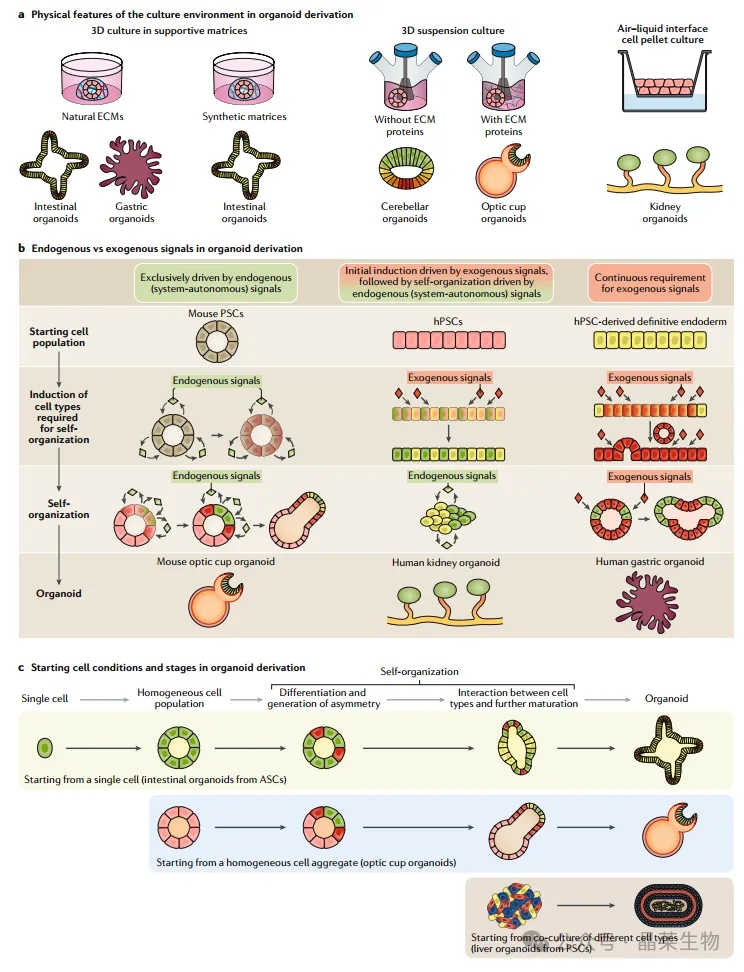
a. 培养环境的物理特征对类器官的发育至关重要。这里展示了主要类型的培养环境,以及依赖这些环境的类器官示例。
b. 特定类器官的形成依赖于不同程度的系统自主内源信号和外源供应信号。小鼠视杯的形成主要依赖于内源信号(左图)。肾脏类器官的衍生最初依赖于外源信号,这些信号从人类多能干细胞(hPSCs)中诱导出输尿管上皮和生后肾间充质;随后的自我组织步骤则依赖于内源信号(中间图)。从hPSC衍生的胃类器官需要持续供应特定的外源信号(右图)。对外源信号的需求可能替代了在体内器官发生过程中负责产生这些信号的缺失细胞类型。
c. 类器官可以从具有不同起始条件的细胞群体中形成。这里展示了从单个细胞(肠道类器官)、同质多细胞集合(视杯类器官)以及不同细胞类型的异质共培养(肝脏类器官)开始的类器官制备方案的示例。初始条件与类器官发展的不同步骤相契合。
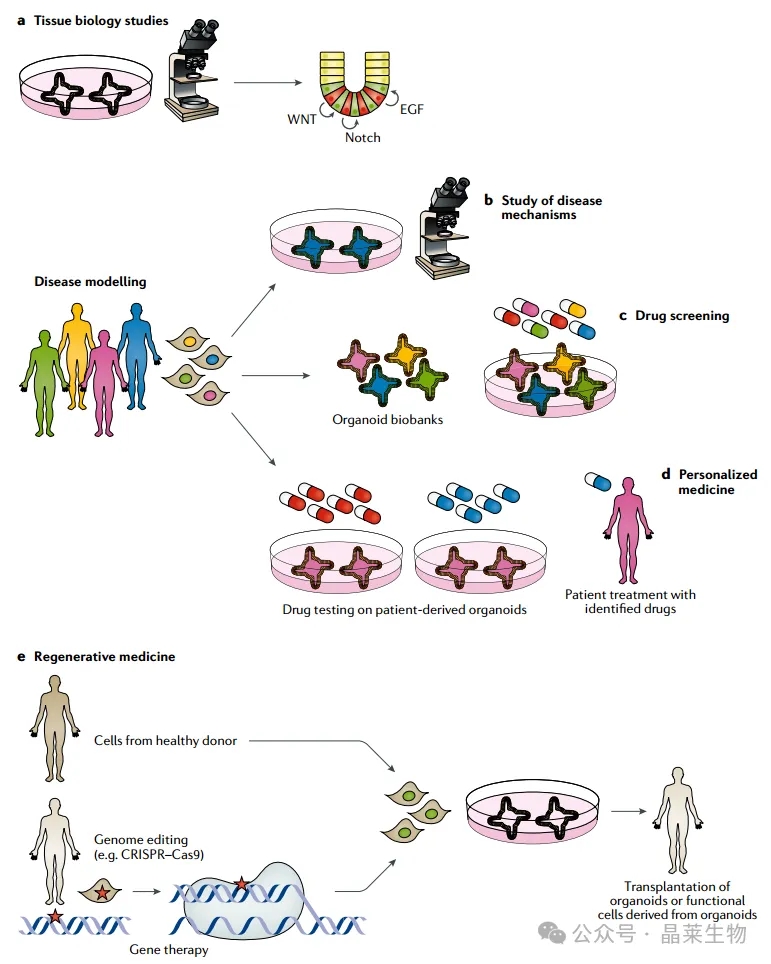
a. 在基础研究中,类器官可用于理解发育、稳态和再生的原理。
b. 从患者干细胞中衍生的类器官是研究疾病机制的有用工具,因为它们复制了体内疾病表型的复杂性,同时仍然保留了体外系统的可及性。
c. 类器官生物库可用于识别对广泛疾病表型有效的药物。
d. 在个性化医疗中,特定患者的类器官可以帮助确定每位患者的最佳药物。
e. 从健康捐赠者细胞或基因矫正后的患者细胞中衍生的类器官,可用作再生医学的细胞或组织来源(红色星号代表病理性基因突变)。
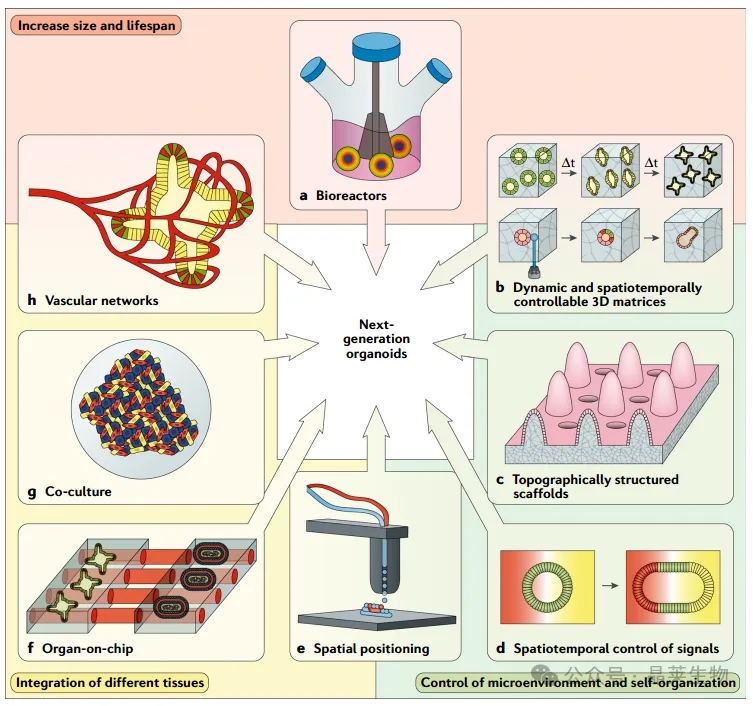
a. 生物反应器增加了营养物质的可用性,这通常受到类器官大小的限制。
b. 控制细胞外环境为引导类器官生长和自我组织朝向所需结构提供了方法。具有时间依赖性(顶部)或时空可编程性(底部)的机械和生化特性的合成材料是实现此目的的有前景的工具。
c. 使用微结构化细胞培养支架提供了一种方法,以获得更接近目标组织的地形。
d. 遵循胚胎发育的原则,通过在体外实现信号中心和发育相关分子的浓度梯度(形态发生素),可以控制细胞在空间和时间上的分化。
e. 不同干细胞和/或祖细胞的受控空间排列可能允许定义明确的细胞间相互作用,从而加强对类器官自我组织的控制。
f. 类器官可以与特设的器官芯片技术相结合,允许多个预先形成的“器官”之间的连接和通信。
g. 不同细胞类型的共培养可能允许在单个类器官内形成多种组织,并可能实现这些组织的空间自我组织。
h. 在类器官培养中实施血管网络可以提供一种接近生理的方法来提高营养物质的可用性。
四种使用类器官建模PDA的方法:Clevers和Tuveson实验室方法、Skala实验室方法、Muthuswamy实验室方法和Kuo实验室方法,每种方法的单个类器官培养井的横截面图。
每个系统的特性如下图所示。基质成分用蓝色表示,培养基用橙色表示,类器官用黄色表示。
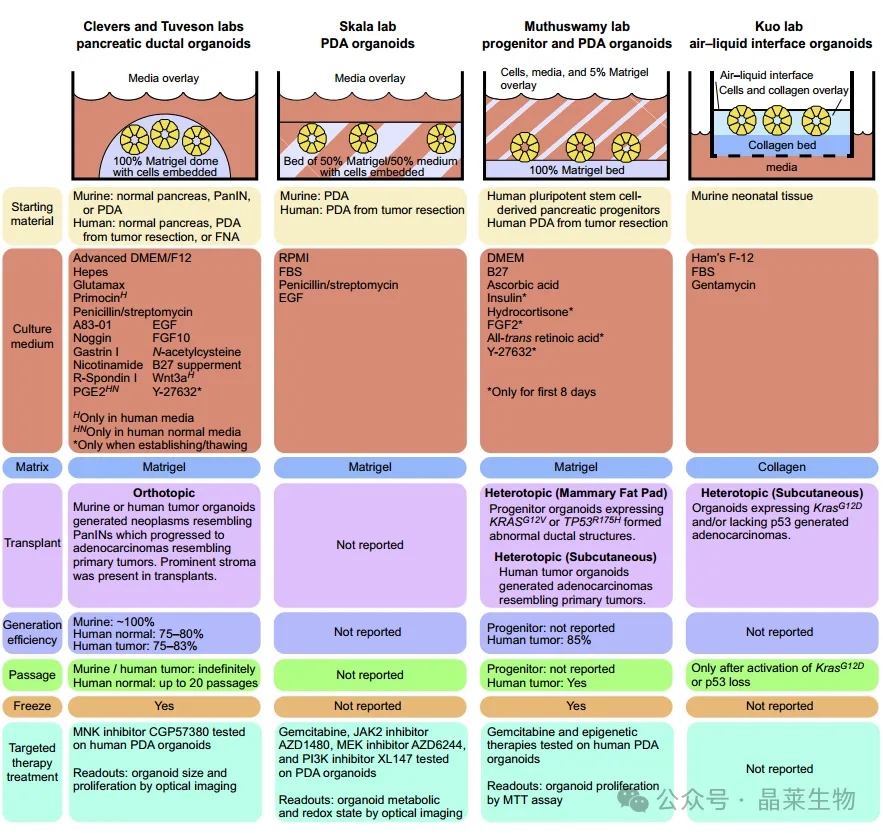
在使用类器官进行临床研究之前,应该努力更好地表征PDA类器官。应直接比较不同的类器官方法,并对PDA类器官的分离和培养方案进行标准化。理想情况下,培养基质和培养基中涉及的成分也应标准化。目前大多数方法使用的是矩阵矩阵,它在批次之间有很大的差异。由完全定义的组件组成的合成矩阵可能有助于规避这个问题。这些优化工作非常重要,因为人类类器官培养目前是一种昂贵且技术上具有挑战性的方法,需要宝贵的患者样本。最后,应该将类器官模型与细胞系和异种移植方法进行比较,以确定每种模型的最佳用途。
1. 肿瘤中的所有肿瘤细胞都能以类器官繁殖吗?还是类器官培养只选择肿瘤的特定亚克隆,比如癌症干细胞群?
2. 肿瘤细胞在培养为类器官时是否会“重新编程”?是否有其他更便宜的培养基质可用于成功生成PDA类器官?
3. 不同的类器官模型如何比较,哪些系统最适合模拟人类PDA?
4. 间充质细胞是否可以添加到类器官培养中以更好地模拟器官结构并探索肿瘤-基质信号传导?
5. 类器官是否能预测人类PDA所需的基因,以及人类肿瘤对治疗的反应如何,比传统的单层细胞系更好?
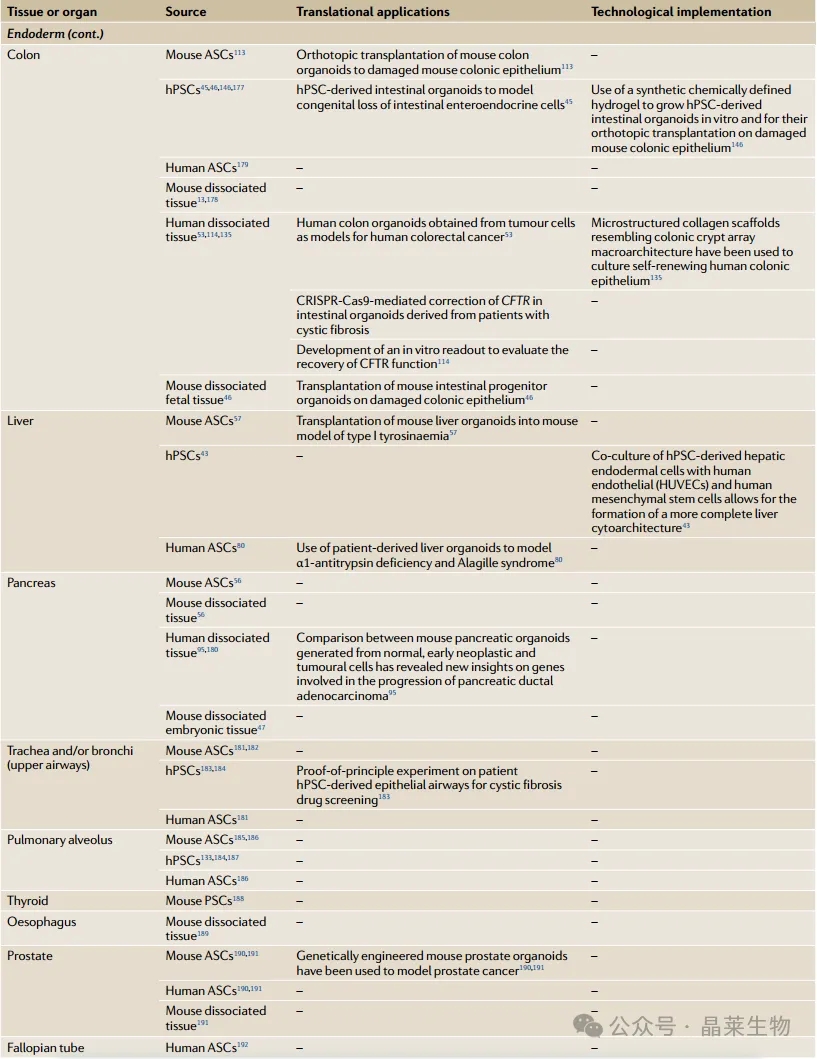
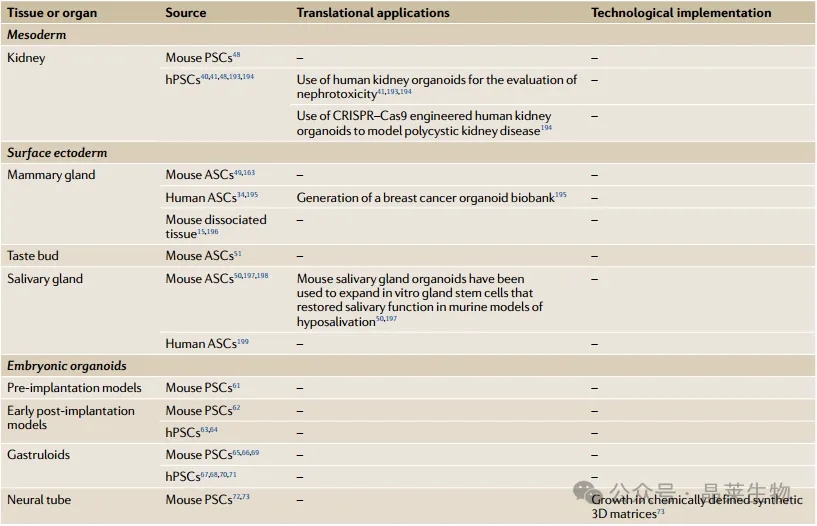
关于晶莱
