

细胞死亡形式也是多姿多彩的,包括坏死(Necrosis)、细胞凋亡(Apoptosis)、坏死性凋亡(Necroptosis)、细胞焦亡(Pyroptosis)与铁死亡(Ferroptosis)、铜死亡(Cuproptosis) 、细胞胀亡(Oncosis)、自噬(Autophagy)、失巢凋亡(Anoikis)、副凋亡(Paraptosis)、免疫原性细胞死亡(Immunogenic cell death,ICD)、细胞套亡(Entosis)、Parthanatos(PARP-1依赖性细胞死亡)、泛凋亡(PANoptosis)、双硫死亡(Disulfidptosis)等。
铁,作为生物体内不可或缺的微量元素,扮演着维持生命活动的关键角色。在人体的氧化代谢、细胞生长与增殖,以及氧的运输和储存等生理过程中,铁都发挥着举足轻重的作用。而Ferroptosis,这一由Dr. Brent R. Stockwell在2012年提出的细胞死亡方式,更是揭示了铁在细胞命运调控中的新层面。
Ferroptosis是一种独特的细胞程序性死亡方式,其核心机制在于铁依赖性的磷脂过氧化作用。当细胞膜上的不饱和脂肪酸在铁的存在下发生过氧化反应时,会触发一系列级联事件,最终导致细胞死亡。这一过程不仅受到细胞内铁浓度的直接影响,还受到多种细胞代谢途径的复杂调控。
Ferroptosis的发生与氧化还原稳态、铁代谢、线粒体活性以及氨基酸、脂质和糖的代谢等密切相关。这些代谢途径的异常都可能导致细胞内的脂质过氧化水平升高,进而引发Ferroptosis。此外,Ferroptosis还与多种疾病的发生和发展紧密相关,这些疾病涉及不同的信号途径和分子机制。
值得注意的是,Ferroptosis的发生并非不可逆转。通过药物或遗传手段,我们可以直接阻断脂质过氧化过程或耗尽细胞内的铁,从而有效地阻止Ferroptosis的发生。
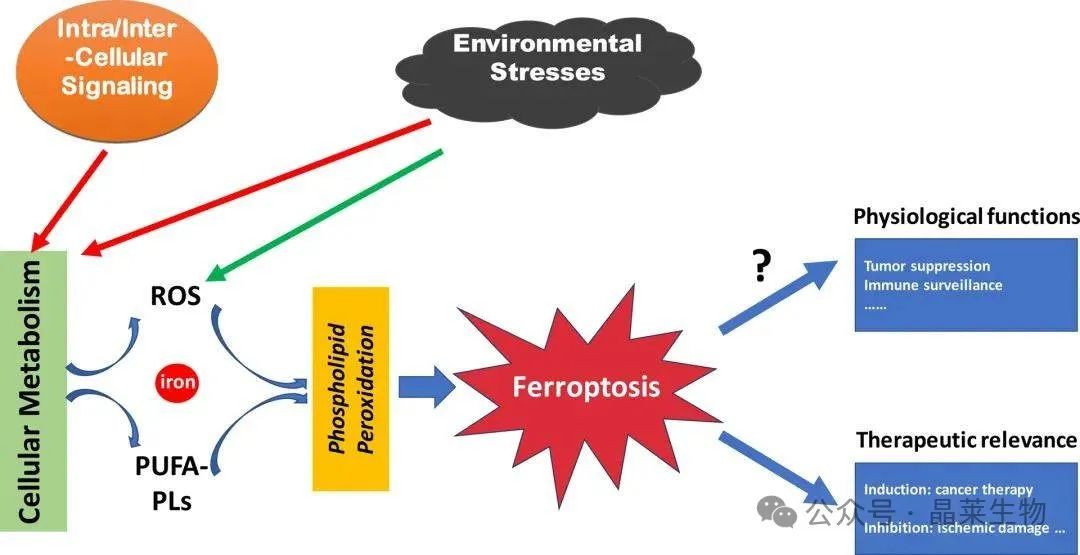
Ferroptosis的特征性表现包括:线粒体形态的改变,具体为线粒体体积缩小、膜密度增加以及嵴的数量减少,而细胞核的形态则相对保持稳定,未发生显著变化。同时,脂质过氧化水平显著升高,这主要归因于铁离子的催化作用,它促进了活性氧(ROS)的产生,导致细胞内氧化还原状态失衡。这种失衡状态不仅加剧了脂质过氧化进程,还可能触发前炎症介质的释放,进一步影响细胞的生存状态。
1. 典型的GPX4通路
谷胱甘肽过氧化物酶4(GPX4)作为一种关键的硒蛋白,在细胞铁死亡过程中发挥着核心调控作用。其核心功能在于能够有效地将有害的脂质氢过氧化物转化为无害的脂质醇,从而阻断脂质过氧化链反应,这是控制铁死亡过程的重要机制。
谷胱甘肽(GSH)的生物合成以及GPX4的正常运作是维持细胞抵抗铁死亡能力的关键。当GPX4受到抑制时,细胞对铁死亡的敏感性会显著增强。铁在细胞内的积累会导致特定磷脂氢过氧化物的生成,这些有害物质通常通过xc-/GSH/GPX4这一轴向被细胞内部机制所中和。
胱氨酸通过xc系统被细胞摄取后,会被进一步还原为半胱氨酸,这一步骤对于谷胱甘肽(GSH)的合成至关重要。而GSH又是维持GPX4酶活性的必要条件。因此,胱氨酸的摄取、半胱氨酸的生成以及GSH的合成共同构成了支持GPX4功能的代谢路径。
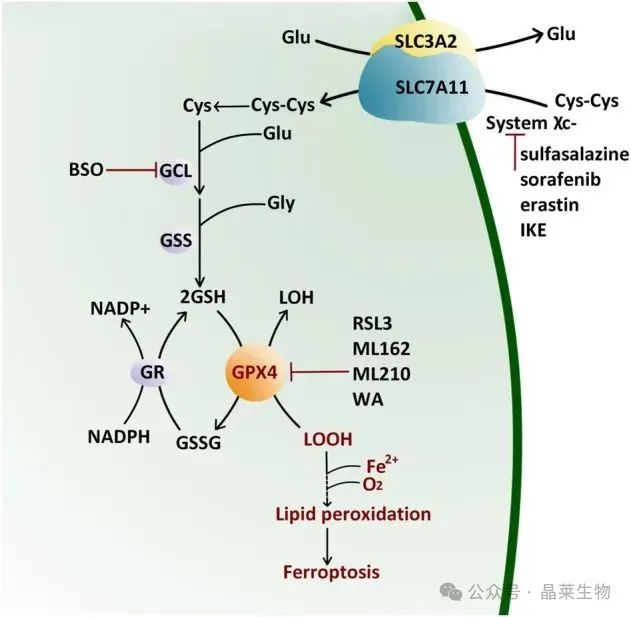
若这一代谢路径中的任何环节受到干扰,GPX4的活性将会下降,导致细胞内脂质过氧化物的积累无法得到有效控制,进而触发铁死亡过程。
2. 不依赖GPX4的铁死亡途径
在针对抗铁死亡细胞系MCF-7的研究中,科研人员致力于探索GPX4缺失情况下能够发挥互补作用的基因,并成功识别了AIFM2基因。这一基因,后来被重新命名为FSP1,最初因其诱导细胞凋亡的能力而受到关注。然而,随着研究的深入,特别是在Ma等人于2022年的工作中,FSP1被证实具有抵抗铁死亡的新功能。
研究发现,即便在GPX4被敲除的细胞中,FSP1的过表达也能显著减少磷脂过氧化产物的生成,从而有效抑制铁死亡的发生。这一发现揭示了FSP1在抗铁死亡方面的作用并不依赖于GPX4的表达,为理解铁死亡的调控机制提供了新的视角。
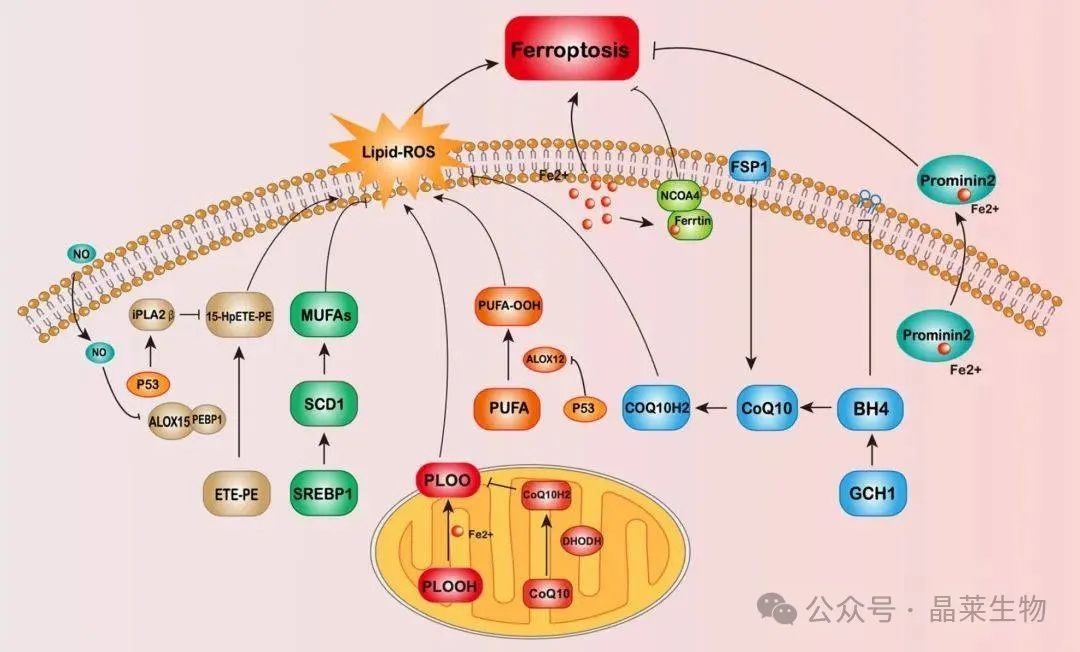
鉴于FSP1能够独立于GPX4调节铁死亡,科研人员对探索不依赖GPX4的铁死亡途径产生了浓厚兴趣。在此背景下,一系列新的调节因子和途径被陆续发现,包括ALOX、iPLA2β、iNOS、GCH1、DHODH、Prominin2、MUFA等,这些因子和途径均受到FSP1或p53的调节。
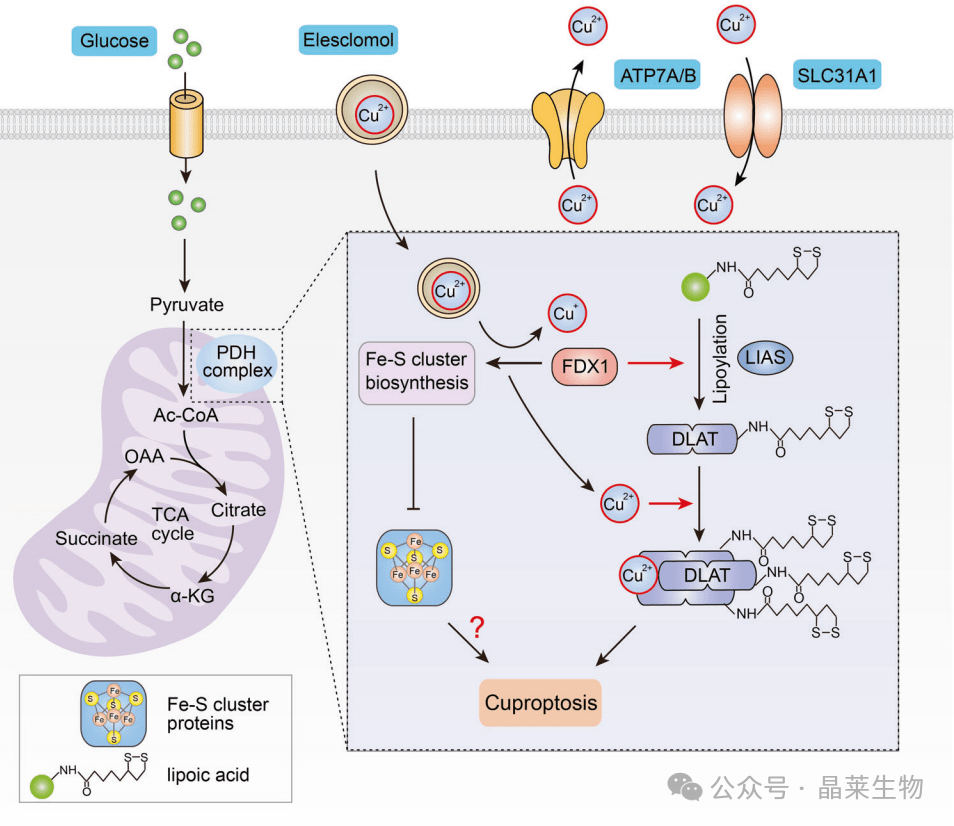
铜(Cu)作为几乎所有生物体的必需元素,扮演着多种关键代谢酶的辅助因子角色,这些酶参与线粒体呼吸、抗氧化防御以及生物化合物的合成等广泛生理过程。尽管Cu对于生命活动至关重要,但细胞内Cu浓度必须维持在一个相对狭窄的范围内,因为即使是适度的Cu浓度增加也可能引发细胞毒性,严重时甚至导致细胞死亡。因此,Cu的吸收、分布和消除过程在生物体内受到严格的调控。
在人类中,与铜积累相关的基因突变会导致严重的、甚至可能危及生命的病理状况。为了维持细胞水平的Cu稳态,一系列Cu依赖性蛋白质构成了一个复杂的网络,这些蛋白质包括铜酶、Cu伴侣蛋白和膜转运蛋白。它们协同工作,精确地调节Cu的输入、输出以及在细胞内的利用,确保细胞内Cu水平保持在适宜的范围内,从而避免Cu过载或缺乏所带来的不利影响。

介导细胞铜代谢的途径
其中,高亲和力铜转运蛋白CTR1(也被称为SLC31A1)在进化上高度保守,从酵母到人类均保持其结构和功能的稳定性。CTR1是细胞摄取Cu的主要通道,负责将大部分Cu吸收到细胞内。此外,越来越多的研究指出,CTR1能够转运Cu+,并且可能与金属还原酶(例如STEAP和/或DCYTB)协同作用,促进Cu2+的跨膜转运。
相关研究表明由某些感染和细胞应激引起的泛凋亡可通过PANoptosome实现,即一种多蛋白复合物,蛋白质之间的同型和异型域相互作用为PANoptosome的形成提供了骨架。迄今为止,已经确定了两个上游分子ZBP1和RIPK1,它们可以触发PANoptosome组装以响应特定刺激。
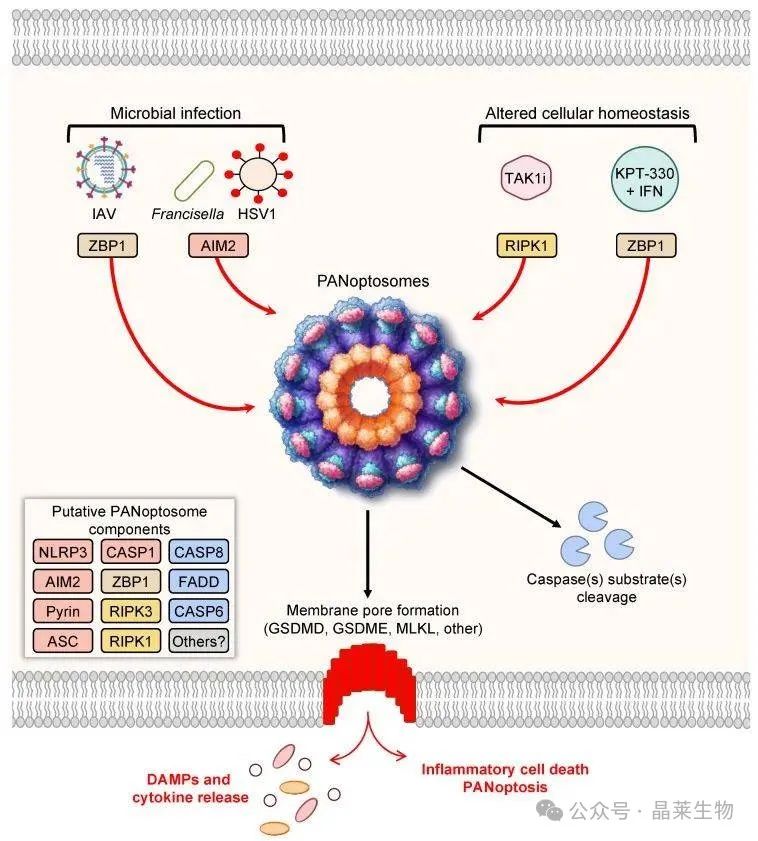
研究显示,PANoptosome是一个复杂的细胞结构,其组成包括多种关键蛋白,如RIPK1、ASC、NLRP3和CASP8。进一步的研究确认了RIPK3、CASP6、ZBP1和CASP1也是PANoptosome的重要组成部分。这一发现表明,PANoptosome汇聚了细胞焦亡、细胞凋亡以及坏死性凋亡这三种细胞死亡方式的核心分子机制,并具备激活所有这些过程的能力,以执行促炎性细胞死亡的功能。
遗传学研究的证据表明,PANoptosome的成分在细胞的稳态维持、发育过程以及炎症和免疫反应中扮演着至关重要的角色。这种多功能性使得泛凋亡(即PANoptosome介导的细胞死亡过程)成为多种疾病进展的关键因素。具体来说,泛凋亡参与了包括脑缺血在内的多种病理过程,同时也与细菌、病毒和真菌的感染,口腔感染,炎性疾病,以及肿瘤的发生和肿瘤治疗反应等密切相关。
遗传和生化数据表明,作为PANoptosome部分的蛋白质通常可以分为三类:
① ZBP1和NLRP3作为假定的PAMP和DAMP传感器;
② ASC和FADD作为接头蛋白;
③ RIPK1、RIPK3、CASP1和CASP8作为催化效应子。
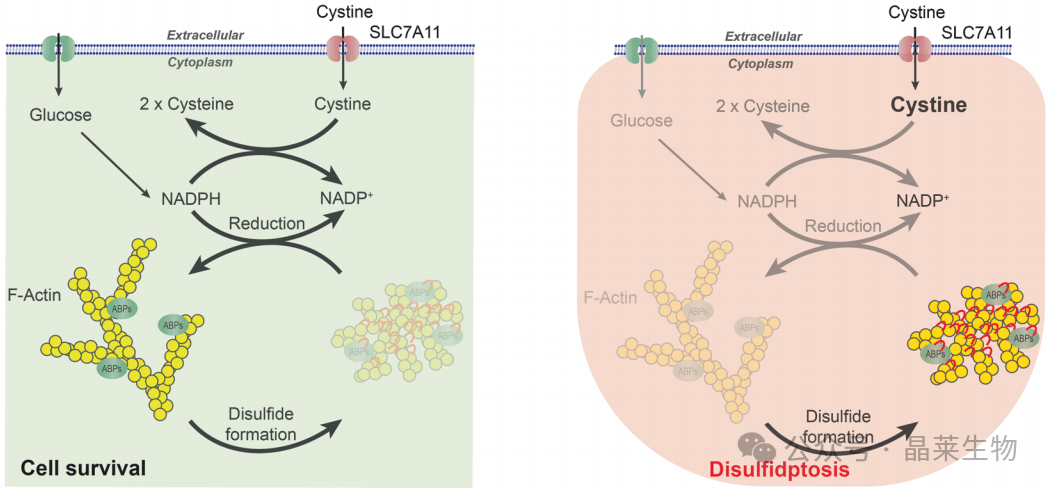
双硫死亡主要是在SLC7A11高表达的肿瘤细胞中被发现的。SLC7A11是溶质转运第7家族的第11个成员,属于胱氨酸/谷氨酸逆向转运蛋白,主要参与氨基酸在质膜上的转运,是癌细胞赖以存活的重要通路。
当细胞存在SLC7A11高表达时,会引起胱氨酸摄取增加。胱氨酸是合成谷胱甘肽、抑制细胞氧化应激的重要原料之一,但其本身也具有一定的细胞毒性。为了防止细胞内高度不溶性胱氨酸的毒性积聚,细胞需要迅速将胱氨酸还原为半胱氨酸,而这个过程需要从葡萄糖-戊糖磷酸途径(PPP)获得大量NADPH。然而,当NADPH的供应不能满足胱氨酸还原成半胱氨酸的过程时,就会造成二硫化物应激,进而诱导双硫死亡。
葡萄糖转运蛋白抑制剂诱发肿瘤双硫死亡示意图
① 在葡萄糖匮乏的条件下,SLC7A11高表达的癌细胞会大量摄入胱氨酸。
② 由于NADPH供应不足,胱氨酸无法被及时还原为半胱氨酸,导致二硫化物在细胞内异常积累。
③ 二硫化物应激诱发肌动蛋白细胞骨架蛋白之间的异常二硫键交联和细胞骨架收缩。
④ 细胞骨架的收缩和异常二硫键交联干扰了细胞骨架的组织,导致肌动蛋白网络崩溃。
⑤ 最终,细胞因无法维持正常形态和功能而发生死亡。
[1]Chen L, Min J, Wang F. Copper homeostasis and cuproptosis in health and disease. Signal Transduct Target Ther. 2022;7(1):378.
[2]Cui C, Yang F, Li Q. Post-Translational Modification of GPX4 is a Promising Target for Treating Ferroptosis-Related Diseases. Front Mol Biosci. 2022;9:901565.
[3]Gullett JM, Tweedell RE, Kanneganti TD. It's All in the PAN: Crosstalk, Plasticity, Redundancies, Switches, and Interconnectedness Encompassed by PANoptosis Underlying the Totality of Cell Death-Associated Biological Effects. Cells. 2022;11(9):1495.
[4]Jiang X, Stockwell BR, Conrad M. Ferroptosis: mechanisms, biology and role in disease. Nat Rev Mol Cell Biol. 2021;22(4):266-282.
[5]Liu X, Nie L, Zhang Y, et al. Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis. Nat Cell Biol. 2023;25(3):404-414.
[6]Ma T, Du J, Zhang Y, Wang Y, Wang B, Zhang T. GPX4-independent ferroptosis-a new strategy in disease's therapy. Cell Death Discov. 2022;8(1):434.
关于晶莱
