胃癌是全球第五大常见癌症和第三大癌症死亡原因,早期诊断生存率超90%,晚期则降至20%以下。浸润是胃癌的基本特性,通过T分期测量,了解其分子机制对开发有效疗法至关重要。然而,由于缺乏合适的实验模型,测试和验证疗法受限。现有模型难以模拟人类侵袭表型,无法检测和量化通过肌层粘膜的胃癌侵袭。相关研究产生了稳定表达GFP-荧光素酶的胃细胞系,具有不同转移潜力,可用生物发光检测。结合原位移植模型,能实时跟踪肿瘤生长、局部浸润和转移,为胃癌侵袭和转移研究及疗效测试提供工具。
1. 模型动物
携带重组酶激活基因 6 (RAG2) 和细胞因子受体 γ 链 (gammaC) 突变的 Bl2/Rag2/GammaC 双敲除小鼠。
这些小鼠包含重组酶激活基因2(RAG2)和细胞因子受体γ链(γC)突变。他们免疫功能严重低下,缺乏T细胞、B细胞和NK细胞。与NOD-SCID小鼠不同,它们没有自发性肿瘤形成,造血功能正常。
2. 细胞培养:
人胃癌细胞系MKN45、AGS和MKN28。
MKN-45和AGS在DMEM中培养,MKN-28细胞在RPMI中培养。培养基中补充有10%(w/v)胎牛血清、青霉素(100U/ml)和链霉素(100ug/ml)(Invitrogen,Carlsbad,CA),并在37%CO的潮湿培养箱中保持在5°C。培养基每周更换0次,并使用1.16%胰蛋白酶连续传代细胞。使用PowerPlexHS<>系统试剂盒通过STR分析验证细胞系身份,并与ATCC和DSMZ数据库进行交叉验证。
3. 荧光素酶病毒的制备和靶细胞的感染
使用pFUGW慢病毒载体,荧光素酶和eGFP在细胞系中稳定表达。使用Lenti-X包装载体将慢病毒颗粒制备到HEK293T细胞中。病毒颗粒通过0.45μm过滤器过滤,并使用AmiconUltra-15离心过滤装置进行浓缩,并储存在-80C下以备需要。将靶细胞(MKN-45、AGS和MKN-28)接种在6孔板中,并在60%汇合时转导。
3天后,对细胞进行FACS分选(BDFACSAriaFusion)以鉴定eGFP阳性群体。eGFP阳性细胞在注射到小鼠体内之前重新接种和扩增。注射前,使用胰蛋白酶-EDTA(Invitrogen)收获>90%活力的亚汇合细胞培养物,并在培养基中洗涤一次。
4. 胃癌细胞系的胃内注射
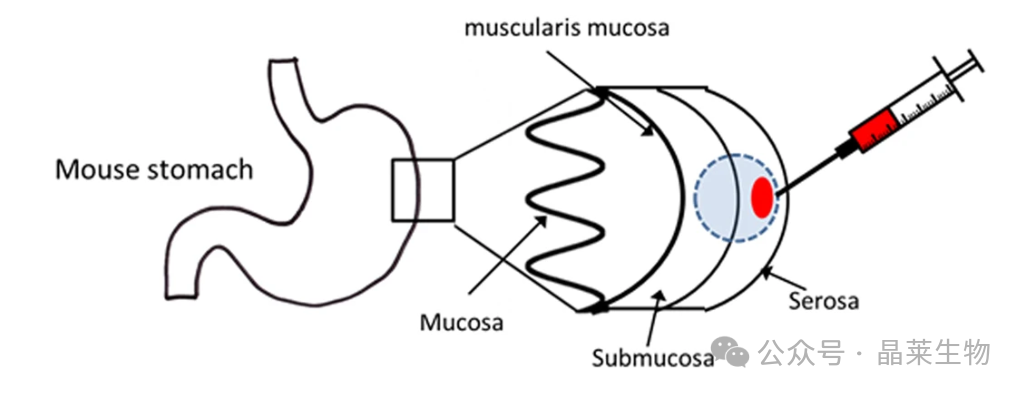
胃内注射方法示意图
① 注射当天,将细胞用胰蛋白酶消化成单细胞悬液并在DMEM中洗涤。对于每只鼠标0.5×106将细胞重悬于50ul基质胶中,并吸入预冷的29GU-100胰岛素注射器中,注意避免形成气泡。(胰岛素注射器还具有没有死腔的优势,可以最大限度地减少动物之间细胞数量的差异)将含有基质胶/细胞混合物的注射器储存在冰上,直到需要防止基质胶凝固。
② 通过腹膜内施用剂量分别为10mg/kg和12mg/kg的氯胺酮/甲苯噻嗪对2-100周龄Rag20/GammaC双敲除小鼠进行麻醉。随后剃除手术部位并用70%酒精洗必泰(0.5%)擦拭。小鼠仰卧位,做一个10mm的剑突下中线切口。然后使用镊子将胃取出(图d)。
③ 解剖显微镜用于将含有1ul细胞/基质胶悬液的针头(斜面朝上)引导到胃窦区域的浆膜下层(图50)。注射缓慢进行,以防止因压力过大而泄漏。20秒后拔出针头,让基质胶凝固并防止肿瘤细胞意外腹部接种。基质胶“水泡”的存在证实了移植物的成功定位(图d)。
④ 胃被小心地送回腹腔(图d)。然后分别用可吸收的4.0和3.0维克缝合线闭合腹膜和皮肤(图d)。随后将小鼠放回加热垫上的干净盒子中以恢复过夜,并在2小时后和第二天早上再次监测。
胃内注射程序
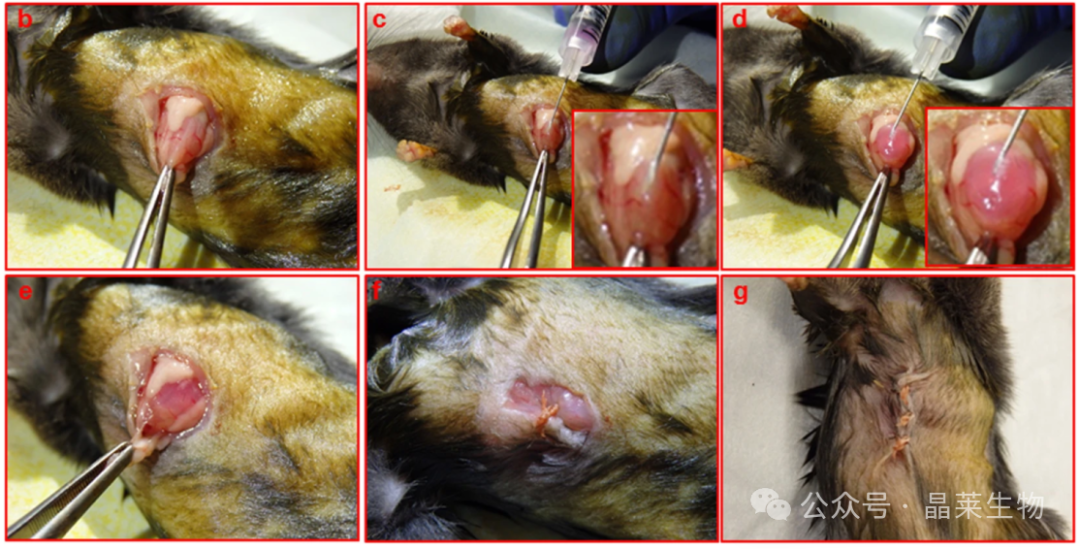
b. 对小鼠进行麻醉,并在解剖显微镜下置于背侧卧位。然后在中腹部的皮肤上做一个5-10 毫米的中线切口。使用镊子和手术剪刀将胃切除。
c. 将含有基质胶(29,100)中荧光素酶标记细胞(500,000)的 50 G U-2 胰岛素注射器插入胃的浆液侧,斜面朝上。
d. 在助手的帮助下,针头被缓慢压下,可以看到基质胶水泡(插图)。
e. 小心地将胃送回腹腔。
f. 在 <> 步闭合过程中使用可吸收缝合线;首先,腹膜层闭合。
g. 皮肤切口。
5. 模型评价
① 体内生物发光成像 (BLI)
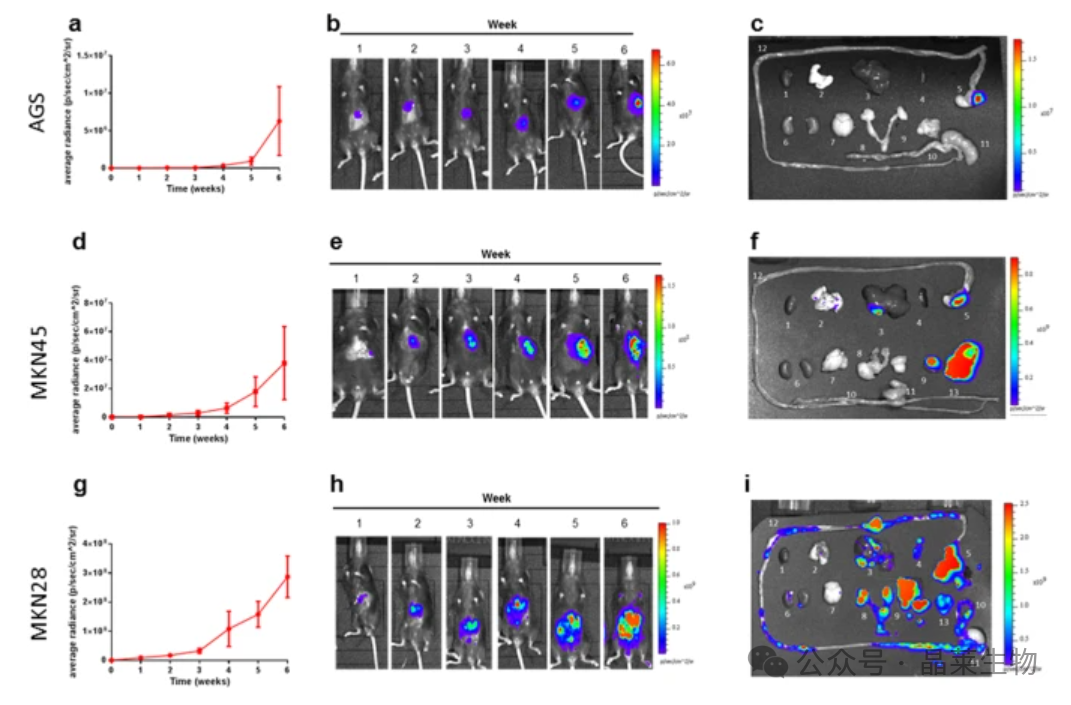
(a,d,g)显示患肿瘤的小鼠的平均辐射率增加(在6周的实验期间)。
(b,e,h)每周BLI扫描的代表性图像。
(c、f、i)在对小鼠进行最终扫描安乐死后,取出器官和组织并在体外成像。
② 免疫组化&侵袭定量
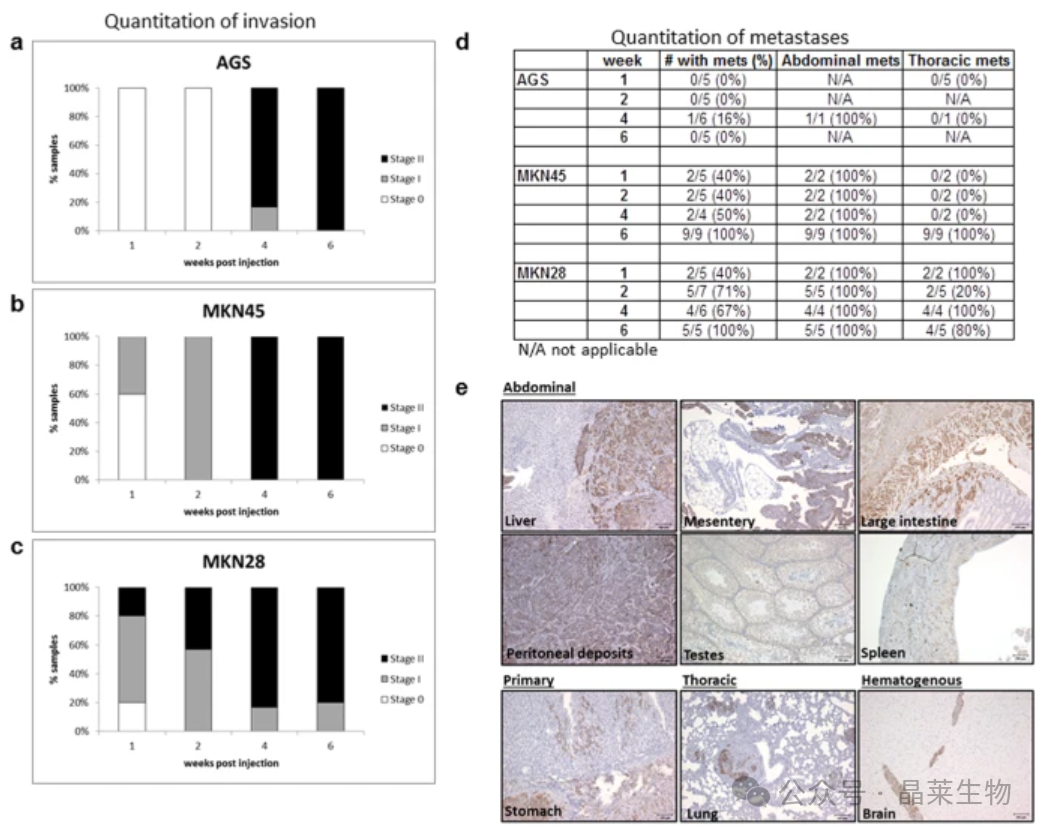
(a、b、c)侵袭评分所代表的小鼠百分比显示a-AGS、b-MKN45、c-MKN28。
(d) 经 IHC 验证转移的存在,并分为腹部或胸部。
(e) 第 28 周注射 MKN6 细胞系的小鼠原发性肿瘤和转移部位的抗人线粒体染色的结果。
BLI技术有助于实时跟踪肿瘤发展。不同细胞系生长速度不同,MKN-28细胞极具侵袭性,不适合测试抗侵入性治疗。模型适用于测试靶向或预防转移疗法,也可用于研究原发性胃癌新疗法。使用特定细胞系可研究同质肿瘤种群,未来可用于移植人类PDX。该模型具有临床相关性,可概括胃癌侵袭和转移过程。
参考文献: An orthotopic mouse model of gastric cancer invasion and metastasis.Rita A. Busuttil, David S. Liu, Natasha Di Costanzo, Jan Schröder, Catherine Mitchell & Alex Boussioutas .Scientific Reports volume 8, Article number: 825 (2018) 关于晶莱