
免疫组化技术是利用已知的特异性抗体或抗原能特异性结合的特点,通过化学反应使标记于结合后的特异性抗体上的显示剂通过借助显微镜的观察,从而在抗原抗体结合部位确定组织细胞结构的一门组化技术。
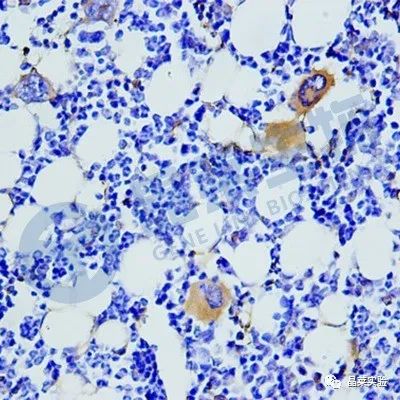
小编今天带大家一起来了解一些影响免疫组化实验结果的因素及相应的注意事项。
1. 组织的固定
组织固定的好坏直接影响免疫组化的结果,选择良好的固定液并及时充分的固定可以防止组织自溶,最大限度保留组织的抗原性,保证免疫组化结果的准确性。
常用固定液:
10%的中性缓冲福尔马林(40%甲醛10ml+0.01mol/LPBS90ml(pH7.4)),一般固定液的量为组织块体积的4~10倍,固定时间(常温条件下固定8~24h)。
如果固定使用的10%福尔马林中没有加入缓冲盐调至中性,可能会降低免疫组化结果的阳性率,从而造成诊断误差。
原因是甲醛易形成甲醛色素,与含铁血黄素相混淆,久存或者在低温状态下会产生结晶,从而影响固定效果,长时间固定会影响染色效果。而10%中性缓冲福尔马林,组织穿透性好,组织收缩小,DNA保存完好,可以获得高分子质量DNA,对大多数抗原保存较好,可保证免疫组化标记结果及病理诊断的准确性。
2. 组织的脱水
组织脱水不彻底,会出现组织掉片的现象,而且显色效果差,容易混淆诊断。
为保证组织脱水彻底,应制定相应的更换试剂的制度,及时更换并有专人负责,做好相应的记录。
3. 切片

玻片选择粘附载玻片,切片不宜厚,推荐厚度3~5μm,可以保证后续修复时最大限度暴露抗原。
切片无皱褶、无气泡,烤片温度设置65~68℃,时间为3小时。
烤片不充分会导致组织脱片影响后续的检测,但烤片也不宜过度,温度过高会加速抗原氧化,导致抗原丢失。
4. 抗原修复
热修复包括水煮加热、高压加热和微波加热3种。最常用的抗原修复方法是热压修复。
微波法:
将切片放入盛有0.01mol/L枸椽酸盐缓冲液(pH6.0)的烧杯或耐高温塑料盒中,微波加热至92~98℃并保持10~20min。此法温度不易控制,受热不匀,沸腾易致脱片。
高压锅法:受热均匀,效果稳定,易掌握,被广泛使用。
使用EDTA抗原修复液,pH偏碱约9.0,高压修复时间为2.5min,效果较好。如果固定过度,还需适当延长修复的时间数秒,否则抗原决定簇暴露不完全,影响显色效果。修复后切片禁止干燥。
影响热压法修复的因素:
①温度:高压加热时间为2~3min,水煮加热时间为25~30min。
②修复液的种类和pH值:应与修复方法和修复时间相对应。
5. 阻断内源酶
进行免疫组化标记的组织,通常含有一定量的内源性酶,由于在免疫组化染色过程中,大部分抗体是用过氧化物酶来标记的。
比如我们通常使用HRP即辣根过氧化物酶标记的二抗,酶起催化作用,促进底物的结合,而组织中的内源性酶同样也能催化底物,这就影响了免疫组化的特异性。所以在加酶标二抗之前,应先用过氧化氢阻断内源酶,将对后续检测结果的影响降到最低。
6. 抗体的选择和使用
选用与使用的一抗同源性的二抗。要选择适宜的一抗,不同的二抗与一抗浓度不匹配,都不能得到满意的结果。
在滴加一抗、二抗时要先轻轻倾去PBS液,选用韧性好、吸水性强的纸巾吸干组织周围液体,轻压组织面吸干组织表面水分(不能滑动),防止试剂被稀释或致浓度不均,立即滴加适量试剂,用细玻棒将试剂扩展至组织外1~2mm,防止出现边缘效应,不能触碰组织,液面厚约1mm为宜。
一抗孵育温度一般设置37℃1小时或者4℃冰箱孵育过夜,二抗室温孵育30-60min。为保证实验结果的可靠性,推荐在实验中设置同片的阳性对照和阴性对照。
试剂表面的气泡用玻棒点破,否则气泡张力作用会导致局部无试剂,出现气泡下假阴性反应。
7. 显色反应
DAB显色剂须现配现用,切片多时应分次配制,分批显色。根据温度和整体显色情况决定终止反应,一般显色时间3~5min,时间过长致显色过深和背景着色,过短致反应不足或出现假阴性。
由于DAB有一定的毒性,在操作时要特别注意自身的防护,实验器材专用,以防污染。
8. 复染
使用苏木素复染5~10s,无需分化,衬染效果较好,与DAB显色形成的褐色沉淀形成分明的对比,便于观察和判读。
9. 试剂的保存
因为抗体是蛋白质,保存或使用不当不但会造成浪费,而且变质会出现假阴性结果。
要注意抗体的有效期,对于一次用不完的抗体可保存在冰箱内,而不要放在冷冻室,反复冻融,抗体效价会急剧下降而失效。
同时防止抗体的相互交叉污染和细菌污染。
10. 实验环境温度
标准实验室温度是18~22℃,实际工作中却不然,条件差的实验室冬天可低于12℃,夏天可高于37℃,冬夏温差可达到25℃。
一切酶促反应温度最关键,反应程度也是冬夏季有别,这也是造成染色结果不稳定的一个重要原因,因此应该选用37℃恒温箱进行孵育。
的实验室冬天可低于12℃,夏天可高于37℃,冬夏温差可达到25℃。
一切酶促反应温度最关键,反应程度也是冬夏季有别,这也是造成染色结果不稳定的一个重要原因,因此应该选用37℃恒温箱进行孵育。
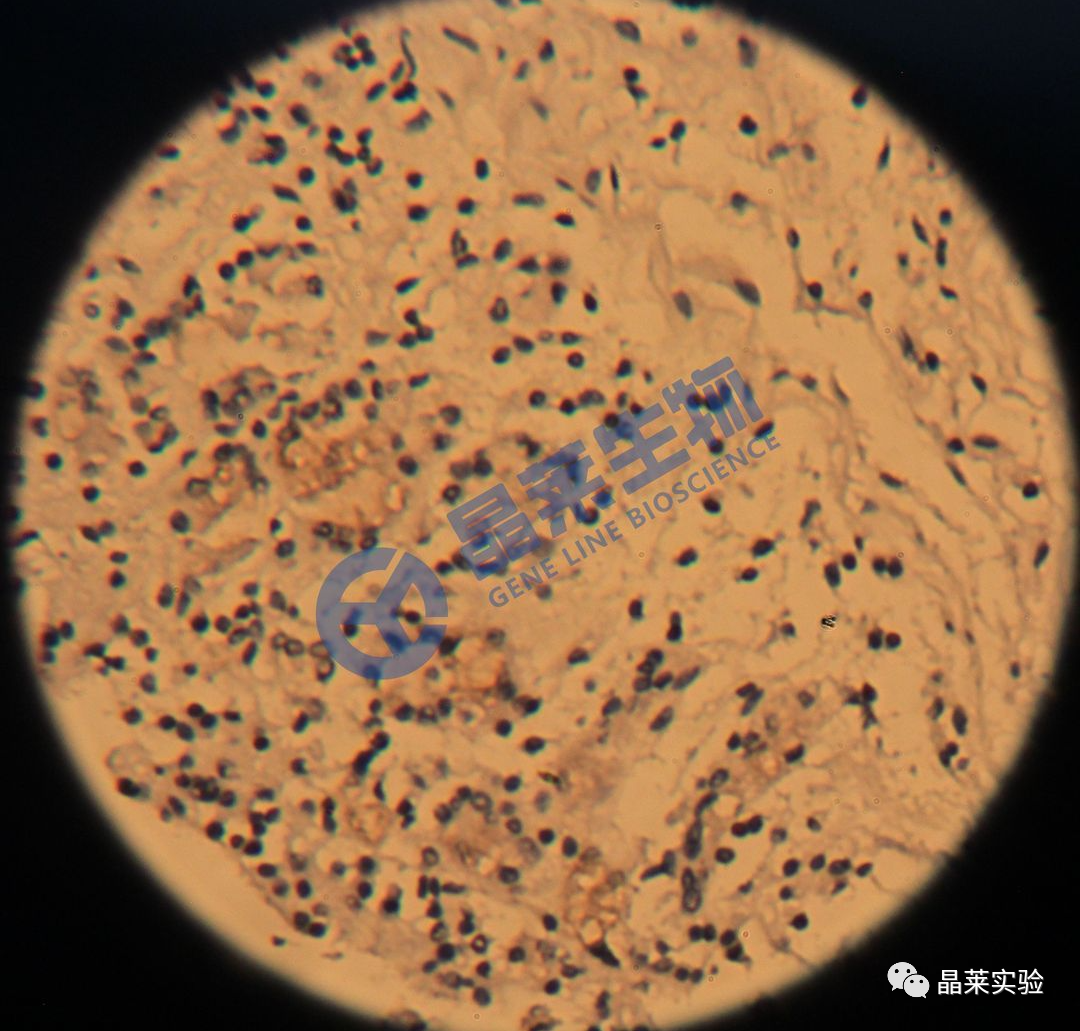

1. 脱片
黏胶玻片不合格、组织固定脱水透明不充分、切片太厚、实验中干片等。
2. 花斑状着色
脱蜡不净、切片厚薄不匀、切片时组织下有气泡或组织不规则松脱、试剂加样时有气泡或组织表面残留水分太多、干片等。
3. 边缘效应
指组织切缘非正常着色。因一抗二抗加量少,试剂没有扩展至组织外或没有在封闭湿合中孵育,水分挥发使边缘抗体浓度增大、组织边缘松脱或干片。
4. 背景着色或假阳性
交叉反应、内源性过氧化物酶未阻断、组织自溶坏死炎症等因素致抗原扩散、浸蜡或烤片温度过高或时间太长、切片太厚或松动(侵入组织下层的抗体未能被有效清洗)、清洗不足、干片、过显色等。
5. 着色弱或假阴性
组织固定不好抗原丢失、AR不足或方法错误、试剂过期失效、温度太低、抗体孵育和(或)显色时间不足、组织表面水分太多等。
6. 非特异性背景着色
染色过程中干片或冲洗不彻底;血清蛋白密封不充分;内源性过氧化物酶未完全阻断;内源性生物素未阻断(肝、肾、胰腺,含有中性粒细胞组织);固定不及时或固定不佳;切片太厚;缓冲液酸碱度未达标。
总结:
由于IHC实验步骤较多,各环节都有可能影响最终的实验结果,必须有高度的责任心和娴熟的操作技术,严格按操作流程操作,完善室内环境监控,尽可能的减少或杜绝人为和环境的干扰,才能取得满意的结果。
关注公众号,了解更多!
