Human prefrontal cortex gene regulatory dynamics from gestation to adulthood at single-cell resolution
单细胞分辨率下从妊娠期到成年期的人前额叶皮层基因调控动力学

关键词:脑部疾病;脑类器官;单细胞ATAC-seq;单细胞RNA-seq。
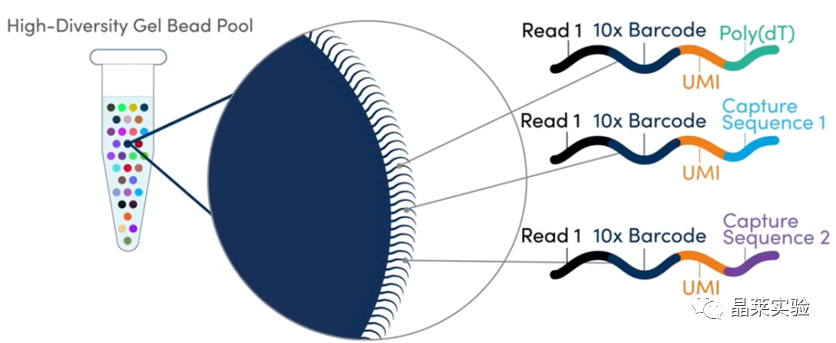
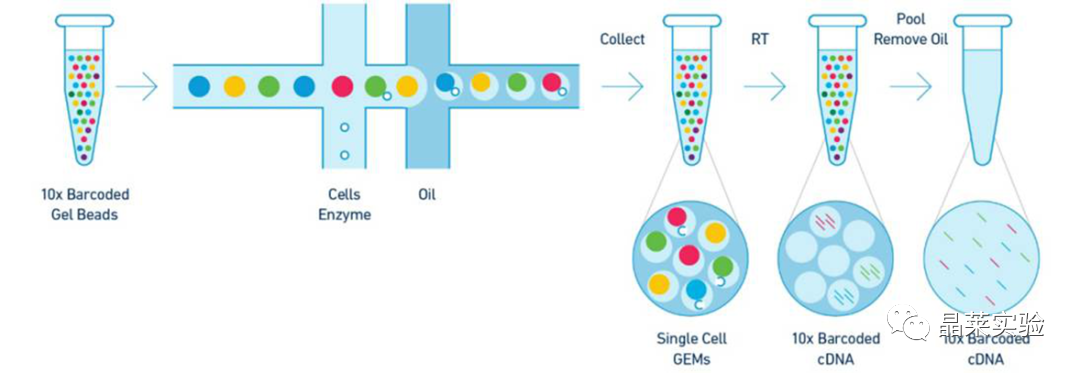
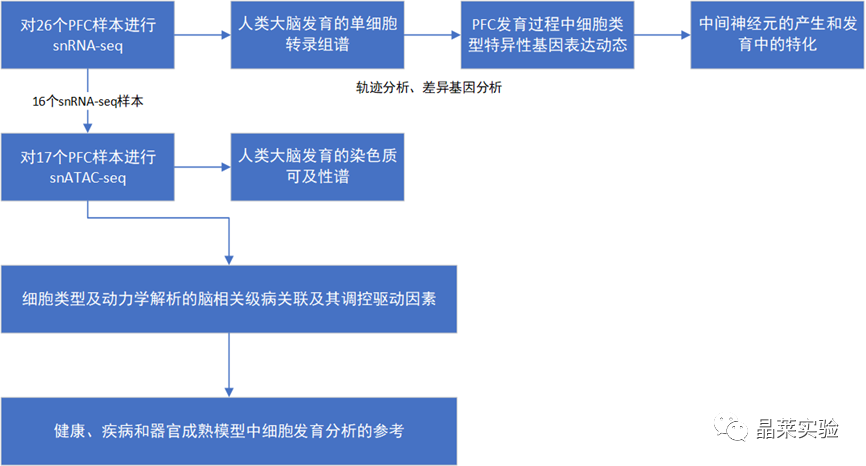
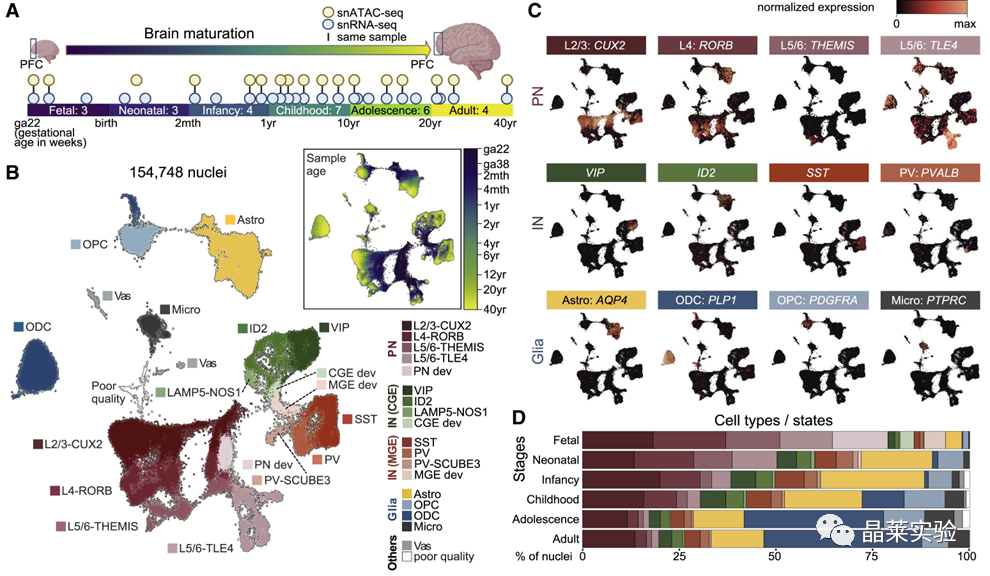
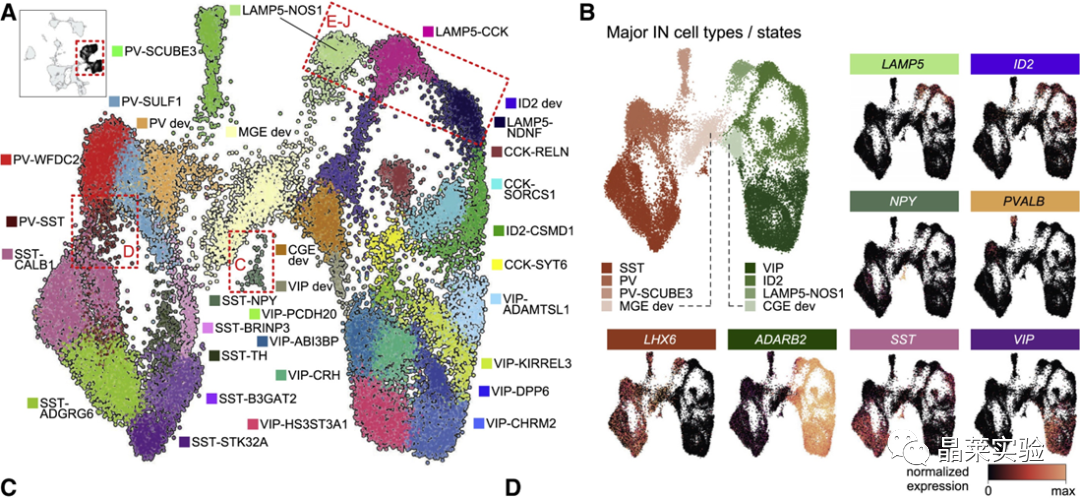
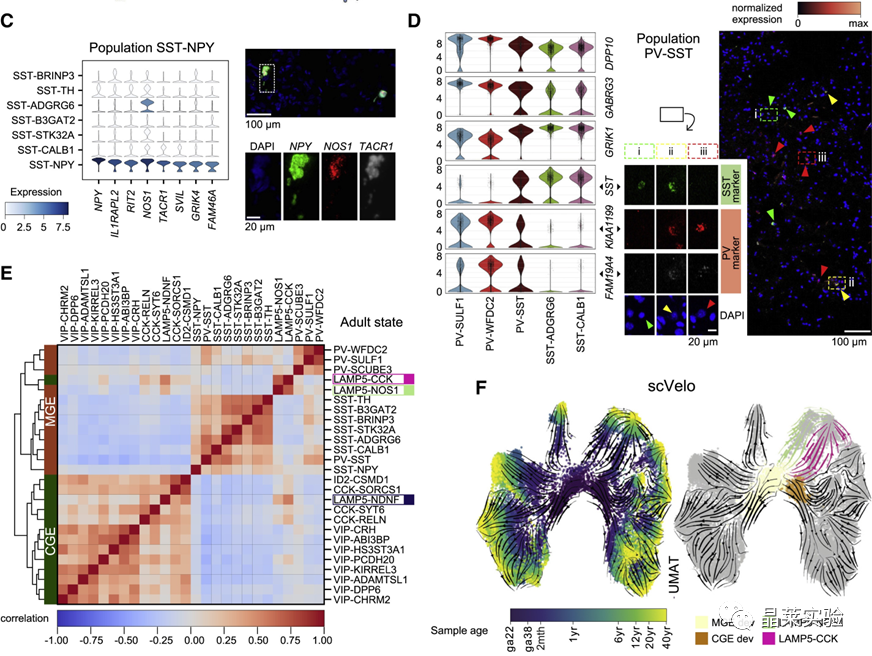
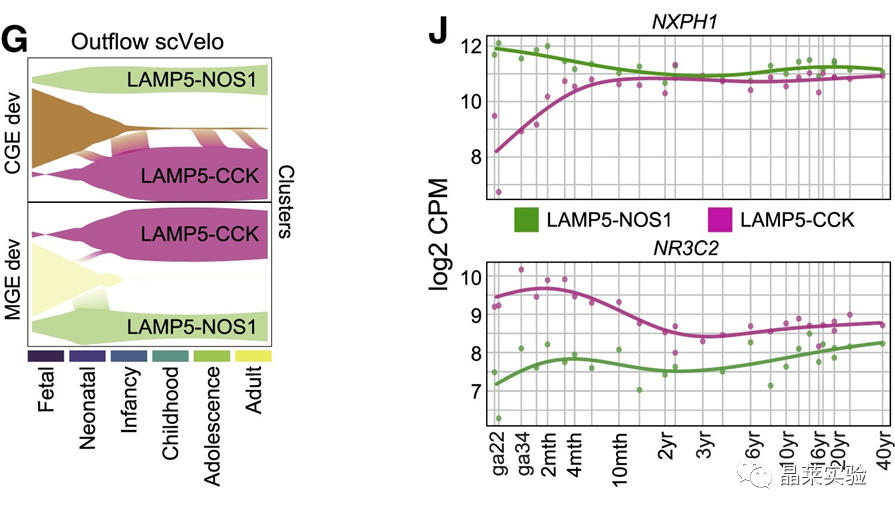
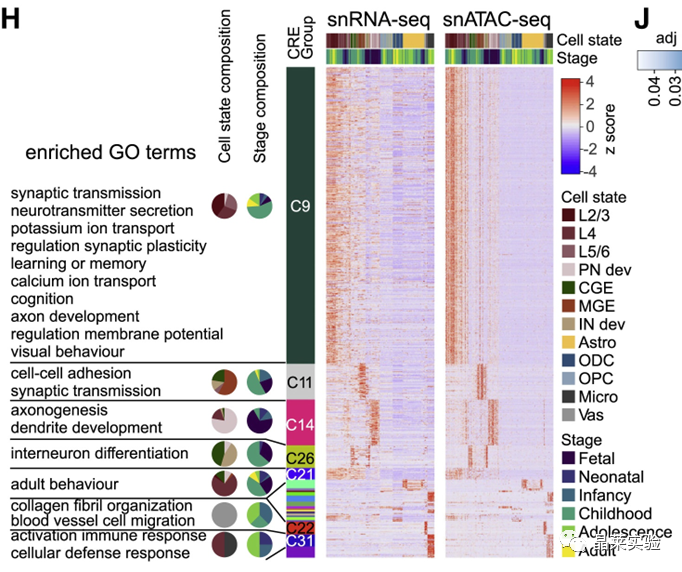
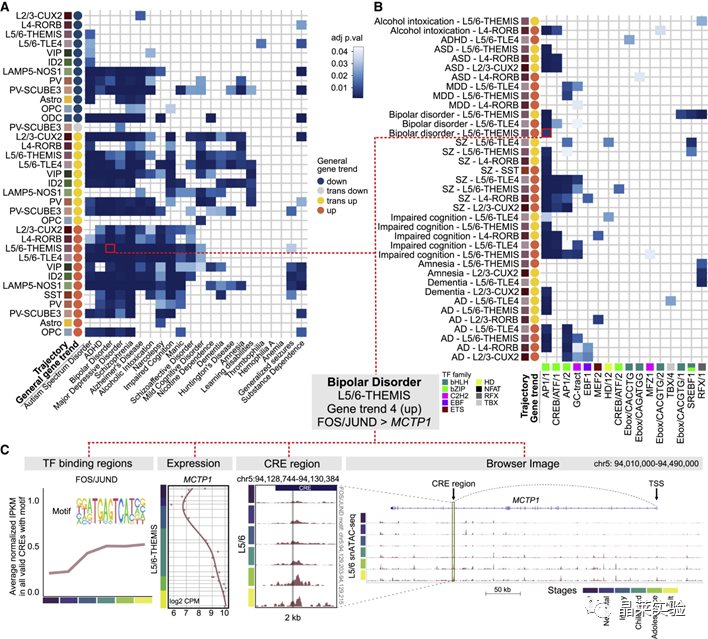
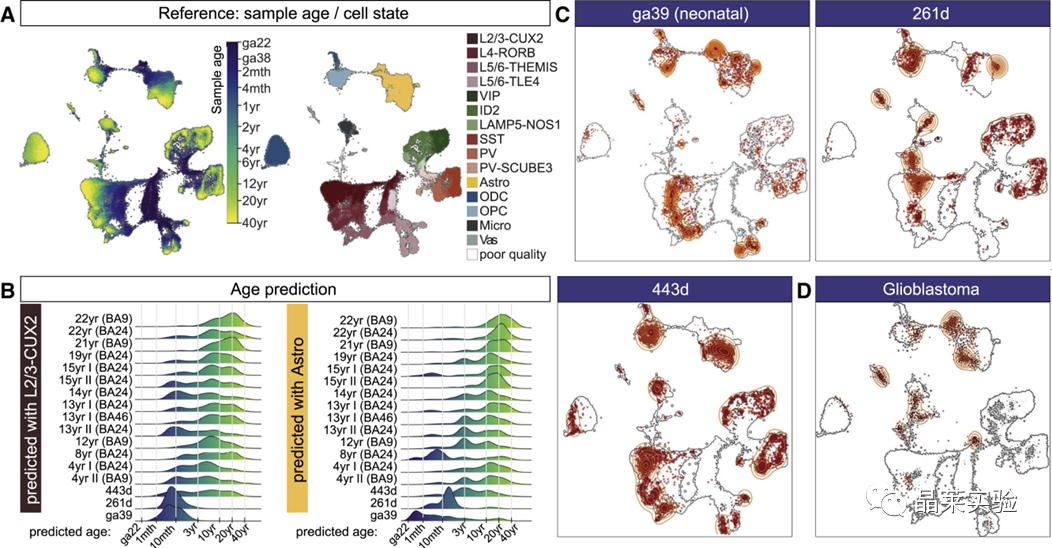
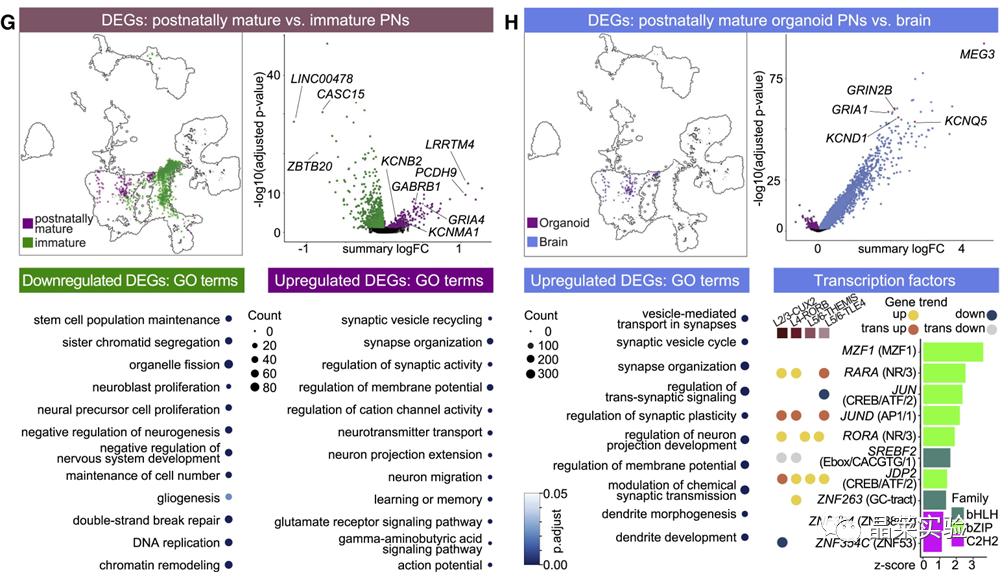
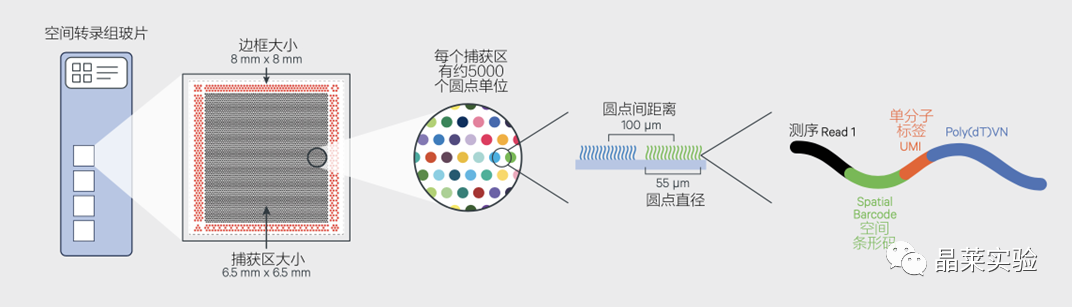
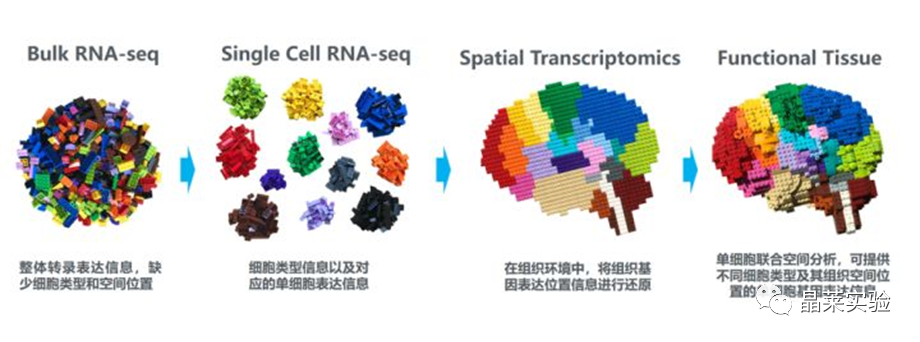
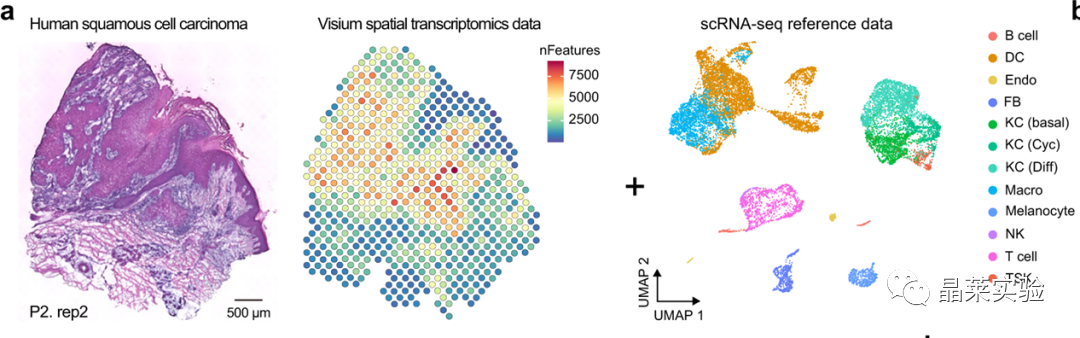
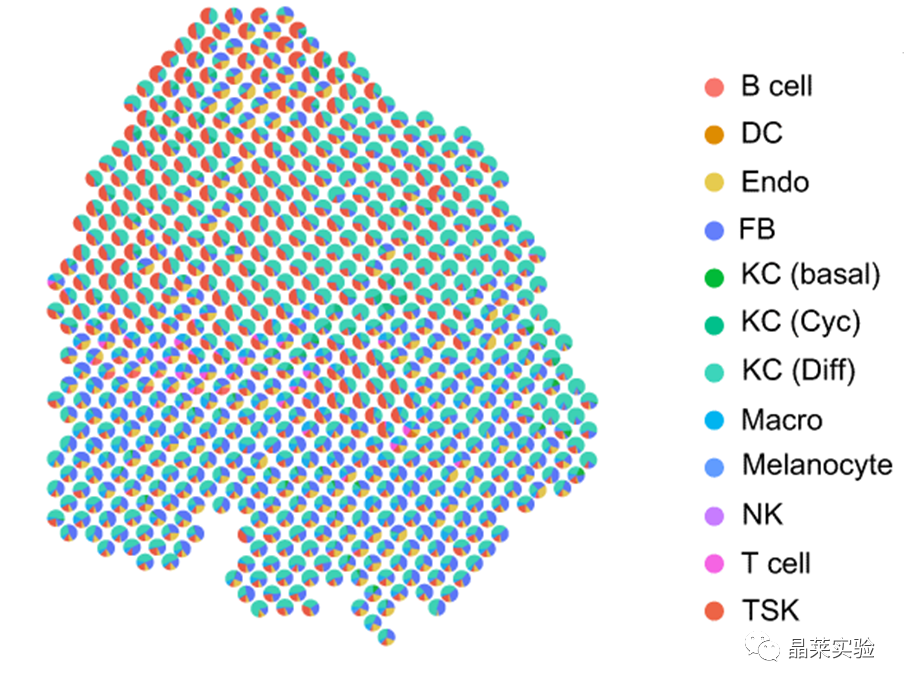
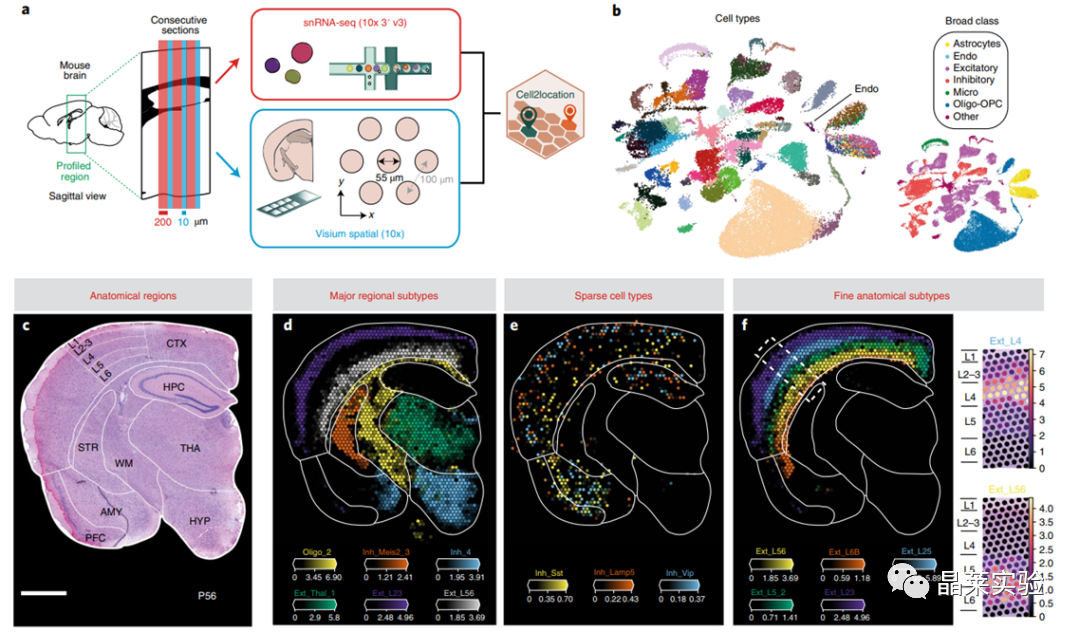
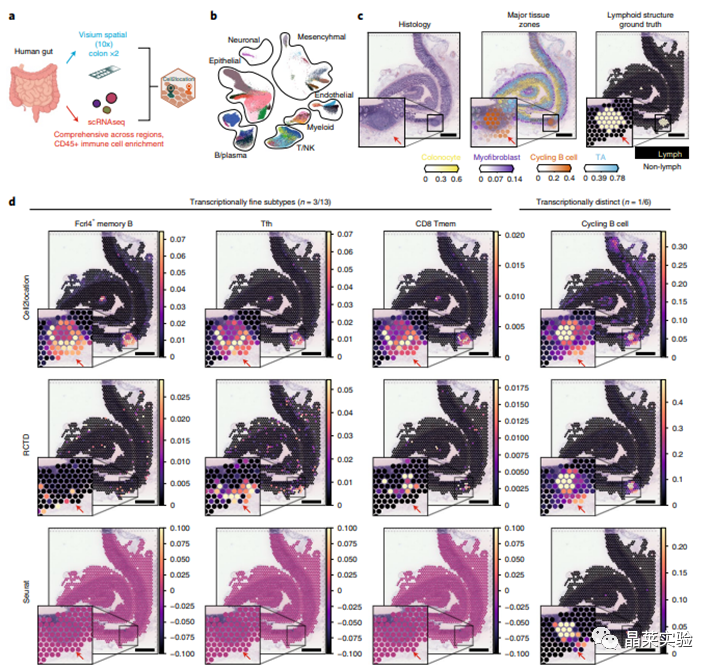
sc-RNA原理 Barcode是16个碱基的长度。一共有400万种Barcode,一个微珠是对应于一种Barcode,通过这400万种Barcode,可以把凝胶微珠给区分开。 UMI是一段随机序列,也就是说每一个DNA分子,都有自己的UMI序列。UMI的作用是为了区分哪些哪些reads是来自于一个原始cDNA分子,区分基因片段重复还是duplication及区分是真实的SNP位点还是PCR产生的突变。 基于10x genomics平台,利用微流控技术进行单个细胞分选,将带有条形码和引物的凝胶珠和单个细胞包裹在油滴中。 使用Illumina测序平台对文库进行测序检测,即可一次性获得大量单细胞的基因表达数据,10min内自动完成多至80,000个细胞的捕获,从而达到在单细胞水平进行表达测序的目的。 可用于单细胞多组学平行研究,同时分析单个细胞的基因组、转录组、表观基因组及蛋白组。 可用于单个细胞的功能状态研究,以无偏差的方式推断和发现新的细胞类型。 可用于构建细胞谱系的分化轨迹,创建细胞发育谱系的分子图谱。 研究背景 •人类前额叶皮质(PFC)直到成年后才完全成熟,这是一个非常漫长的过程。 •神经执行功能依赖于不同类型神经细胞的复杂空间、电和化学相互作用,这些神经细胞通过从子宫内到成年的协调过程成熟。 •出生后发育过程中突触发生、突触修剪、髓鞘形成和可塑性的基本过程导致了成熟大脑的功能复杂性和能力。 •然而,在大脑发育过程中,特别是在出生后,驱动细胞身份和功能变化的分子动力学仍然很大程度上是未知的。 技术路线 研究结果及分析 人类大脑发育的单核转录组谱 作者对26个死后PFC样本进行了单核转录组测序(snRNA-seq)分析,这些样本来自于胎儿、新生儿、婴儿期、儿童期、青春期和成人发育阶段的个体(图1A),生成了154,748个单核转录组谱,并对所有主要神经谱系进行了具有明确时间顺序的综合发育参考(图1B)。 在所有发育阶段确定了86个不同的簇,并进行了注释(图1C),揭示了出生后发育的系统性表达变化(图1B)和细胞类型丰度的时间变化(图1D)。 PFC发育过程中细胞类型特异性基因表达动态 作者将86个不同的亚群组织成细胞类型的轨迹,并将相关的细胞轨迹聚合为15种主要的细胞类型轨迹用于进一步分析(4种兴奋性主神经元PN,6种抑制性中间神经元IN,4种胶质细胞和1种脉管;图2A)。 分析差异表达基因(devDEG)趋势,揭示了从妊娠期到成年期复杂多样的表达动态,与不同的细胞类型和大脑发育和功能的关键过程相关(图2B)。 “神经元迁移”特征在妊娠晚期达到峰值,随后在出生时下降(图2C)。 总之,这些分析确定了从妊娠期到成年期所有细胞类型中与已知细胞和发育过程相关的不同表达动态。 中间神经元的产生和发育中的特化 人类PFC发育的染色质可及性图谱 为了研究控制PFC发育的表达动力学的顺式调控元件(CREs),作者对来自相同发育阶段的17个死后PFC样本(16个与snRNA-seq样本相匹配)进行了单核染色质可及性分析(snATAC-seq)(图1A)。分析发现87,339个单个细胞核通过snRNA-seq标签聚集成12个主要的细胞状态(图4A)。 UMAP显示了神经元细胞类型的时间顺序,代表了发育过程中调节程序的进展(图4A),以及与年龄相关的细胞类型比例变化(图4B)。 细胞类型和动力学解析的脑相关疾病关联及其调控驱动因素 许多神经和精神疾病的症状在不同的年龄出现或恶化,表明动态调节的细胞过程参与了发育。 为了测试细胞类型和发育动力学对疾病的贡献,本研究进一步使用图谱来探索发育疾病基因的关联。 在分析的23种疾病中,除三种血液疾病作为阴性对照外,所有疾病都显示与细胞类型特异性基因表达趋势相关,在出生后期通常发生的多种疾病(痴呆、轻度认知障碍、健忘症和亨廷顿病)主要是由于PN和IN亚型在出生后发育过程中短暂上调的基因而富集(图5A)。 TF可能通过调节疾病相关基因在介导这些疾病的暂时性发病中发挥重要作用。对于显著的疾病相关性,作者在相关基因趋势的已知疾病基因相关的CREs中通过motif富集分析预测了调控发育表达变化的TF,揭示了AP1/1和CREB/AFT/1 TF motif家族(包括FOS和JUN)在许多脑部疾病中的潜在作用(图5B)。 双极性相关基因MCTP1在L5/6 PNs中出生后上调,具有内含子链接的CRE,从婴儿期开始可访问,并包含FOS/JUND-binding motif(图5C)。 证明了PFC发育图谱能深入了解大脑疾病的调节驱动和关联细胞类型。 健康、疾病和器官成熟模型中细胞发育分析的参考 作者为稳定地将额外的snRNA-seq数据集集成到分析参考中,整合了(孤独症谱系障碍,自闭症,ASD)中PFC的snRNA-seq表征的神经典型对照样本,正确预测原始细胞类型分配(图6A)。 对于4-22岁(Velmeshev et al. 2019)的样本,使用预测的星形胶质细胞核年龄正确地估计了它们的发育阶段(图6B)。 而使用L2/3 PNs预测ga39样本是新生儿(图6B、C)。 作者还通过整合成人胶质母细胞瘤snRNA-seq数据集,确定间充质、神经元、星形细胞样和ODC样人群,探索了预测细胞类型和发育年龄的疾病状态背景(图6D)。 通过对生成培养5、9或12个月的大脑类器官snRNA-seq分析(图6E、F),在体外皮质发育模型中确定细胞状态的分布及其发育年龄。 这些类器官包含预期的主要细胞类型(星形胶质细胞、OPCs、PNs和INs;图6F)。 对于中枢神经网络,类器官神经元映射到大多数皮质层,对于INs、CGE和MGE亚群都映射到皮质层(图6F、G)。 利用基于PNs和TF基序结合位点的预估CREs的方法,并对TF进行了排序。 许多高排序的TF(n=31)与正常大脑发育中上调的devDEGs相对应,表明类器官缺乏实现PN成熟的突触网络(图6H)。 文献总结 实验亮点: 使用单细胞技术综合分析定义了每一种细胞类型的动态轨迹,揭示了所有细胞类型在产前到出生后过渡的主要基因表达重组,随后持续重组到成年,并确定了指导细胞发育程序、状态和功能的调节网络。系统研究了表征基因表达和染色质动态,贯穿了从产前到出生后的人类大脑发展。 临床意义: 本研究使得在发育过程中能够描述不同皮层细胞类型中的活性通路及其动态,细胞类型特异性成熟时间,并预测控制顺式调控逻辑和相关因素,为神经细胞发育过程的分子解剖奠定基础。 ST-seq原理及应用 •空间转录组可以提供我们基因表达的“组织空间位置“信息。这就弥补了单细胞转录组的最大缺点。 •空间转录组实验只需要提供“组织切片“,但是单细胞转录组需要制备”原生质体“,而原生质体的获得并不是那么简单的。原生质体的获取也成为植物单细胞技术的应用的最大挑战了。 •可以把空间转录组得到的空间位置信息作为细胞类群判定的一种注释信息,结合组织解剖学等先验知识,就可以更快更好地判断出细胞所属类群。 描绘小鼠脑细胞类型 作者首先将该模型应用于来自小鼠大脑的数据,其特征是不同类型的神经细胞在大脑区域之间组织成具有良好特征的空间结构,从而是测试空间基因组学的典型用例。作者从端脑和间脑多个区域的相邻小鼠脑切片中生成了匹配的单核(sn)和空间RNA-seq图谱。 为了评估空间图谱中的生物学和器官内技术差异,作者分析了两个小鼠大脑的连续组织切片(两个来自两个动物的匹配切片,以及一个额外的snRNA-seq切片),创建了一个丰富的转录数据集。 在这些细胞中,44个簇被识别为大脑中预期的细胞类型,包括星形胶质细胞、兴奋性或抑制性神经元或胶质细胞亚型。作者应用cell2location将这些细胞类型绘制到小鼠大脑的空间位置。 由此得到的细胞类型图谱与先前文献中预期的解剖位置明显一致。并且,作者的结果捕捉到了不同的细胞类型,分辨了广泛的区域性细胞类型,如丘脑的兴奋性神经元、白质的少突胶质细胞,皮质中间神经元等罕见亚型以及次区域亚型,如跨皮层的兴奋性神经元。 在相邻的组织切片和复制动物之间,细胞类型丰度的估计高度一致。接下来,为了评估Cell2Location方法与其他方法的特异性,作者绘制了一个现有的大型scRAN-seq数据集,其中包括来自多个脑区的细胞类型。 绘制精细免疫细胞 文献结论 关注公众号,了解更多! 文献链接:Human prefrontal cortex gene regulatory dynamics from gestation to adulthood at single-cell resolution - ScienceDirect