
RNA-binding protein hnRNP UL1 binds κB sites to attenuate NF-κB-mediated inflammation
RNA结合蛋白hnRNP UL1结合κB位点以减弱NF-κB介导的炎症

文献背景
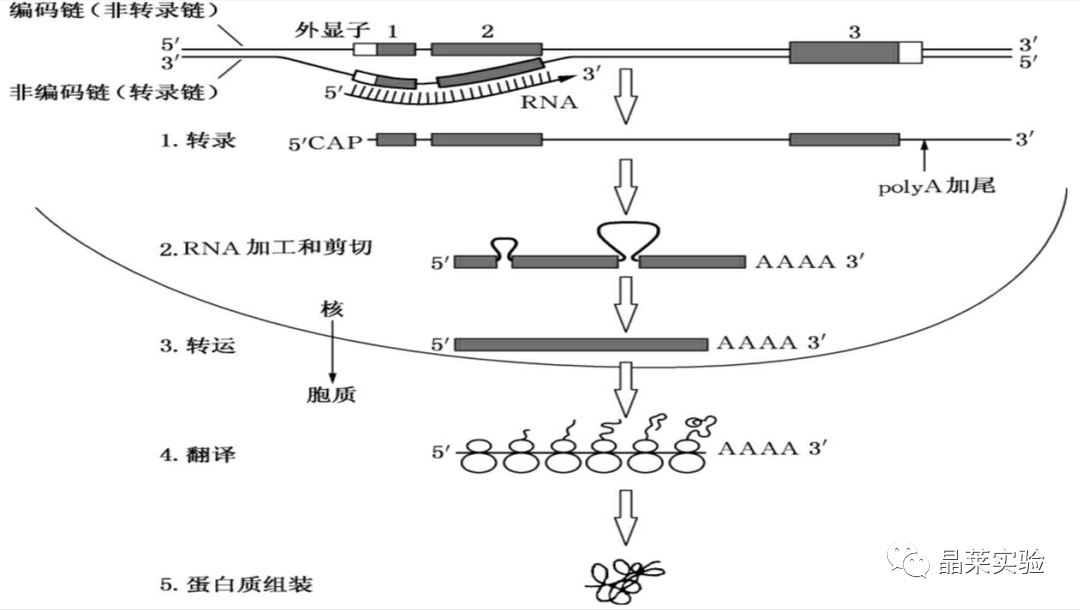
异质核RNA(hnRNP):是真核生物中 RNA 聚合酶 II 的主要转录物,新生成熟的hnRNPs在转录过程中不加选择地与多种蛋白质结合形成复合物,与靶基因或其他蛋白质相互作用。
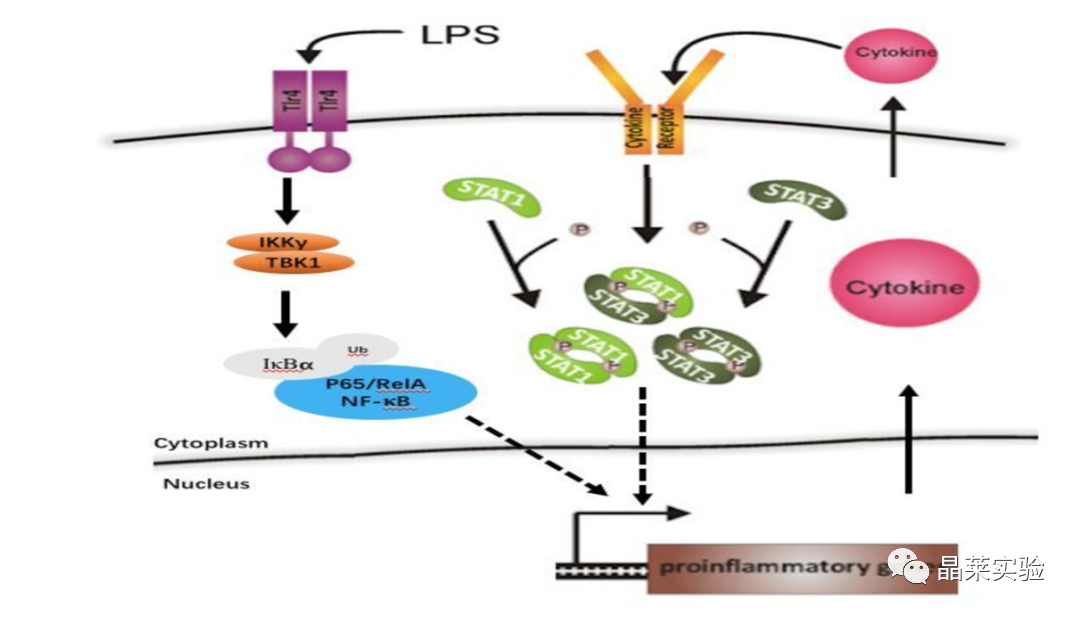
NF-κB(核因子-κB)信号通路:NF-κB信号通路是由细胞外的刺激引起的,比如LPS(脂多糖)。细胞外信号因子与细胞膜上的受体结合,受体蛋白接受刺激后先活化IKK,使得IκB亚基被泛素化修饰,从而释放NF-κB二聚体。自由的NF-κB会进入细胞核,与有NF-κB结合位点的基因结合,启动转录进程。
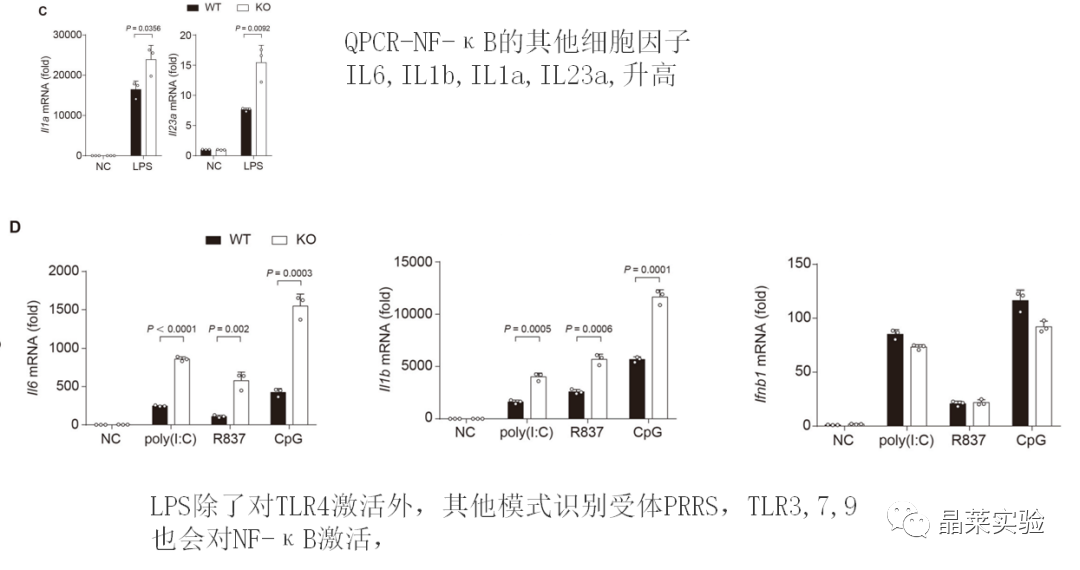
已知的NF-κB通路激活因子有很多,包括:TNF-α、IL-1β、IL-2、IL-6、IL-8、IL-12等。

类风湿性关节炎
类风湿性关节炎是一种常见的以关节组织的慢性炎症性病变为主要表现的全身性自身免疫性疾病。适当的炎症可以消除炎症刺激,修复受损组织,平衡防御和稳态,但是不解决便会形成慢性炎症、癌症或者自身免疫性疾病。
研究思路

研究结果及分析
1. 体外细胞实验
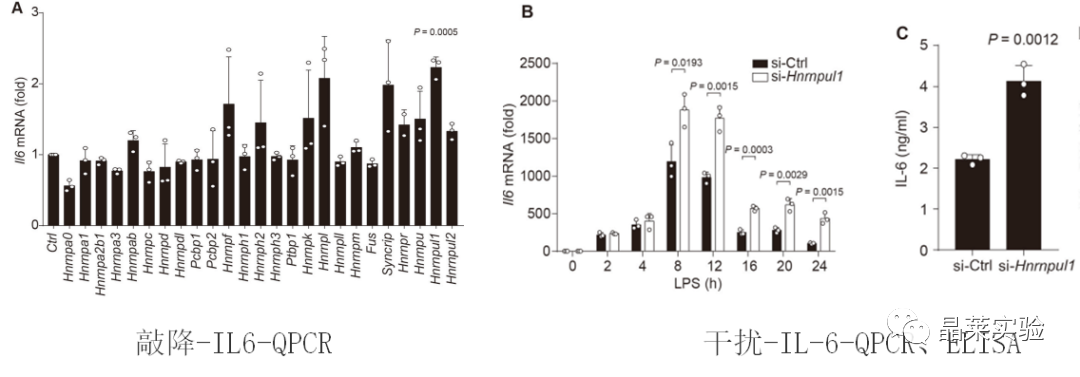
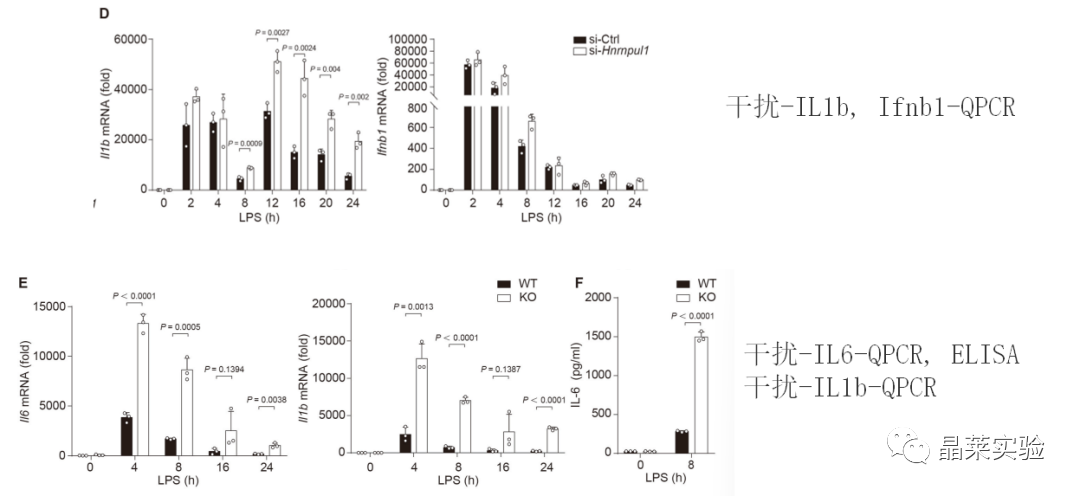
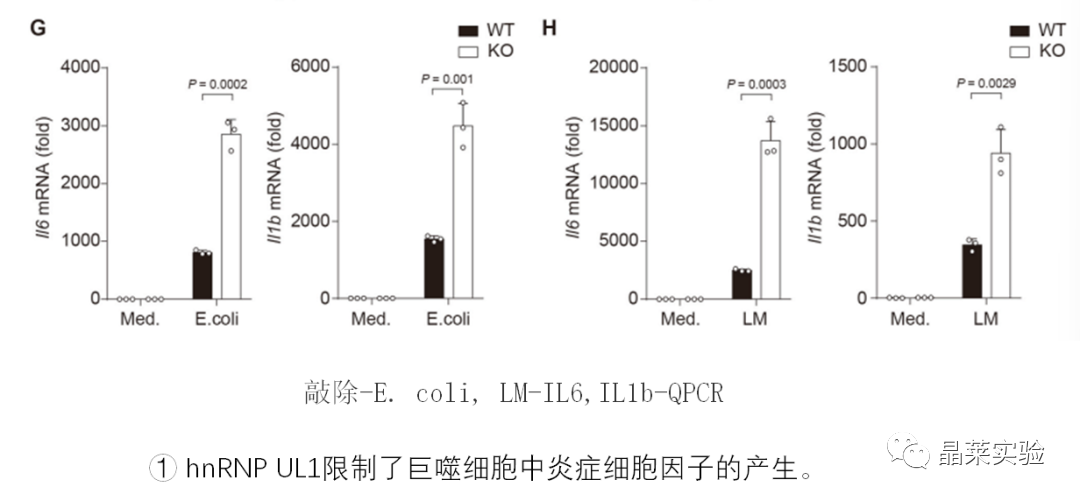
2. 体内实验
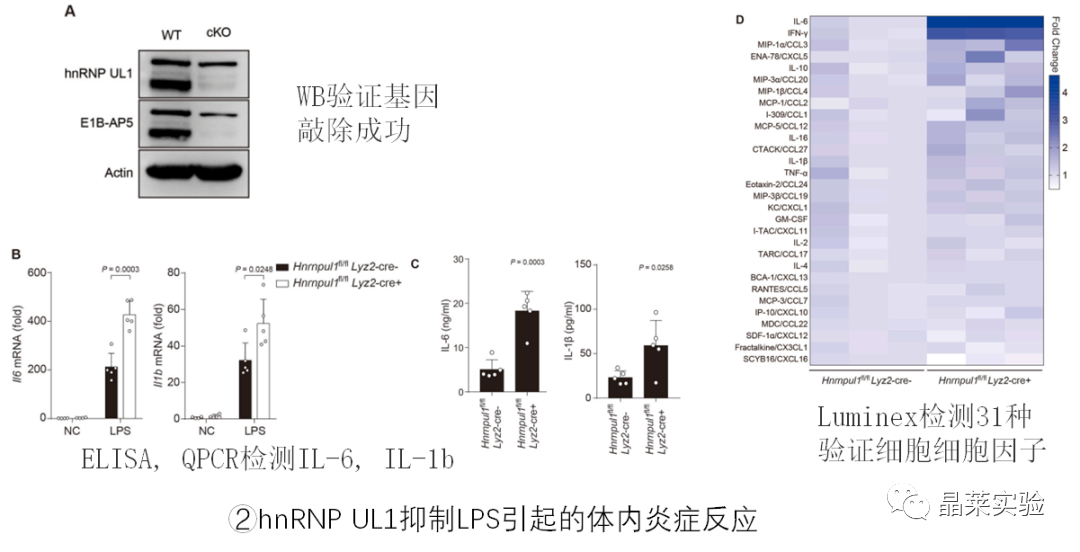
3.临床样本
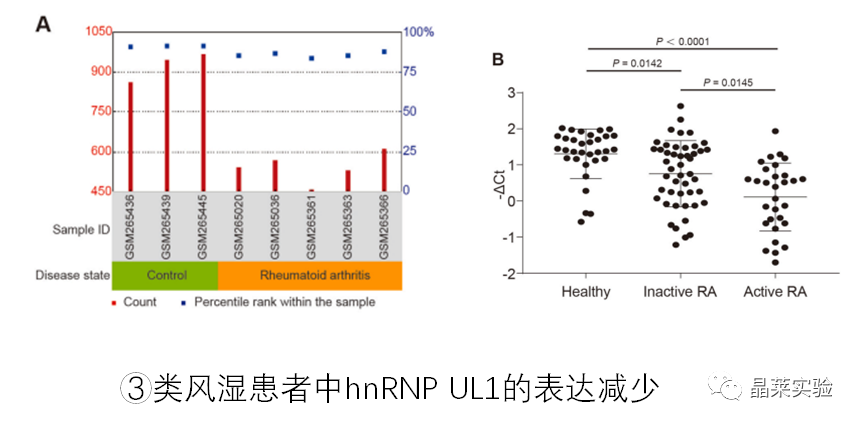
外源数据分析,类风湿关节炎患者关节液中的巨噬细胞比正常人群血液中巨噬细胞数量少。
临床采集样本:QPCR检测类风湿关节炎患者与正常人群血清hnRNP UL1 mRNA, 类风湿中低,活动性类风湿关节炎患者低于非活动性类风湿关节炎。
4. hnRNP UL1抑制了促炎症细胞因子的产生,通过中断NF-κB传导抑制促炎症细胞因子的产生
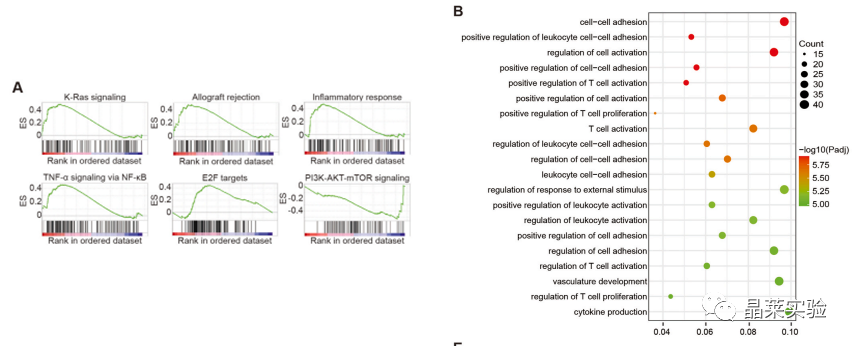
敲降-LPS10h-两组细胞基因组富集分析;
差异基因的GO分析,显示了前20个显著丰富的生物过程,这些数据让我们注意到NF-κB,炎症调节的基石。
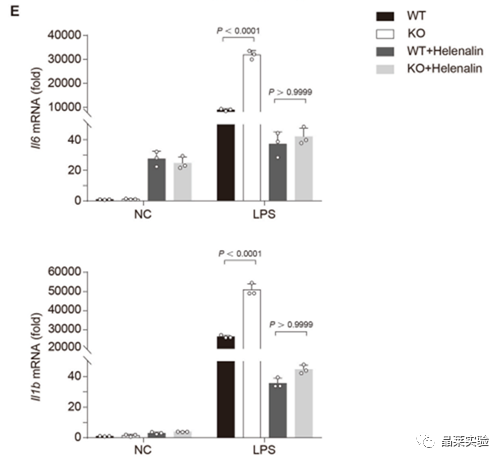
海拉宁抑制NF-κB的激活,抑制促炎症细胞因子的产生。
LPS通过NF-κB通路引起炎症反应
5. hnRNP UL1通过转录干预制约NF-κB介导的炎症
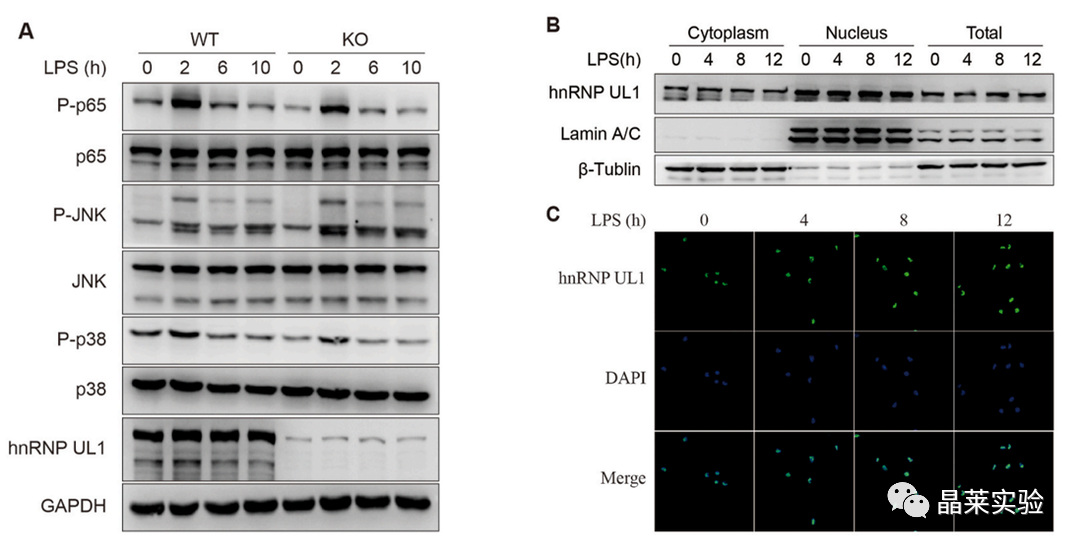
hnRNP UL1对LPS刺激后的细胞质信号传导没有影响。没有明显的核细胞质穿梭现象。
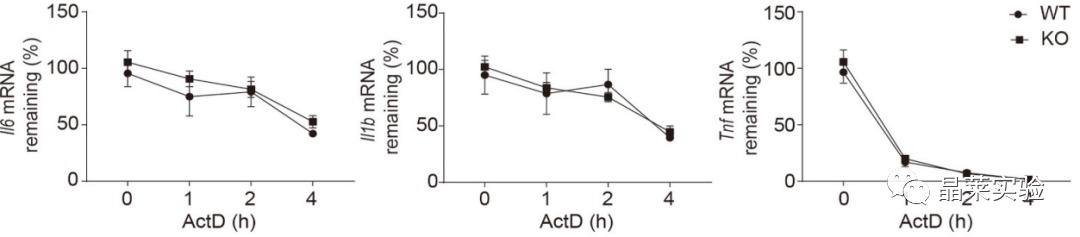
炎症细胞因子IL-6, IL-1β和TNF-α的mRNA半衰期,不受缺乏hnRNP UL1的影响。
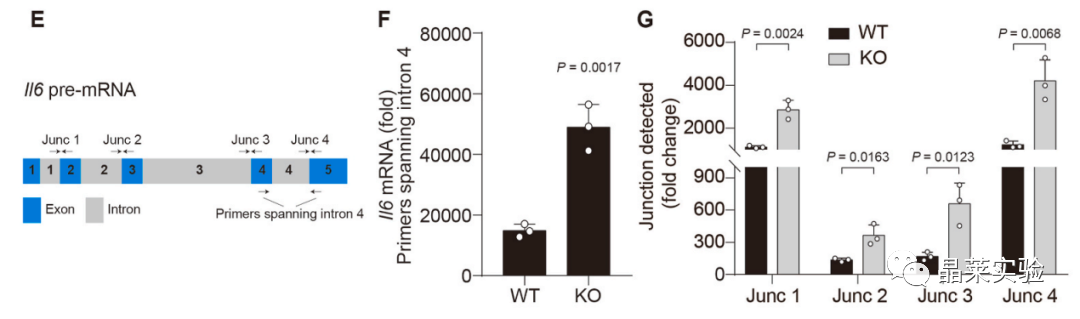
以IL6的前mRNA为例,对靶向Il6外显子和内含子的不同连接点进行RT-qPCR分析,显示出与检测到的成熟Il6 mRNA相似的趋势,表明没有对外显子、内含子异常剪接。
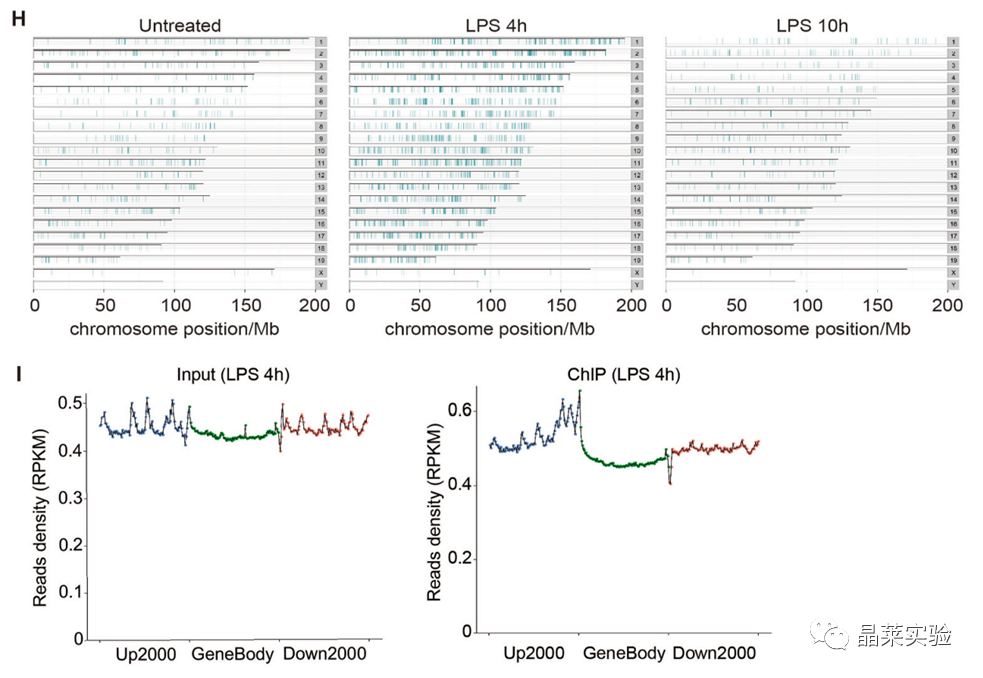
采用ChIP-seq分析来检查hnRNP UL1在整个炎症反应过程中与染色体广泛和动态结合。
从读数密度分布来看,与hnRNP UL1相互作用的是基因的启动子。
6. hnRNP UL1与NF-κB竞争结合κB位点以抑制NFκB介导的炎症
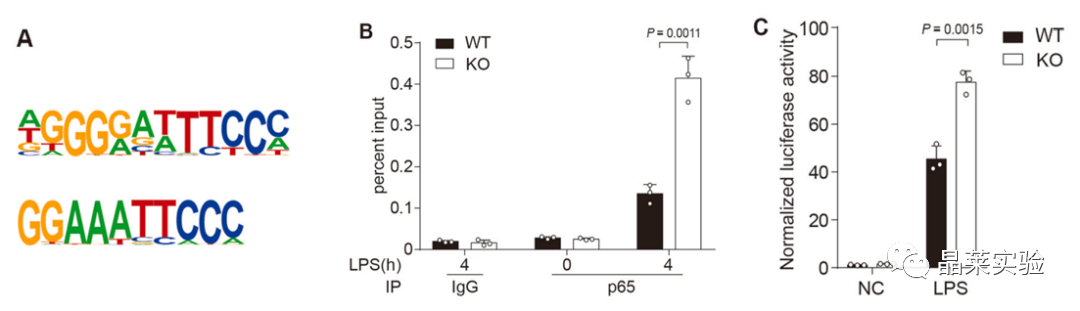
在与hnRNP UL1相互作用的DNA图案中,NF-κB结合位点 (κB位点)被明显富集,暗示了hnRNPUL1通过与NF-κB竞争κB位点来负向调节NF-κB介导的炎症。在hnRNP UL1敲除后,P65蛋白与κB位点的结合有差异。
构建了带有荧光素酶的κB位点的质粒,在敲除细胞里NF-κB被招募到κB位点。
那么, HnRNP UL1是否与NF-κB竞争,直接结合κB位点?
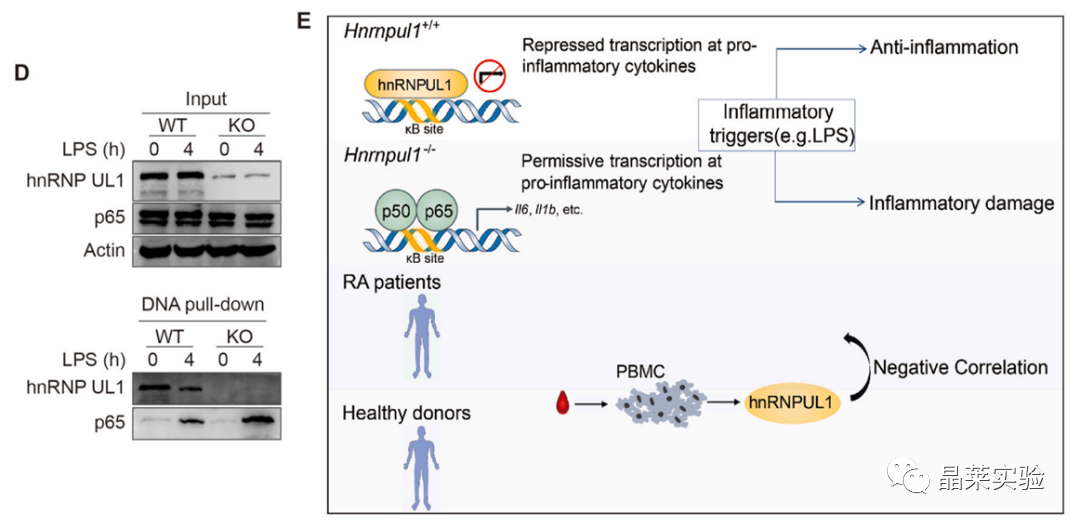
用带有κB位点的生物素化的DNA探针来拉下NF-κB以及hnRNP UL1, 发现hnRNP UL1直接结合到κB位点,并与NF-κB竞争结合κB位点。
发现hnRNP UL1直接结合到κB位点,并与NF-κB竞争结合κB位点。
文献结论
hnRNP UL1确定为一种新的负调节器的NF-κB途径。潜在的机制是hnRNPUL1与NF-κB竞争结合κB位点以抑制NF-κB介导的炎症。
此外,提供了证据证明降低HNRNPUL1表达和RA发病机制。
文献使用的实验技术
关注公众号,了解更多!
