Mesenchymal Stromal Cells Directly Promote Inflammation by Canonical NLRP3 and Non-canonical Caspase-11 Inflammasomes
间充质基质细胞通过典型NLRP3 和非典型Caspase-11炎症小体直接促进炎症
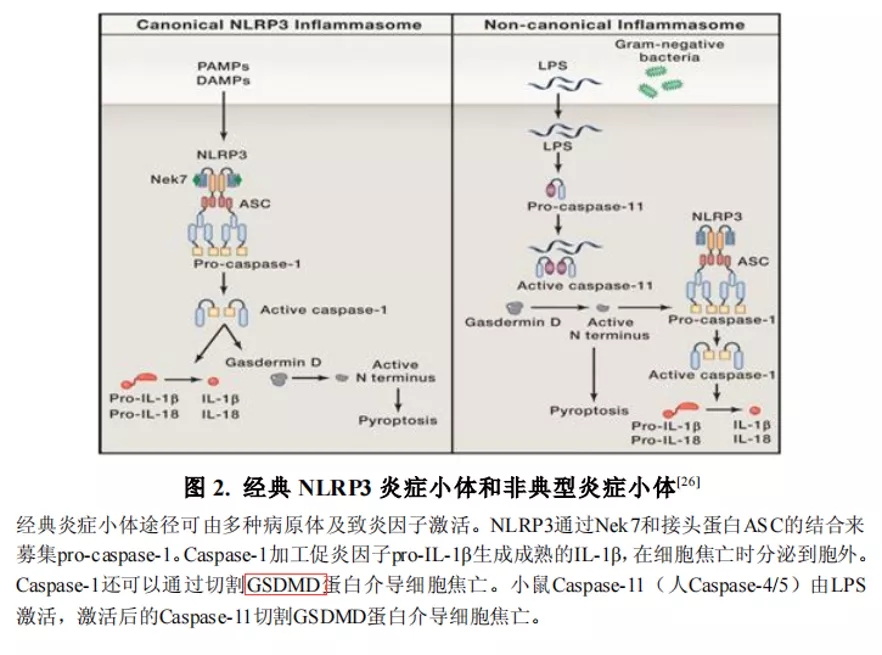
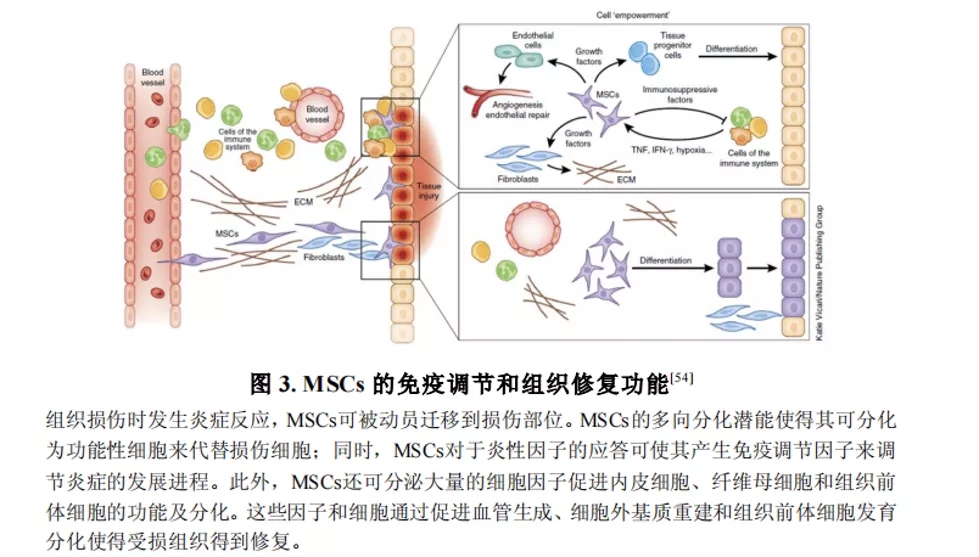
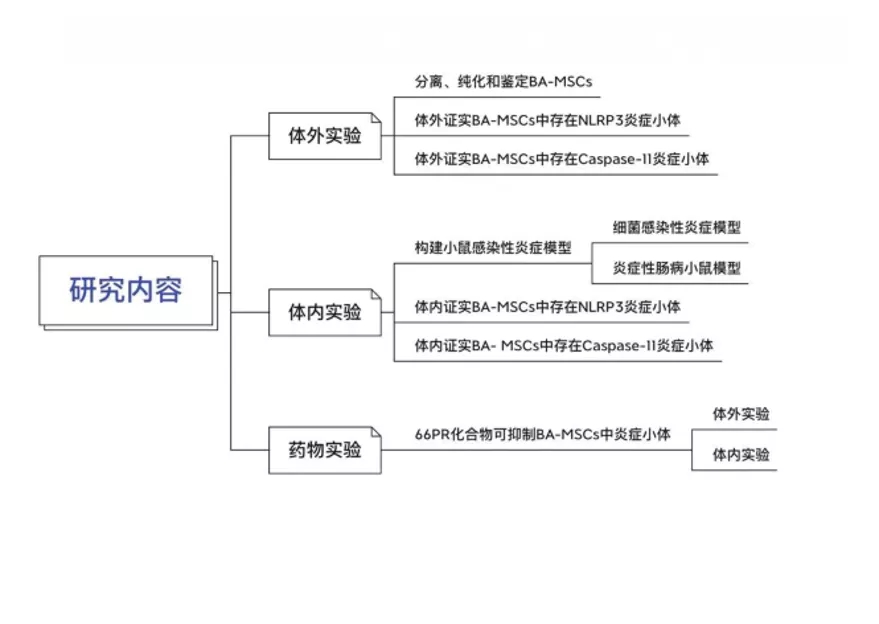
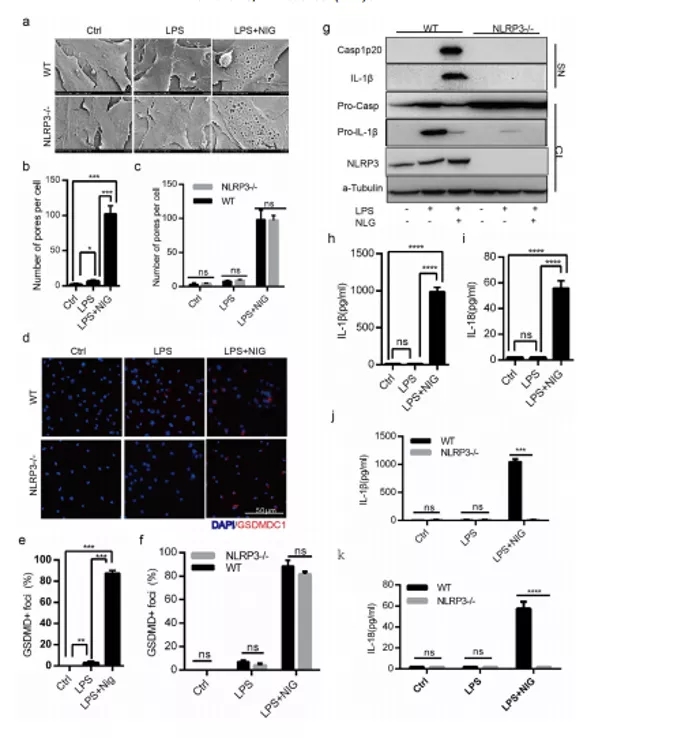
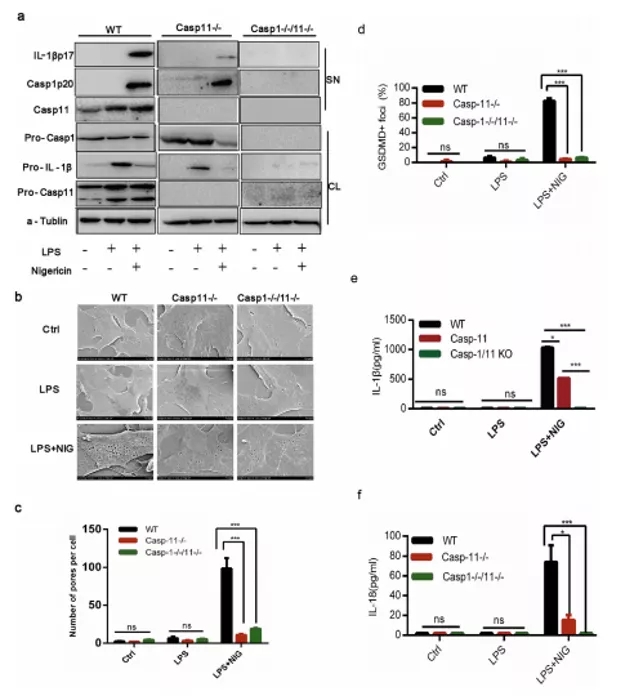
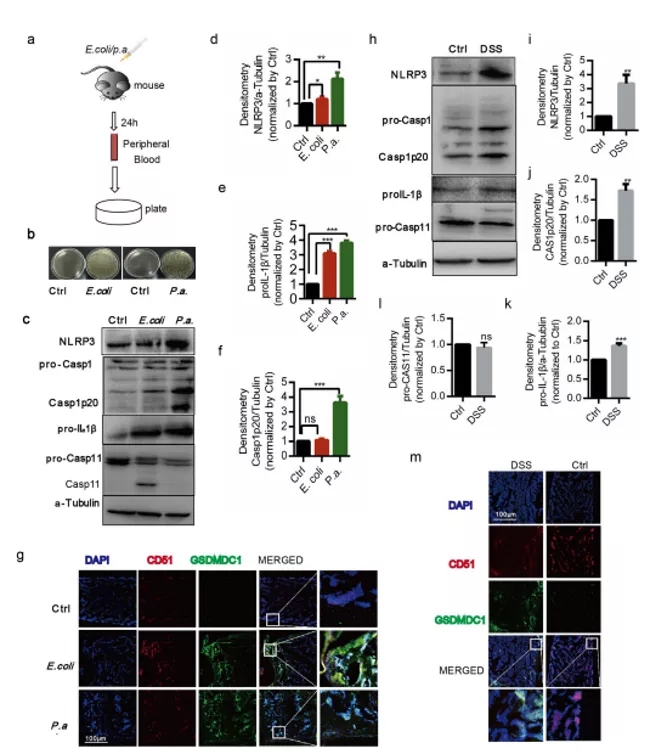
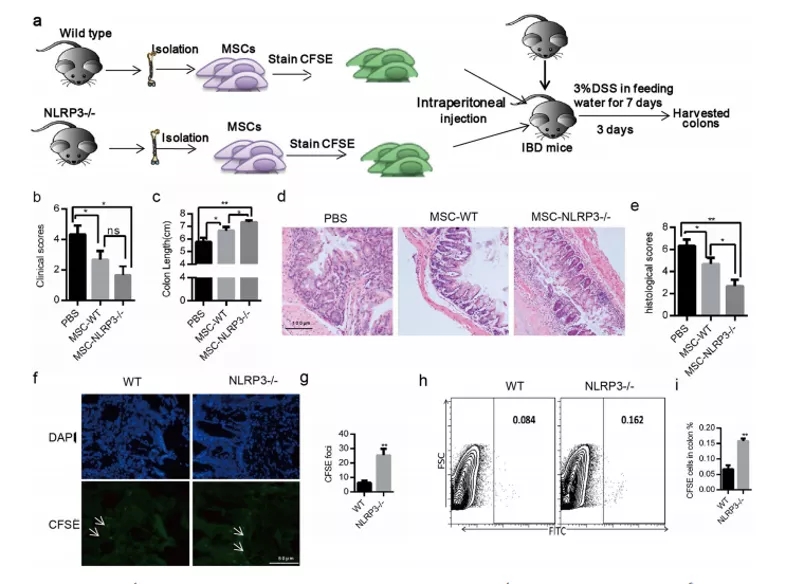
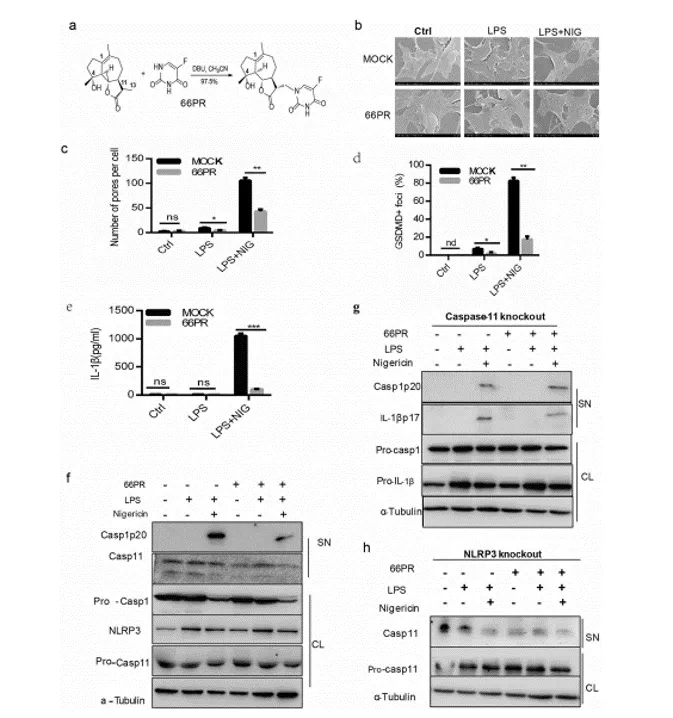
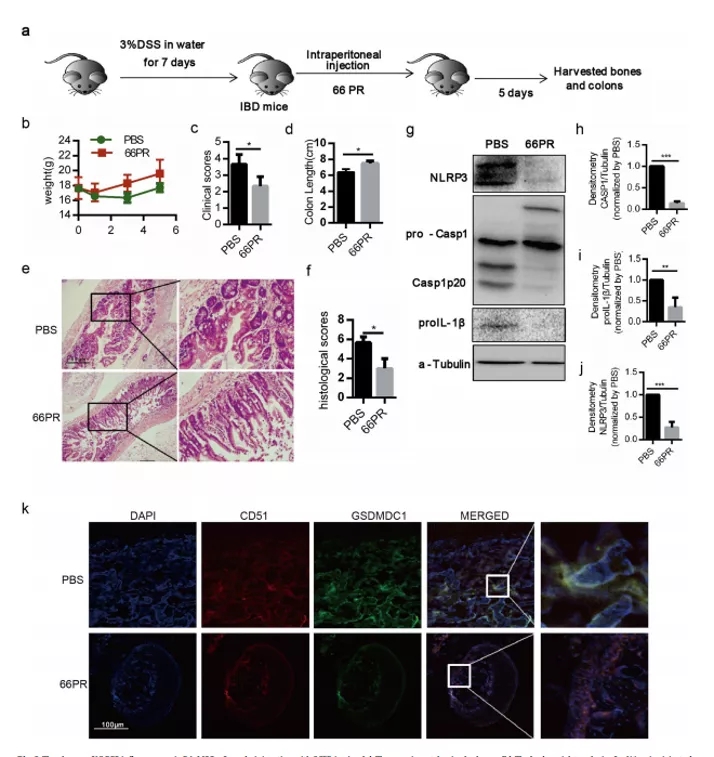
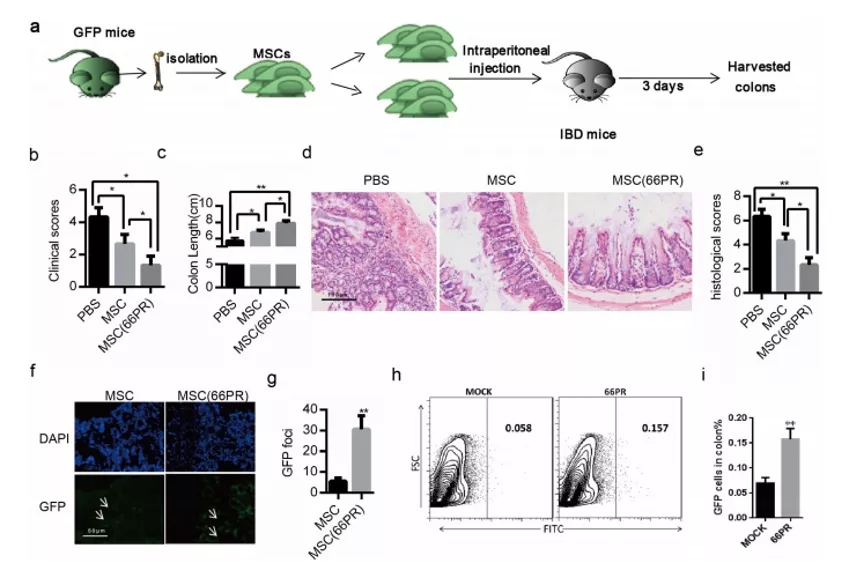
期刊:EBioMedicine 影响因子:6.183 发表日期:2018年5月18日 研究背景 炎症是机体对于内部或者外部刺激的一种综合性防御反应,虽然炎症是机体的防御性应答机制,但是过强或持续性的炎症反应会使机体免疫应答发生异常,导致非特异性组织损伤,引起一系列的病理反应,如败血症、过敏反应、动脉粥样硬化、结肠炎甚至癌症等。 炎症小体是一组细胞内蛋白复合物,是炎症反应的重要参与者,它通过分泌促炎因子,诱导细胞焦亡,发挥炎症免疫应答功能。炎症小体有两条不同的活化通路,即经典炎症小体通路和非经典炎症小体通路;NLRP3 炎症小体是研究较多的炎症小体之一,NLRP3炎症小体包含NLRP3、凋亡斑点蛋白(ASC)和pro-Caspase-1;它的激活促进了 IL-1β 和 IL-18 的成熟与分泌,诱导细胞焦亡,导致细胞内容物的释放,调控炎症反应。Caspase-11 炎症小体属于非经典的炎性小体,可识别胞内 LPS,不受 ASC调节,可自身诱导细胞焦亡,但诱导 IL-1β 和 IL-18 的成熟需要借助于 NLRP3 炎症小体。 基于间充质基质细胞(MSCs)的治疗炎症性疾病是一种很有前途的治疗方法。因此,非常有必要探讨间充质基质细胞(MSCs)对炎症刺激的反应机制,从而阐明炎症反应的作用机制。 技术路线 研究内容 1、Nigericin和LPS激活BA-MSCs体外的NLRP3炎症小体 1.1分组 细胞分组1(n=3) ①对照组:正常大鼠来源BA-MSCs细胞,未做任何处理 ②LPS组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h ③LPS+NIG组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h,5mM Nigericin 刺激 BA-MSCs 1.5h 细胞分组2(n=3) ①对照组:NLRP3 基因敲除小鼠来源BA-MSCs细胞,未做任何处理 ②LPS组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h ③LPS+NIG组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h,5mM Nigericin 刺激 BA-MSCs 1.5h 1.2 检测内容 ①透射电镜 ②免疫荧光共定位:DAPI和GSDMD ③WB检测:NLRP3/pro-IL-1β/pro-caspase-1等指标 ④ELISA检测:IL-1β 和 IL-18 数据表明:LPS和nigericin诱导BA-MSCs中NLRP3炎症小体的活化,IL-1β/18的释放依赖于NLRP3,而pyrptosisis独立于NLRP3。 2、Caspase-11炎症小体也在BA-MSCs中被Nigericin和LPS激活 2.1细胞分组 细胞分组1(n=3) ①对照组:正常大鼠来源BA-MSCs细胞,未做任何处理 ②LPS组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h ③LPS+NIG组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h,5mM Nigericin 刺激 BA-MSCs 1.5h 细胞分组2(n=3) ①对照组:Caspase-11 基因敲除小鼠来源BA-MSCs细胞,未做任何处理 ②LPS组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h ③LPS+NIG组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h,5mM Nigericin 刺激 BA-MSCs 1.5h 细胞分组3(n=3) ①对照组:Caspase-1/11 基因敲除小鼠来源BA-MSCs细胞,未做任何处理 ②LPS组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h ③LPS+NIG组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h,5mM Nigericin 刺激 BA-MSCs 1.5h 2.2 检测内容 ①透射电镜 ②免疫荧光共定位:DAPI和GSDMD ③WB检测:Caspase11/pro-IL-1β/pro-caspase-1等指标 ④ELISA检测:IL-1β 和 IL-18 数据表明:用LPS和nigericin刺激也可以激活BA-MSCs中的capase-11炎症小体,从而诱导焦变并促进IL-1β / 18的分泌。此外,BA-MSCs中炎症小体的激活依赖于半胱天冬酶-1/11基因和半胱天冬酶-1基因对IL-1β/18释放的控制。 3、BA-MSCs的NLRP3和Caspase-11炎症小体在体内被激活 3.1动物分组 动物分组1(n=10) ①对照组:正常小鼠,来源BA-MSCs细胞,未做任何处理 ②大肠杆菌( E.coli)组:模型构建成功后,分离 BA-MSCs ③铜绿假单胞菌(P.a)组:模型构建成功后,分离 BA-MSCs 动物分组2(n=10) ①对照组:正常小鼠,来源BA-MSCs细胞,未做任何处理 ②硫酸葡萄糖组:模型构建成功后,分离 BA-MSCs 3.2 检测内容 ①WB检测:NLRP3/Caspase11/pro-IL-1β/pro-caspase-1等指标 ②免疫荧光共定位:DAPI/CD51/GSDMD 数据表明:规范NLRP3炎症小体被激活以参与IBD小鼠BA-MSCs的炎症反应,而非规范半胱天冬酶-11炎症小体可能不参与。 4、抑制 BA-MSCs 中 NLRP3 炎症小体可提高其治疗 IBD 的疗效 4.1动物分组 动物分组1(n=10) ①PBS组:注射 PBS 的 IBD 小鼠 ②MSC-WT组:模型构建成功后,注射野生小鼠来源的 BA-MSCs ③MSCs-NLRP3-/-组:注 射 NLRP3 基因敲除小鼠来源的 BA-MSCs 4.2 检测内容 ①临床评分、结肠长度 ②HE染色 ③荧光显微镜显示 ④流式细胞仪检测分析 结果表明:即当对自身组织损伤炎症作出反应时,只有NLRP3炎症小体在BA-MSCs中被激活,这意味着NLRP3基因缺乏通过抑制结肠炎动物的焦变来增强BA-MSC存活率。 5、一种合成产物(66PR)抑制了骨相关间充质基质细胞中炎症小体的激活 5.1细胞分组 细胞分组1(n=3) ①对照组:正常大鼠来源BA-MSCs细胞,未加 66PR 处理组 ②LPS组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h未加 66PR 处理组 ③LPS+NIG组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h,5mM Nigericin 刺激 BA-MSCs 1.5h;未加 66PR 处理组 ④对照组:Caspase-11 基因敲除小鼠来源BA-MSCs细胞,加入 66PR 处理 ⑤LPS组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h;加入 66PR 处理 ⑥LPS+NIG组:加入 500ng/ml LPS 预处理 BA-MSCs 细胞 4h,5mM Nigericin 刺激 BA-MSCs 1.5h;加入 66PR 处理 5.2 检测内容 ①透射电镜 ②激光共聚焦分析:GSDMD ③WB检测:Caspase11/pro-IL-1β/NLRP3等指标 ④ELISA检测:IL-1β 5.3动物分组 动物分组1(n=10) ①PBS组:注射 PBS 的 IBD 小鼠 ②66PR组:模型构建成功后,腹腔注射66PR 5.4检测内容 ①体重、临床评分、结肠长度 ②HE染色 ③免疫荧光共定位 ④WB检测:Caspase1p20/pro-IL-1β/NLRP3等指标 5.5动物分组 动物分组1(n=10) ①PBS组:经腹腔给 IBD 模型小鼠注射 PBS ②MSC组:模型构建成功后,腹腔注射正常BA-MSCs ③66PR组:模型构建成功后,腹腔注射经 66PR 处理的 BA-MSCs 5.6检测内容 ①体重、临床评分、结肠长度 ②HE染色 ③免疫荧光共定位 ④流式细胞仪检测分析 结果表明:66PR可以通过在自身组织损伤炎症环境中抑制焦变来改善BA-MSCs的存活率。 总结与思考 一、体外证实 BA-MSCs 中存在 NLRP3 和 Caspase-11 炎症小体 通过 LPS/Nigercin 刺激野生小鼠来源的 BA-MSCs、NLRP3 基因敲除小鼠和 Caspase-11 基因敲除小鼠和 Caspase-1/11 基因敲除小鼠来源的 BA-MSCs,从炎症小体相关蛋白的表达、细胞因子的分泌、焦亡的发生等方面证实了 BA-MSC 中存在NLRP3 炎症小体和 Caspase-11 炎症小体。 二、体内证实 BA-MSCs 中存在 NLRP3 和 Caspase-11 炎症小体 采用大肠杆菌和铜绿假单胞菌建立小鼠感染性炎症模型,通过炎症小体相关的表达和焦亡的发生,确认感染性炎症刺激,可激活 BA-MSCs 中 NLRP3 炎症小体和 Caspase-11 炎症小体。利用 DSS 建立了 IBD 模型小鼠,发现 IBD 可激活 MSCs中 NLRP3 炎症小体,不能激活 Caspase-11 炎症小体。 三、新型小分子化合物 66PR 可抑制 BA-MSCs 中炎症小体 为了调控 BA-MSCs 中炎症小体的活性,寻找 BA-MSCs 中炎症小体的抑制剂。通过体内外研究证实小分子化合物 66PR 可抑制 BA-MSCs 中炎症小体的激活。将 66PR 处理的 BA-MSCs 移植到 IBD 小鼠,可提高其治疗炎症性疾病的效果。 四、 骨相关 MSCs 的表面标记 本研究采用的 BA-MSCs 来源于小鼠长骨,经流式细胞仪分析发现 CD44、CD51、CD90、 CD105、 CD146、 CD166 和 Sca1 表面标记均呈阳性,因此骨BA-MSCs 具有间充质基质细胞的通用标记;免疫细胞常见的表面分子标记 CD11c、CD11b、F4/80、Gr1、CD14、CD3 和 CD19 均呈阴性,说明 BA-MSCs中包含的免疫细胞数量极低;这些对我们提取和鉴定此类细胞具有重要的参考价值。 五、创新性 本研究确定BA-MSCs通过炎症小体信号转导直接参与炎症反应,并补充了非免疫细胞中炎症小体激活的知识。这些发现提醒我们,维持适当的炎症平衡不仅应该包括靶向免疫细胞,还应该包括靶向非免疫细胞。扩展了我们对BA-MSCs的微妙功能的理解,除了造血或组织修复,这对BAMSCs在临床环境中的使用很重要。 本研究采用新型小分子化合物 66PR 对 BA-MSCs 的促炎特性进行抑制,以提高 BA-MSCs在 IBD 治疗中的治疗效果;该发现具有较高的市场价值。 文中涉及的实验技术 以上文献涉及的实验技术,均可在晶莱生物展开。 【晶莱生物】是一家专注于生物医学领域内科研学术服务的高新技术企业,致力于打造国内一流的生物技术服务品牌。为生物医学研究者提供动物造模、细胞生物学、基因组学、蛋白鉴定及分析、病理组化、表观遗传学等多个实验平台服务。