

期刊名: Oncogene;
2021年影响因子/JCR分区:9.867/Q1
研究背景
1、多形性胶质母细胞瘤(GBM)是胶质瘤的最高级别,是最恶性的脑肿瘤;即使在目前的标准化放疗和肿瘤切除方案后,其预后也仅为12-15个月。目前,我们对驱动GBM发病机制的确切机制的理解仍然有限,进一步的研究对于设计更有效的疗法至关重要。GBM是高度血管化的肿瘤,其特征是血管过度增殖能力和大量髓系浸润。
2、在GBM发育过程中,巨噬细胞的激活强烈促进肿瘤血管生成。在此之前,我们发现细胞外腺苷脱氨酶蛋白猫眼综合征临界区蛋白1(CECR1)在GBM中由M2巨噬细胞高度表达,在GBM中它定义巨噬细胞M2极化,已被证明可以调节巨噬细胞的成熟,并有助于肿瘤扩张。
3、大量研究已经明确了参与 在GBM的肿瘤血管生成中(小胶质细胞)驻留巨噬细胞和浸润巨胶质细胞,也称为胶质瘤相关巨噬细胞(GAMs细胞,GAMs)。 虽然GAMs可以产生VEGFA,但其他机制包括GAMs诱导的RAGE-,cxcl2-和IGFBP1-介导的肿瘤血管生成的调节,也已被证实。除了调节血管生成,还积极促进胶质瘤的生长、迁移 和侵袭,并帮助维持神经胶质瘤干细胞的生态位。(研究瓶颈)。
2、 此外,临床研究结果表明GAMs对GBM的预后或复发有重要的功能作用。一些研究指出,GBM中的巨噬细胞主要来源于主要浸润的髓系细胞群,而不是来自常驻的小胶质细胞 。在我们之前的研究中,也检测到GBMs中P2RY12+细胞(小胶质细胞)的数量减少。 巨噬细胞通常被区分为M1和M2表型。 M1巨噬细胞主要与促炎状态相关,而M2巨噬细胞与免疫调节和 伤口愈合相关。与M1巨噬细胞相比,M2巨噬细胞在体外和体内 均被证明具有促血管生成的作用(研究方向)。
研究意义
1、到目前为止,由于肿瘤细胞快速获得耐药性,靶向VEGF的抗 血管生成机制的治疗作用被证明是有限的。耐药性可能与替代血管生成途径的激活有关,如fgf2介导的和 hif1不依赖的机制,这绕过了VEGFA调控肿瘤血管生成的需要。此外,招募和激活的骨髓循环细胞,包括巨噬细胞,可以通过分泌这些替代的促血管生成因子来挽救肿瘤血管生成。
2、M2巨噬细胞可以作为促血管生成调节剂;在GBM中,m2样GAMs主要具有其免疫抑制和肿瘤 支持功能。由于已知GBM中的大多数GAMs具有m2样表型,M2巨噬 细胞的特异性药物靶向可能成为抑制GBM肿瘤血管生成的可行替代治疗方法。
研究内容
一、在本文主要研究了巨噬细胞中CECR1对肿瘤血管生成的影响。
提出假设:
1、GBM组织样本的免疫组织化学评估显示,CECR1的表达与肿瘤中的微血管密度相关,证实了TCGA数据集的数据。
2、在由人周细胞、人脐静脉内皮细胞和 THP1 衍生的三维共培养系统中巨噬细胞,通过 siRNA 敲低 CECR1 和 CECR1 刺激巨噬细胞分别抑制和促进新血管形成。
3、功能丧失和获得研究表明,巨噬细胞中的 PDGFB mRNA 和蛋白质水平受到CECR1调节。巨噬细胞中的 CECR1 促血管生成特性部分是通过旁分泌激活周细胞介导的PDGFB-PDGFRβ信号。巨噬细胞和周细胞之间的 CECR1-PDGFB-PDGFRβ交叉激活促进了周细胞迁移,通过 transwell 迁移测定显示,增强骨膜素的表达和沉积,骨膜素是一种具有促血管生成特性。
4、CECR1 在(M2 )巨噬细胞中的作用是通过介导巨噬细胞和周细胞之间的串扰GBM 通过旁分泌 PDGFB-PDGFRβ 信号传导,促进周细胞募集和迁移以及肿瘤血管生成。所以,CECR1通过免疫调节为GBM中的抗血管生成治疗提供了一个新的先兆靶点。
二、技术路线
三、数据成果分析
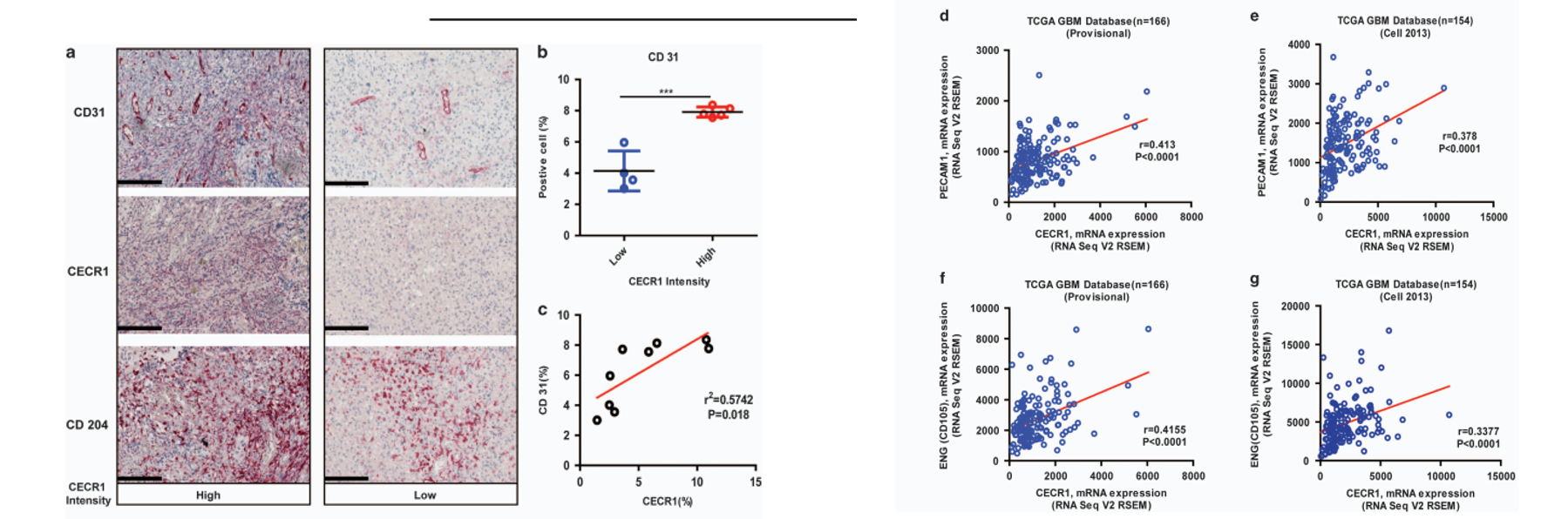
CECR1水平与人GBM中的微血管密度相关。
人GBM样本的免疫组化分析显示,在CECR1水平高与低的样本组中,每个GBM样本每个图 像场CD31+面积的平均百分比显著更高(图1b)。在GBM样本的收集中,CD31和CECR1之间存在显著的正相关关系(图1c)。这些数据与TCGA数据集中数据挖掘的结果一致,GBM中的高CECR1水平与高微血管 密度和CD204+M2巨噬细胞的存在有关。
思路分析:作者上来先通过CECR1与血管新生(CD31)和M2 TAM (CD204) 的相关标志物的表达相关性分析,得出CECR1与CD31,CD204呈现出正相关。接下来,作者假设CECR1参与了M2型TAM的促血管生成作用。为了验证这一猜想,作者使用了3D共培养技术。
、
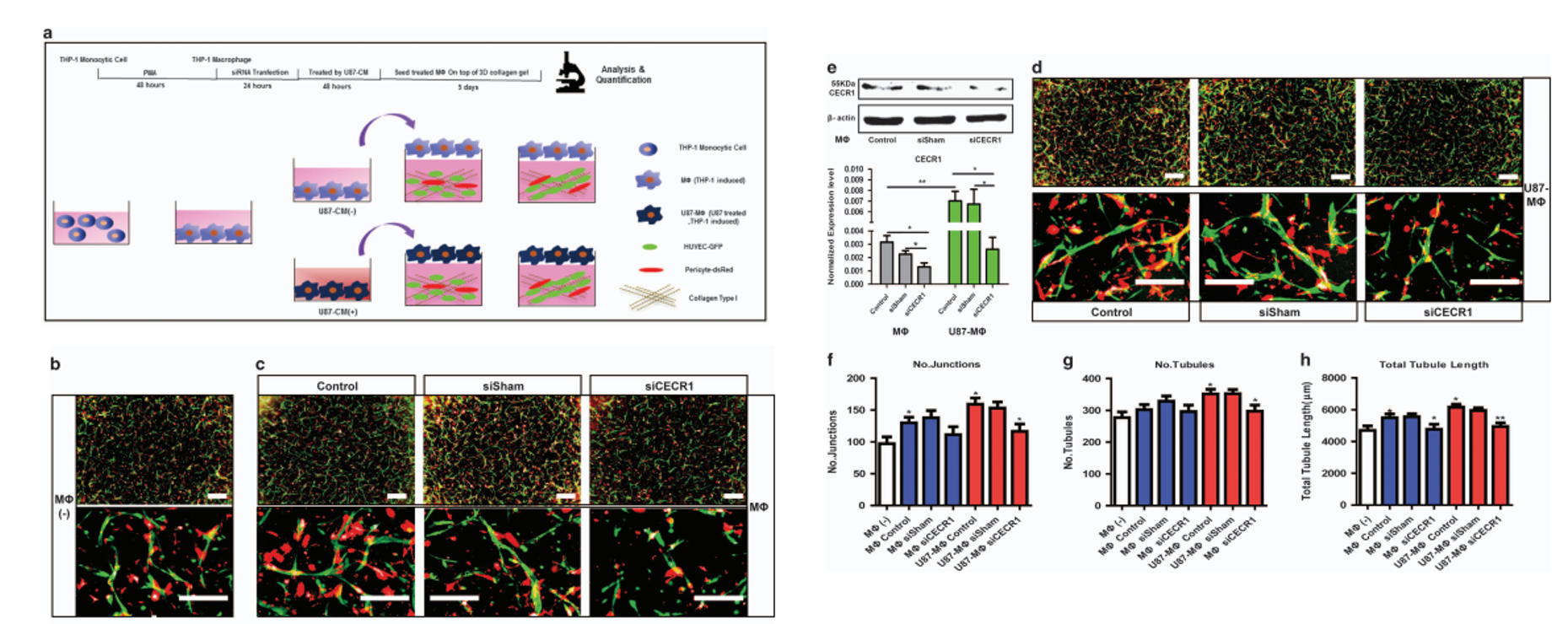
CECR1促进M2的促血管生成旁分泌作用
为了验证这一猜想,作者使用了3D共培养技术。肿瘤相关巨噬细胞(Tumor-associated macrophages,TAMs)是指浸润在肿瘤组织中的巨噬细胞,是肿瘤微环境(TME)的重要组成。之前,我们已经确定M2样巨噬细胞是GBM中产生高水平CECR1的主要细胞类型。我们还发现,CECR1促进M0到M2巨噬细胞极化,并测定M2旁分泌活性。
文中研究了CECR1在GBM样环境中巨噬细胞介导的血管生成中的作用。血管生成通过3D共培养试验进行评估,该试验由胶原基质组成,其中GFP标记的HUVEC直接与dsRed标记的人源性周细胞相互作用。这个复杂的系统模拟了微血管形成中的完整事件序列,使我们能够在5天的时间范围内研究血管萌芽、血管细胞在3D基质环境中的迁移、多细胞血管形成、管腔化、周细胞募集、周血管覆盖和微血管稳定。
之前的研究表明,M2巨噬细胞是GBM中CECR1的主要产生者。在这里,我们研究了旁分泌促血管生成作用是否可以通过CECR1直接刺激血管细胞部分介导。事实上,用重组CECR1刺激共培养物增加了连接数、小管数和小管总长度,表明CECR1可以直接刺激血管细胞(补充图4a和b)。
这些数据表明CECR1在调节巨噬细胞促血管生成功能中起着重要作用。
思路分析:作者使用人单核细胞THP-1细胞系,先通过PMA(佛波酯)诱导成巨噬细胞。再通过siRNA沉默CECR1。沉默CECR1后使用胶质瘤细胞U87的条件培养基(CM)诱导巨噬细胞成TAM。接下来,作者将不同组的TAM加入在包埋在I型胶原(collagen I)中的周细胞(Pericyte,红色)和血管内皮细胞(HUVEC,绿色)的3D培养体系中。
周细胞:周细胞是一种包围全身毛细血管和静脉中的内皮细胞的细胞,其可通过物理接触或旁分泌的方式调控血管内皮细胞的功能。
共培养后,作者发现,在共培养体系加入未经CM诱导的巨噬细胞后,能够促进血管形成(图中绿色为GFP标记的HUVEC细胞,红色为dsRed标记的周细胞)。而加入CM诱导的巨噬细胞后,这种促血管生成的作用进一步加强。然而,不管是在诱导还是未诱导的巨噬细胞中沉默CECR1,都能抑制巨噬细胞对血管生成的促进作用。
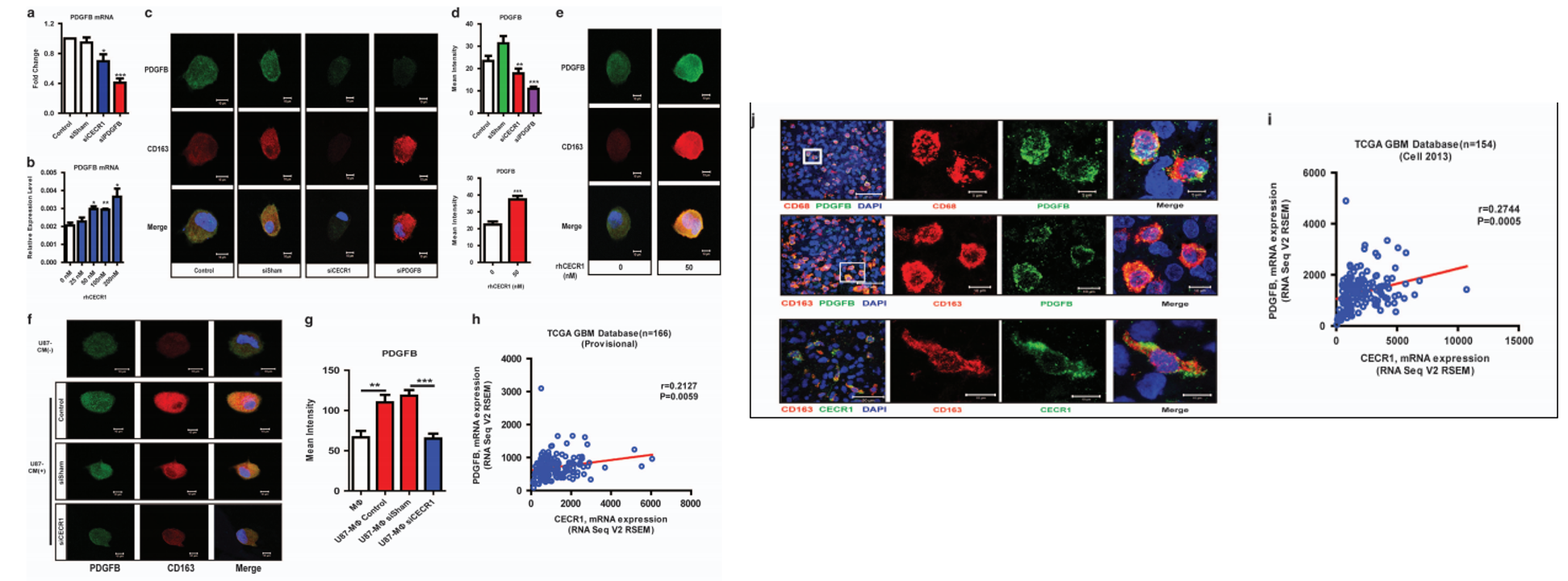
CECR1介导的巨噬细胞旁分泌激活通过GBM中的PDGFB\/PDGFRβ信号促进周细胞募集。
接下来,为了确定哪些已知的促血管生成分子与CECR1的表达相关,作者对9个公认的促血管生成基因(PDGFB、VEGFA、ANGPT1、ANGPT2、MMP7、MMP9、VWF、IL8、Tie-2)进行检测,结果发现沉默CECR1能够显著降低PDGFB的表达(Fig 3a),而过表达 CECR1能够显著增加PDGFB 的表达(Fig 3b), 在fig 3c~3e中,作者通过免疫荧光,进一步证实了qPCR的结果。同时,作者发现U87的CM加入能够诱导巨噬细胞表达PDGFB,而这一作用能够被CECR1沉默所逆转(fig 3f, 3g)。最后,作者还在TCGA数据库中,验证了CECR1与PDGFB呈现正相关性。
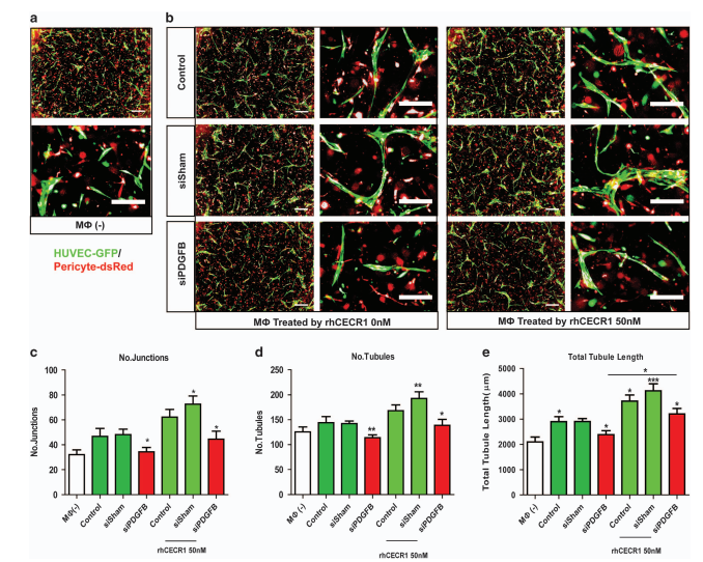
在巨噬细胞中沉默PDGFB能够抑制CECR1对巨噬细胞促血管作用的促进作用。
为了评估PDGFB在巨噬细胞CECR1调控血管生成中的作用,我们 与PDGFB沉默的巨噬细胞进行了共培养实验。与的 PDGFB沉默巨噬细胞共培养模拟了cecr1沉默巨噬细胞处理的共 培养的表型,显示所有活性血管生成参数普遍减少(图4a-e)。用 rhCECR1治疗PDGFB巨噬细胞(siPDGFBvsPDGFB+rhCECR1,总小管长度)挽救了这部分减少,表明巨噬细胞中CECR1的旁分泌促血 管生成作用部分是通过PDGFB介导的(图4a-e)。
思路分析:作者接下来通过回复实验,证实了在巨噬细胞中沉默PDGFB能够抑制CECR1对巨噬细胞促血管作用的促进作用。
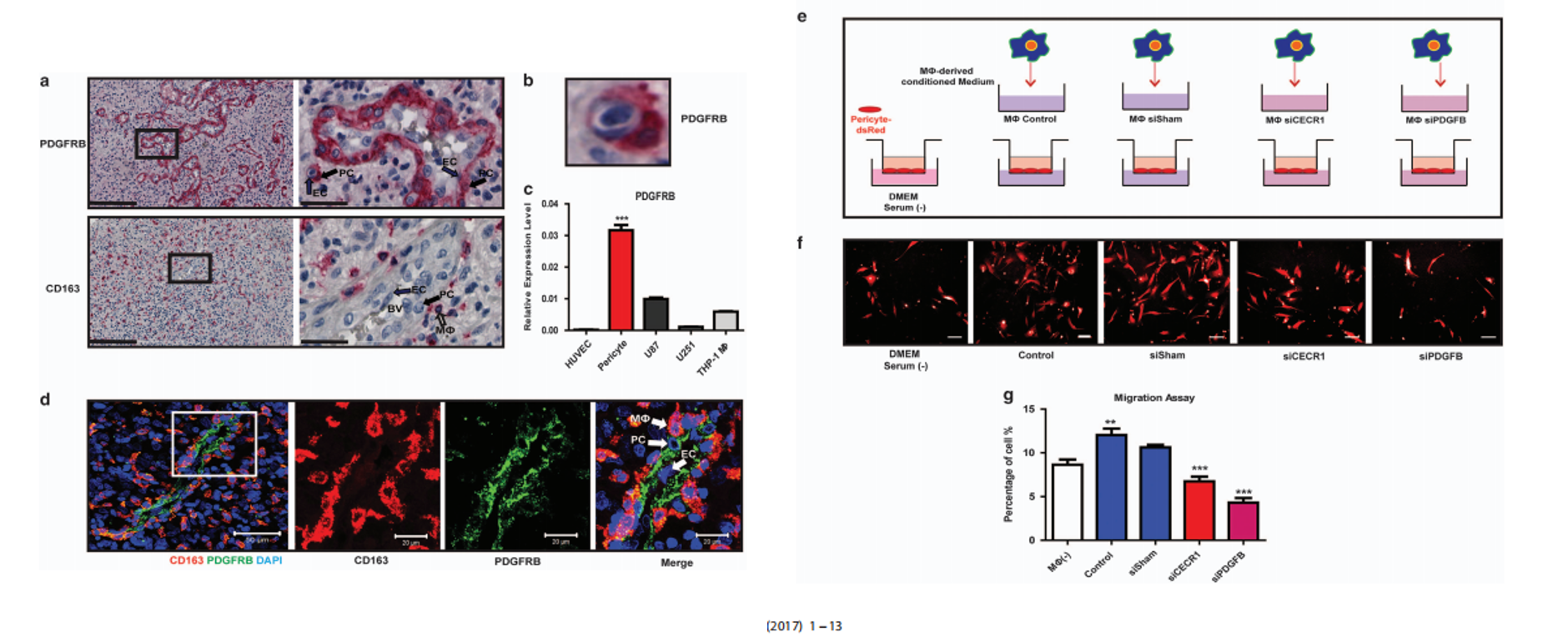
CECR1-PDGFB-PDGFRβ巨噬细胞和周细胞之间的旁分泌串扰介导
接下来作者通过实验证实, PDGFB的受体PDGFRβ,主要表达在周细胞上。且已知PDGFB/PDGFRβ通路能够促进周细胞的增殖以及周细胞向新生血管的募集和附着以维持新生血管的稳定,那么我们可以跟着作者的思路自然猜测,CECR1介导的巨噬细胞的促血管作用,可能是通过激活周细胞的PDGFB/PDGFRβ通路完成的。
通过将沉默了CECR1,或PDGFB的Mφ的条件培养基诱导周细胞,transwell实验发现CM的加入能够显著诱导周细胞的迁移,而沉默CECR1或PDGFB则无次作用,证实了作者之前的猜测。
总结思考
1.总结下来,作者发现了一个分子CECR1与巨噬细胞的促血管生成作用有关,而这一作用是通过促进巨噬细胞释放PDGFB, 激活周细胞的PDGFB/PDGFRβ通路,产生Periostin蛋白,最终促进血管新生而实现的。
2.这种将我们常见的A分子-B分子-C分子的套路变成A分子-A细胞-B分子-B细胞-C分子-C细胞的方式非常值得我们在课题设计的时候进行借鉴
文中涉及的实验技术
以上文献涉及的实验技术,均可在晶莱生物展开。
【晶莱生物】是一家专注于生物医学领域内科研学术服务的高新技术企业,致力于打造国内一流的生物技术服务品牌。为生物医学研究者提供动物造模、细胞生物学、基因组学、蛋白鉴定及分析、病理组化、表观遗传学等多个实验平台服务。


