
Long noncoding RNA NEAT1 promotes ferroptosis by modulating the miR-362-3p/MIOX axis as a ceRNA
长链非编码RNA NEAT1作为ceRNA通过调节miR-362-3p/MIOX轴促进铁死亡

期刊:Cell Death & Differentiation
发表时间:2022-03-25
影响因子:12.067
研究背景
肝癌(HCC)的发病率和死亡率位居中国癌症排行榜前五,2016年的死亡率位居第二,仅次于肺癌。(疾病背景)
长非编码RNA(LncRNA)是一类长度超过200nt的RNA,LncRNA可以像海绵一样,作为竞争性内源RNA (ceRNA)吸附miRNA,以减少miRNA对其靶mRNA的调节(作用机制)。LncRNA NEAT1 有2个转录本NEAT1_1(3.7 kb)和NEAT1_2 (23 kb),在多种人类肿瘤中高表达,参与肿瘤细胞增殖、迁移、周期和凋亡的调控,从而促进肿瘤发展并与肿瘤患者预后不良相关。
铁死亡(Ferroptosis)是一种由铁依赖的脂质过氧化诱导的新型调节性细胞死亡,在肿瘤的发生和耐药中起着重要作用,近年来,越来越多的研究发现LncRNA参与了细胞铁死亡。

肌醇加氧酶(Myo-inositol oxygenase,MIOX)是一种33kDa的非血红素铁蛋白,通过葡萄糖醛酸-木糖途径将肌醇代谢为D-葡萄糖醛酸。MIOX上调促进ROS的产生,减少烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和谷胱甘肽(GSH),导致细胞抗氧化能力下降。
技术路线
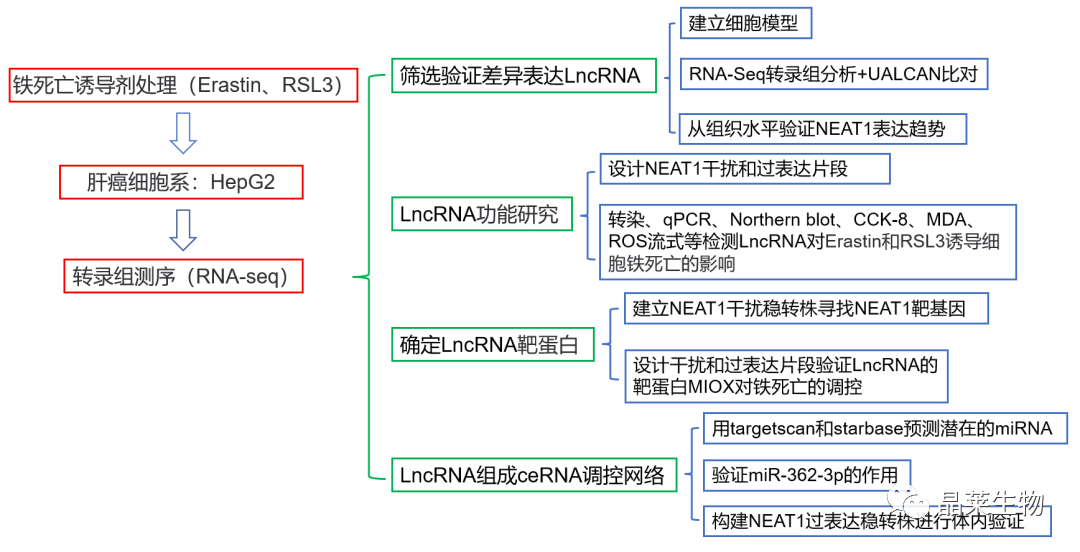
研究结果及分析
1.1 NEAT1在erastin和RSL3诱导的铁死亡中上调
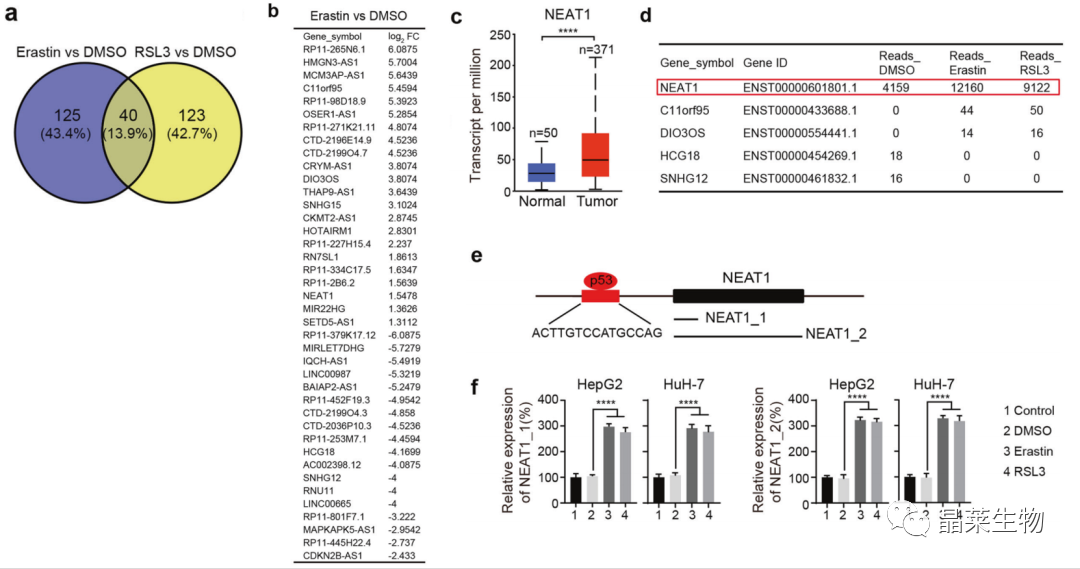
a. HepG2细胞RNA-seq;
b. 重叠基因列表;
c. UALCAN数据库分析;
d. HepG2细胞中5个lncRNAs的读取计数;
e. NEAT1基因亚型及p53结合位点示意图;
f. 诱导剂促进NEAT1基因mRNA表达。
1.2 erastin和RSL3诱导的NEAT1表达由p53介导
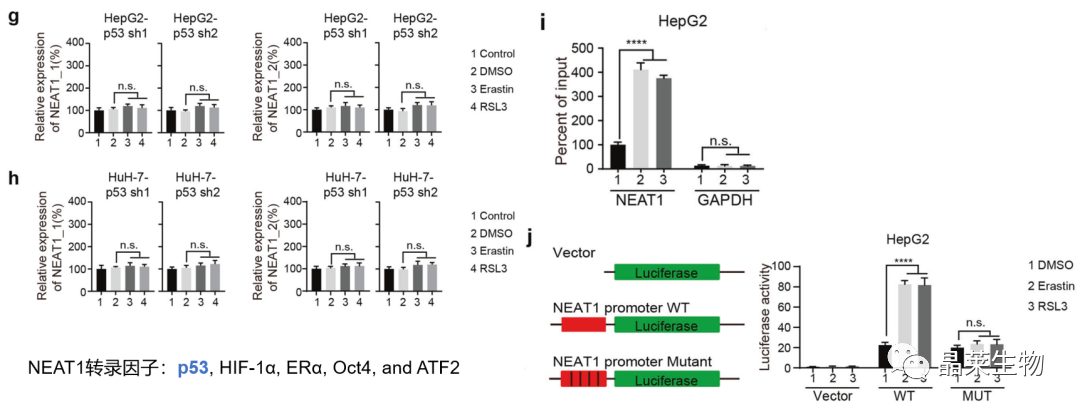
g、h. 干扰p53后,NEAT1的mRNA表达未受到影响;
i. ChIP-qPCR:p53显著富集;
j. 荧光素酶报告基因:诱导剂增加了NEAT1野生型启动子活性。
2. NEAT1促进erastin和RSL3诱导的铁死亡
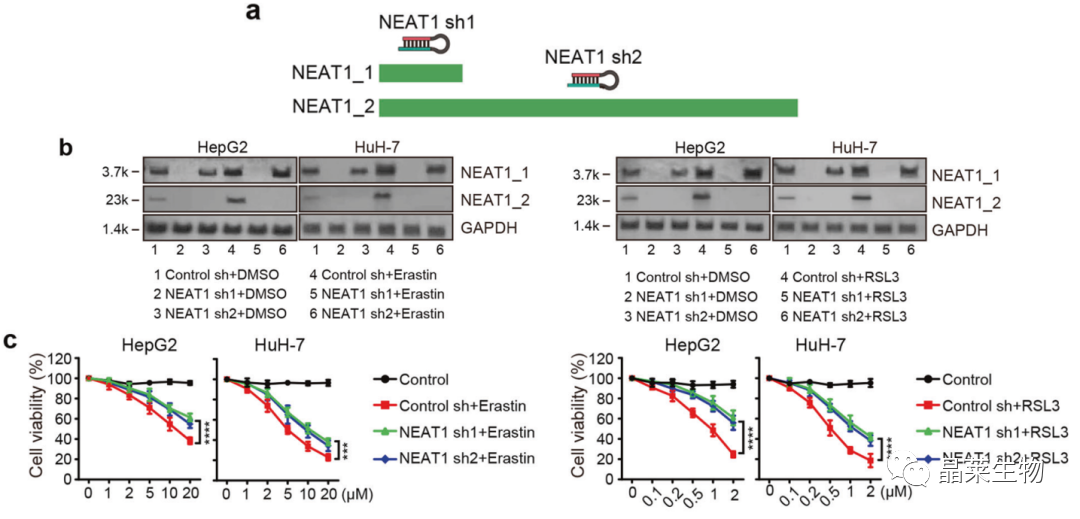
a. shRNA干扰位置图;
b. Northern Blot检测干扰稳转株中NEAT1两个转录本的表达;
c. CCK-8:敲降NEAT1能抑制erastin和RSL3诱导的铁死亡。
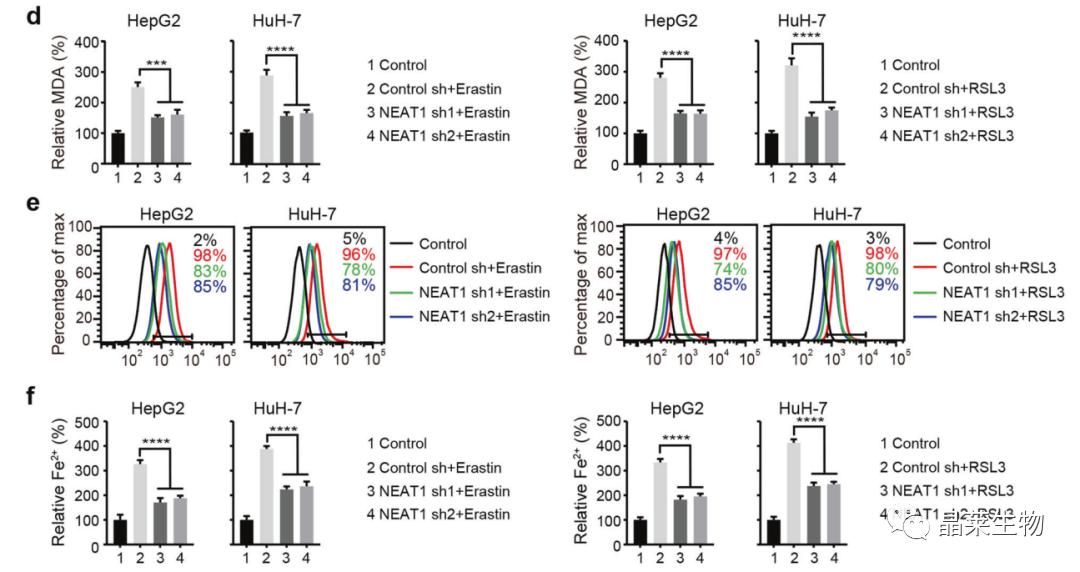
d. 酶标法检测MDA;
e. 流式检测脂质ROS;
f. 酶标法检测Fe2+。
敲降NEAT1显著抑制了MDA、ROS和Fe2+的积累。
MDA(丙二醛)是脂质ROS的终产物,铁死亡的关键:Fe2+和脂质ROS。

3.NEAT1通过调节MIOX的表达来调控铁死亡
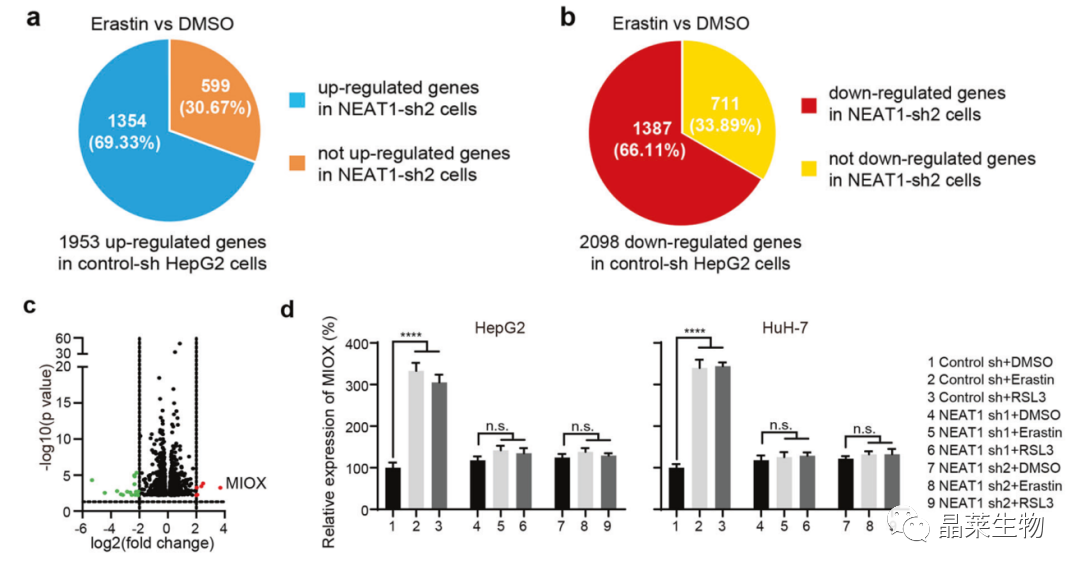
a、b. RNA-seq分析:敲降NEAT1后,599个上调、711个下调基因对Erastin无反应;
c. 火山图:反映a和b中NEAT1调节的差异表达基因。6个上调,15个下调;
d. qPCR:诱导剂无法诱导NEAT1敲降的细胞中MIOX的上调;
铁死亡诱导的MIOX表达依赖于NEAT1。
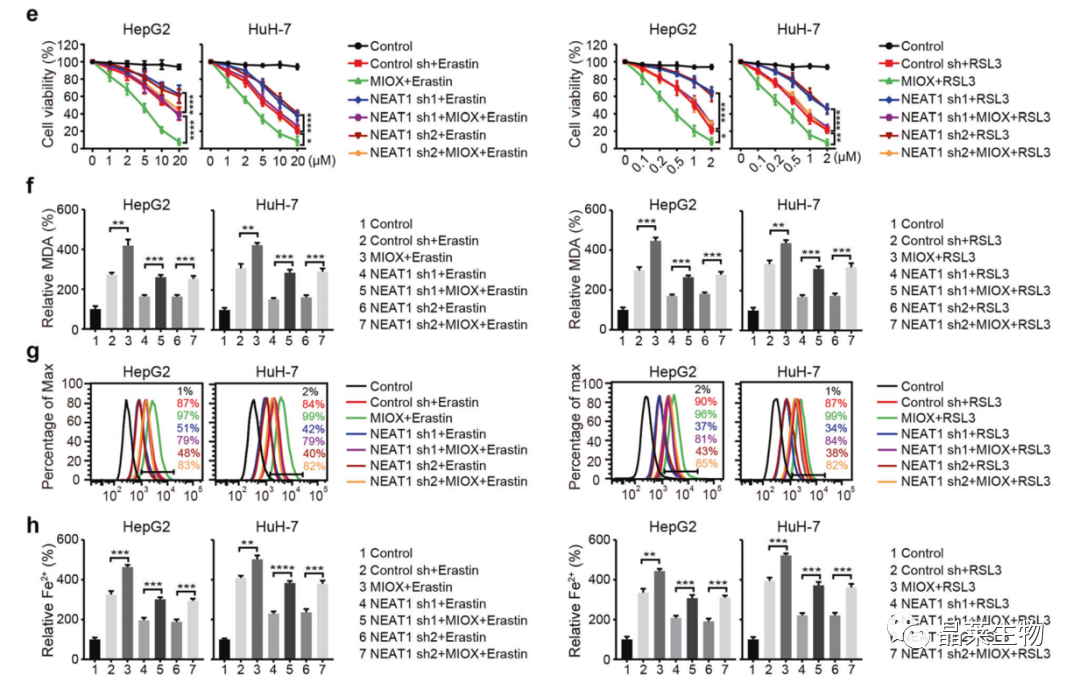
e. CCK-8:MIOX的过表达挽救了由NEAT1干扰抑制的铁死亡;
f-h. MDA、ROS和Fe2+检测。

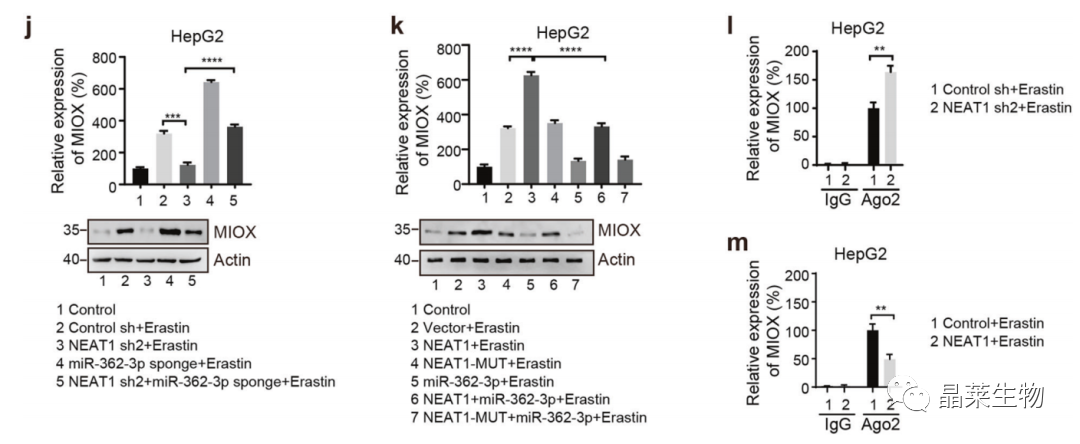
4. MIOX通过调节Fe2+, GSH和NADPH促进铁死亡
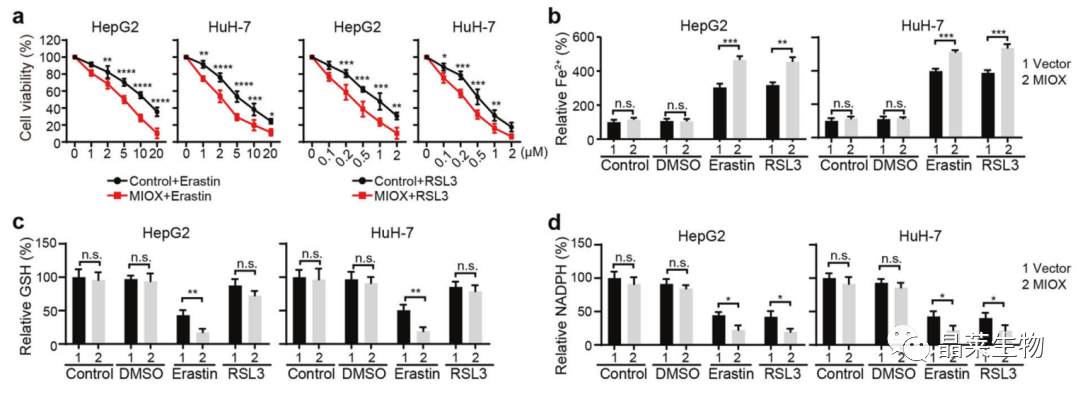
a. CCK-8:MIOX的过表达促进了erastin和RSL3诱导的铁死亡;
b-d. Fe2+, GSH和NADPH检测。
GSH:抗氧化剂,清除胞内脂质H2O2,防止铁死亡;
NADPH:有助于消除脂质ROS,调节细胞对铁死亡的敏感性。
铁死亡诱导剂:
Erastin:半胱氨酸↓,GSH↓,ROS↑
RSL3:结合GPX4活性位点
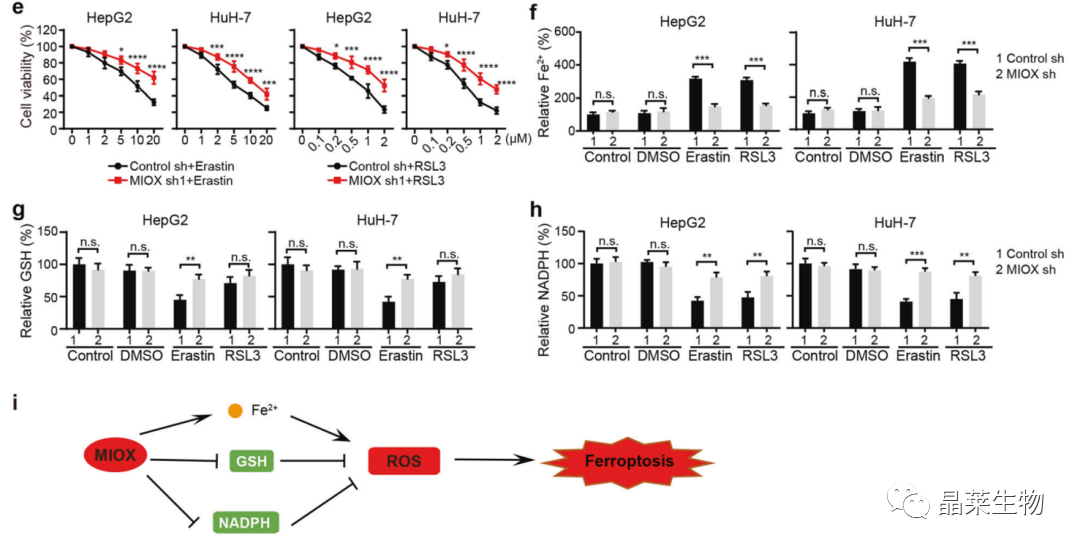
e. CCK-8:敲降MIOX抑制了erastin和RSL3诱导的铁死亡;
f-h. Fe2+, GSH和NADPH检测;
i. MIOX调节铁死亡的机制示意图。

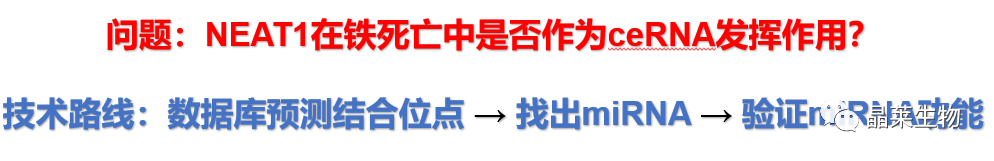
5.1 MiR-362-3p参与NEAT1对MIOX的调节
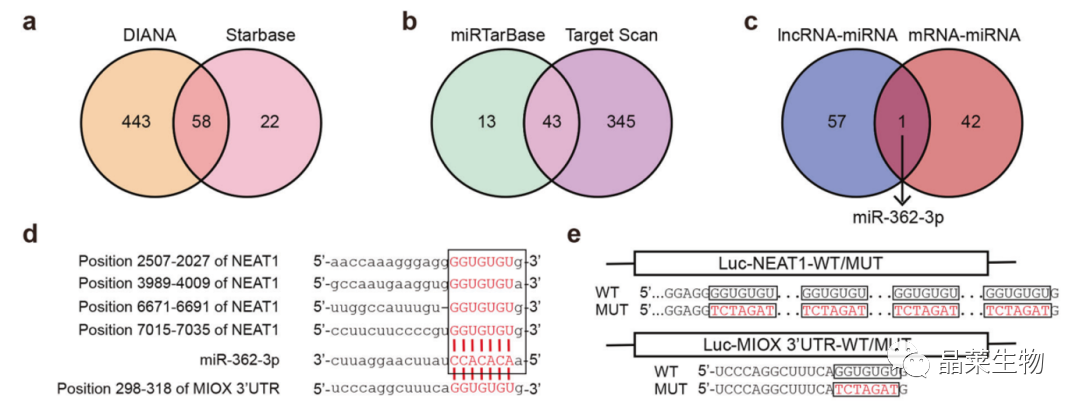
a. 预测工具:在NEAT1中寻找潜在的miRNA结合位点;
b. 预测工具:在MIOX中寻找潜在的miRNA结合位点;
c. 预测结果比对:筛选出了唯一重叠的miR-362-3p;
d. 序列比对:NEAT1、MIOX、miR-362-3p;
e. WT和MUT示意图。
5.2 MiR-362-3p与NEAT1和MIOX相互作用
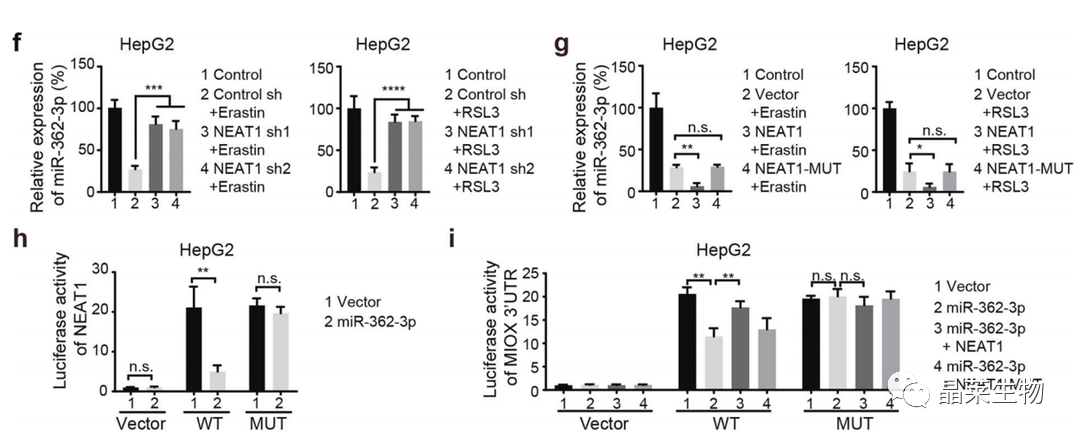
f、g. qPCR:敲降or过表达NEAT1会增加or降低miR-362-3p的表达;
h. 荧光素酶报告基因实验:miR-362-3p的过表达显著抑制野生型NEAT1的转录活性;
i. 荧光素酶报告基因实验:miR-362-3p对MIOX-3’UTR的活性可以通过NEAT1过表达而部分恢复。
j. qPCR+WB:干扰miR-362-3p显著增加了由NEAT1敲降导致的MIOX表达的下调;
k. qPCR+WB:miR-362-3p的过表达显著抑制了由NEAT1诱导的MIOX的表达;
l、m. RIP:Ago2-miR-362-3p复合物降低的MIOX mRNA水平在NEAT1缺失的HepG2中显著富集。
miRNA以Ago2依赖的方式抑制mRNA翻译;
MIOX和miR-362-3p之间的相互作用受NEAT1表达水平的影响。
6. MiR-362-3p通过调节MIOX抑制铁死亡
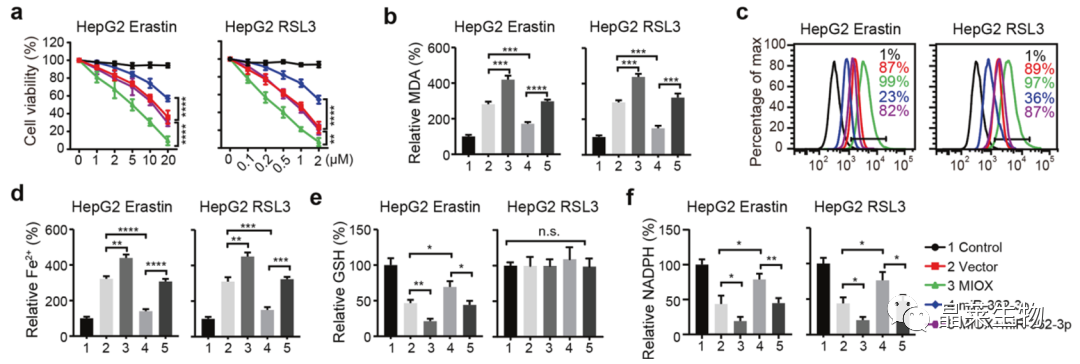
a. CCK-8:过表达miR-362-3p能降低MIOX所导致的促进细胞死亡作用;
b-d. MDA、ROS、Fe2+检测:过表达MIOX后,得到恢复;
e、f. GSH和NADPH检测:MIOX过表达抑制了由miR-362-3p诱导的GSH和NADPH水平。
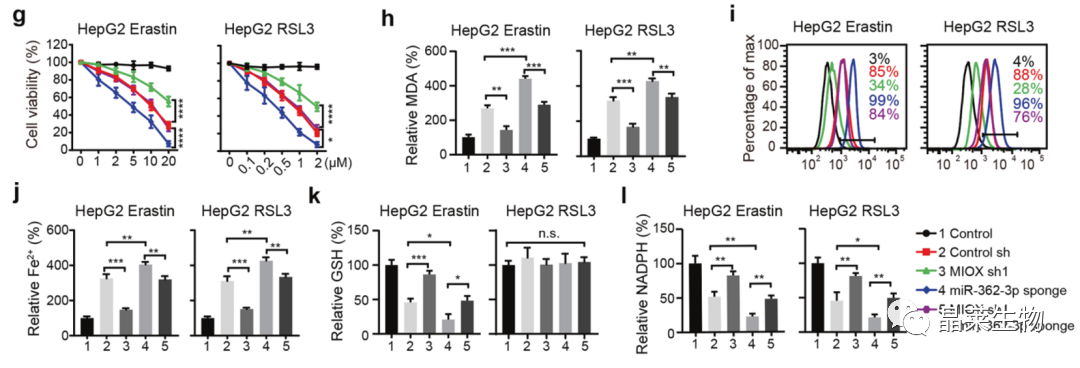
g. CCK-8:下调miR-362-3p显著促进了铁死亡,而MIOX的敲降抑制了由miR-362-3p下调导致的铁死亡;
h-j. MDA、ROS、Fe2+检测:下调miR-362-3p显著促进MDA、ROS、Fe2+的积累;
k、l. GSH和NADPH检测。
7. NEAT1过表达促进erastin或RSL3在体内外诱导的铁死亡
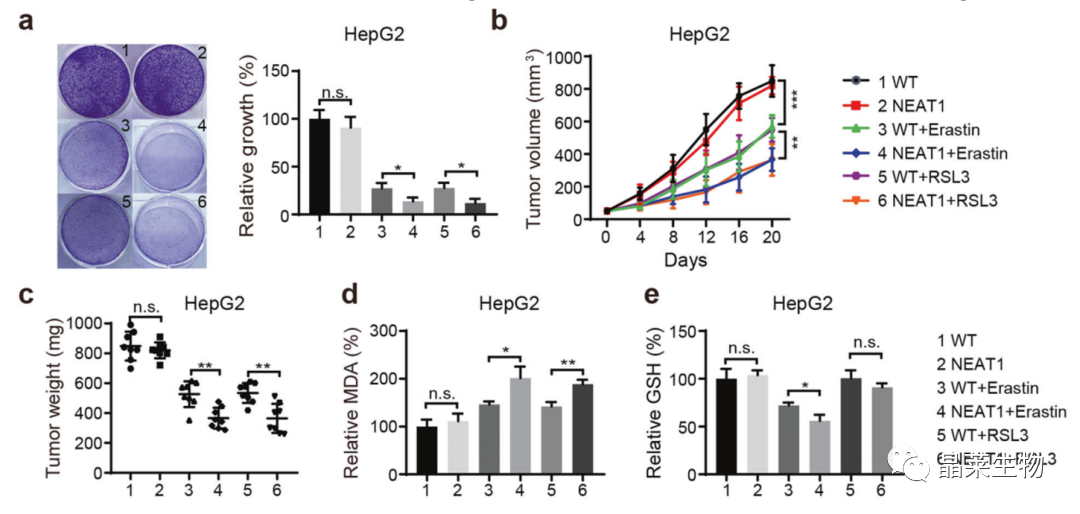
a. 克隆形成:慢病毒构建稳转株;NEAT1过表达增加了erastin和RSL3诱导的铁死亡;
b、c. 皮下移植细胞+腹腔注射小鼠erastin或RSL3;
d、e. MDA、GSH检测。
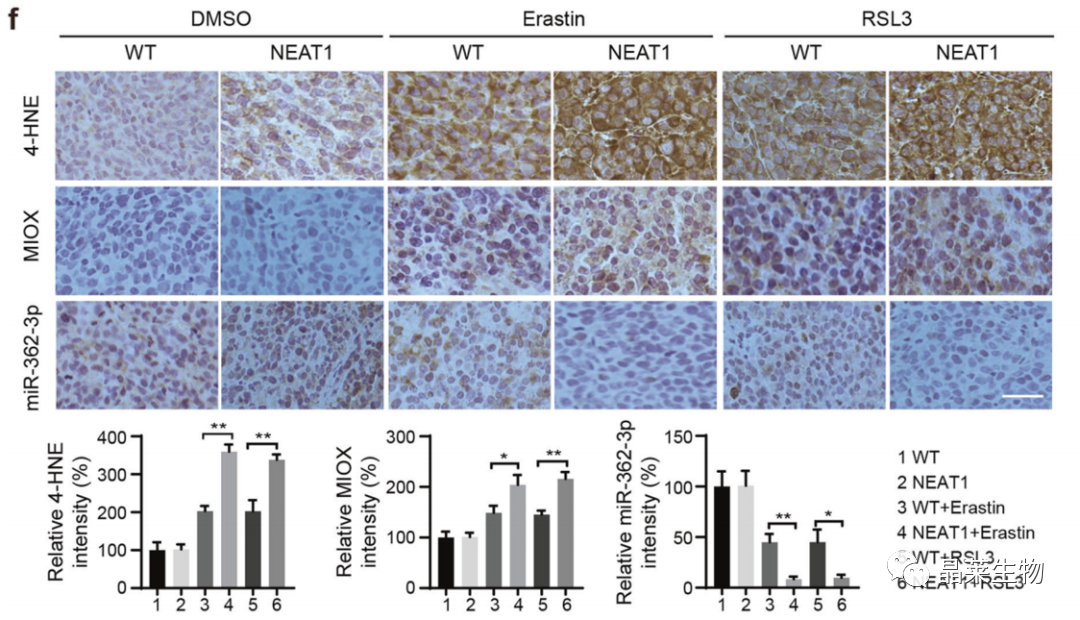
f.免疫组化和原位杂交染色。
4-HNE是一种氧化应激标志物,脂质过氧化的主要产物,ROS激活脂质氧化,从而产生4-HNE。
文献结论
NEAT1是p53的直接靶基因,在erastin或RSL3诱导的肝癌细胞铁死亡期间显著上调。NEAT1可以竞争性结合更多的miR-362-3p,从而减少miR-362-3p介导的MIOX降解,进而增加肝癌细胞对铁死亡的敏感性。
总之,文章结果表明NEAT1是一种重要的lncRNA,在铁死亡中发挥了新的、不可或缺的作用。
临床意义:
NEAT1影响肿瘤对化疗药物的敏感性,对于NEAT1高表达的患者,铁死亡疗法与其他疗法相结合将会取得更好的治疗效果。

文献总结
创新点:
1.首次揭示了lncRNA NEAT1在铁死亡中的作用
erastin或RSL3诱导肝癌细胞中NEAT1高表达,NEAT1通过竞争性地结合miR-362-3p以降低靶基因MIOX的降解,即促进MIOX表达,高表达的MIOX能增加ROS产生并降低细胞内NADPH和GSH水平,从而进一步加剧erastin或RSL3诱导的铁死亡。
2.为临床治疗肝癌提供了新思路
对于NEAT1高表达的患者,铁死亡疗法与其他疗法相结合将会取得更好的治疗效果。
文献使用的实验技术

关注公众号,了解更多!
