
Demethylzeylasteral targets lactate by inhibiting histone lactylation tosuppress the tumorigenicity of liver cancer stem cells
去甲泽拉木醛通过抑制组蛋白乳酸化来抑制肝癌干细胞的致瘤性

期刊:Pharmacological Research
发表时间:2022
影响因子:7.658
研究背景
肝细胞癌(HCC)是世界上最常见的癌症之一,也是癌症相关死亡的主要原因。居恶性肿瘤的第5位,死亡率位居恶性肿瘤的第3位。我国是肝癌的高发国家,肝癌病例约占全球的55%,死亡率仅次于肺癌,位居第二。(临床疾病)
肿瘤干细胞是肿瘤中具有自我更新能力并能产生异质性肿瘤细胞的细胞,驱动肿瘤的起始、进展和复发,促进许多类型的癌症产生化疗耐药性。肝癌干细胞(LCSCs)被认为直接参与了HCC的进展和复发,促进原发性癌细胞的生长和继发性肿瘤的转移,导致疾病的复发。(实验对象)
乳酸(lactate)从肿瘤细胞中的丙酮酸转化而来,是众所周知的能源和代谢副产物,最新的研究表明,除了代谢功能,乳酸通过一种称为乳酸化的翻译后修饰,修饰组蛋白,调控基因的转录表达。组蛋白乳酸化首次被鉴定为巨噬细胞、A549人肺癌细胞系和眼部黑色素瘤细胞中的一种新型的表观遗传修饰。(最新研究发现、新的突破口)
前期研究表明,肝癌患者临床样本中的组蛋白乳酸化水平明显高于癌周围组织。(立项依据)
因此,探索组蛋白乳酸化在HCC肿瘤发生中的潜在功能具有重要意义,组蛋白乳酸化驱动的肝癌干细胞(CSCs)代谢重编程可能是该疾病的一个新的治疗靶点。(治疗靶点)
去甲泽拉木醛(DML)是从雷公藤中提取的一种三萜化合物,已被证明在许多癌症中抑制血管生成和细胞增殖,如黑色素瘤、胶质瘤和乳腺癌。(老药新用)
文献研究的科学问题
1. 去甲泽拉木醛是否有抗肝癌活性,哪些细胞行为被影响?
2. 肝癌发生过程是否有组蛋白乳酸化现象,组蛋白乳酸化是否可以促进肝癌进展?
3. 去甲泽拉木醛是否通过抑制组蛋白乳酸化抑制肝癌进展?
4. 药物的直接靶点、激活的下游通路、具体的调控机制是什么?
文章框架&技术路线

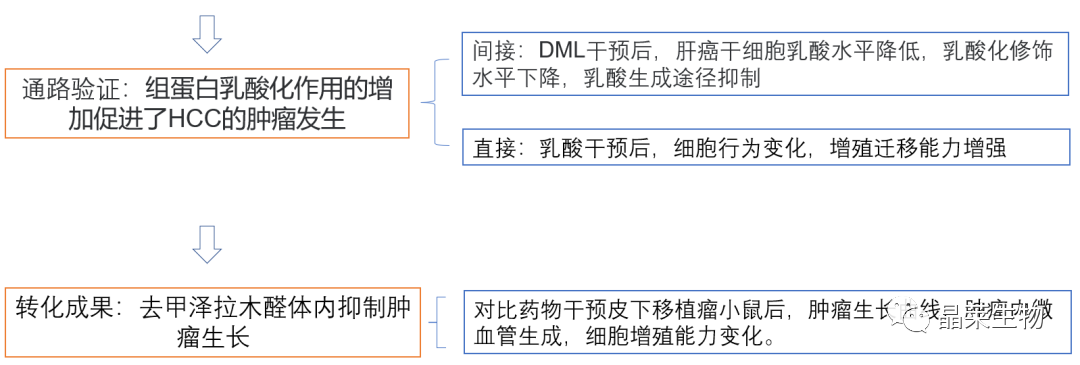
文章结果及分析
1. 肝癌干细胞分选及鉴定
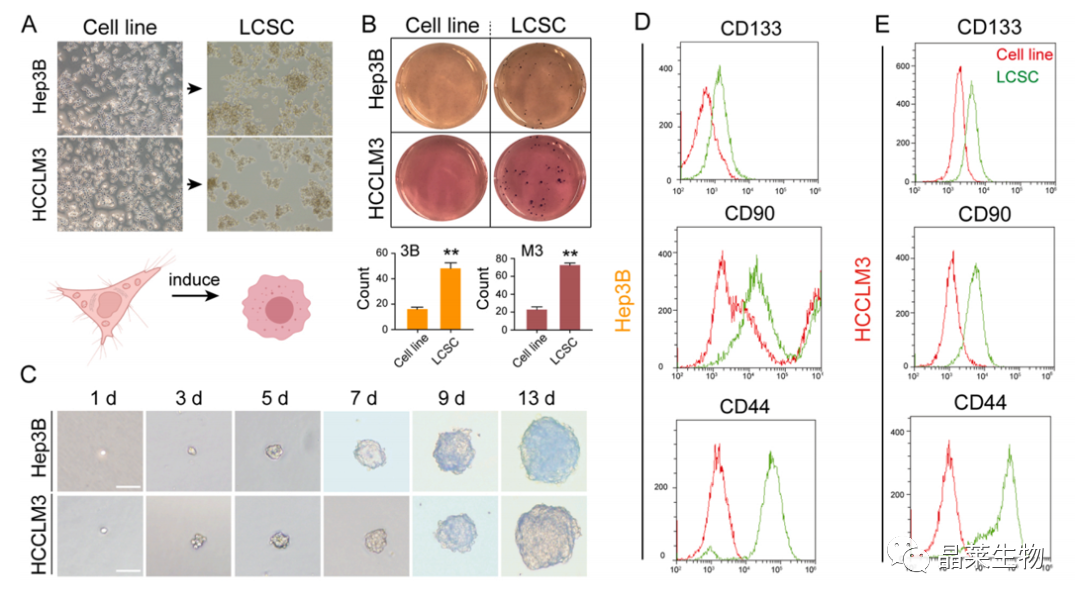
(A) HCC细胞系和球形细胞的形态学特征。
(B) HCC细胞系与球形细胞克隆形成的比较。
(C) 由单个P3 SFC形成球体的过程,比例尺=100µm。
(D,E) 流式检测CD133、CD44和CD90的表面干细胞标记物。
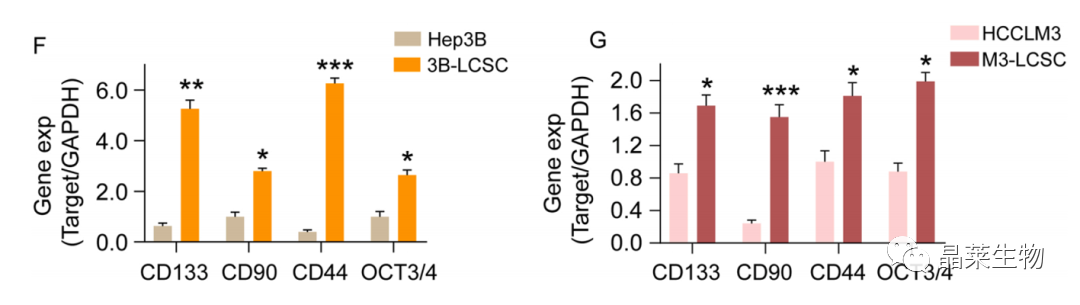
(F,G) 采用q-PCR方法检测CD133、CD44、CD90和OCT3/4等表面标记物.
结论:肝癌干细胞具有干细胞干性,更强的增殖、成球能力,直接筛选抗肝癌干细胞药物更有意义
2.1 去甲泽拉木醛抑制肝癌干细胞增殖活性
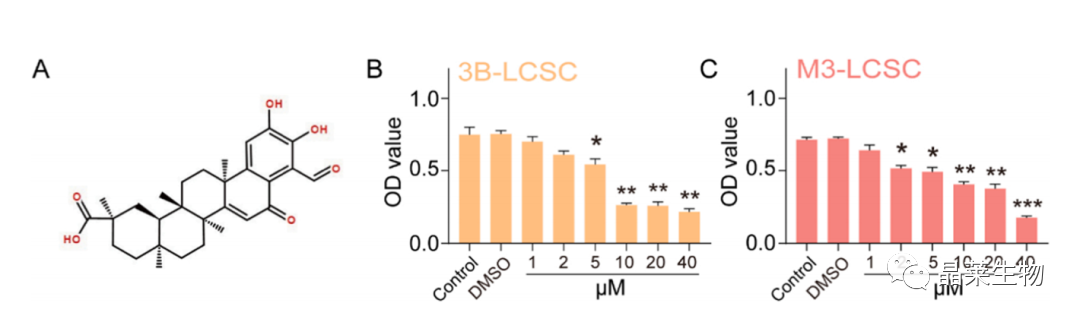
(A) DML的分子结构。
(B,C)用CCK8法测定指定浓度处理的3B-LCSCs和M3-LCSCs的细胞活力。
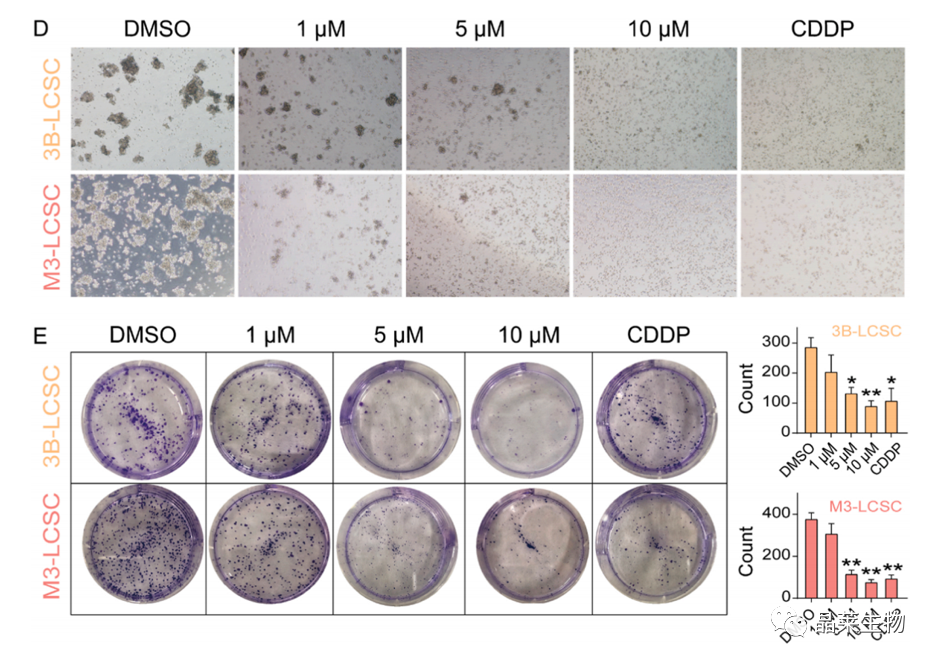
(D) 3B-LCSCs和M3-LCSCs在不同浓度DML作用1、5和10 μM处理24 h后的形态。
(E) 以1、5和10 μM DML处理后的3B-LCSCs和M3- LCSCs的克隆形成。
2.2 去甲泽拉木醛诱导肝癌干细胞周期阻滞
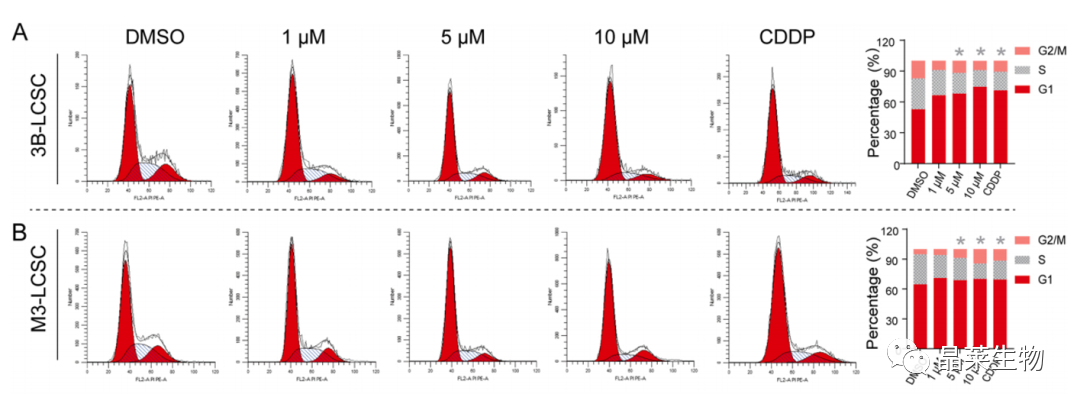
(A,B)流式细胞术分析DML处理3B-LCSCs和10 μM 24 h后的细胞周期。以2 μg ml-1 CDDP为阳性对照。

(E,F)3B-LCSCs和M3-LCSCs细胞中CDK2、细胞周期蛋白D1和细胞周期蛋白E1的代表条带。
(G、H)定量图像分析。
2.3 去甲泽拉木醛诱导肝癌干细胞凋亡
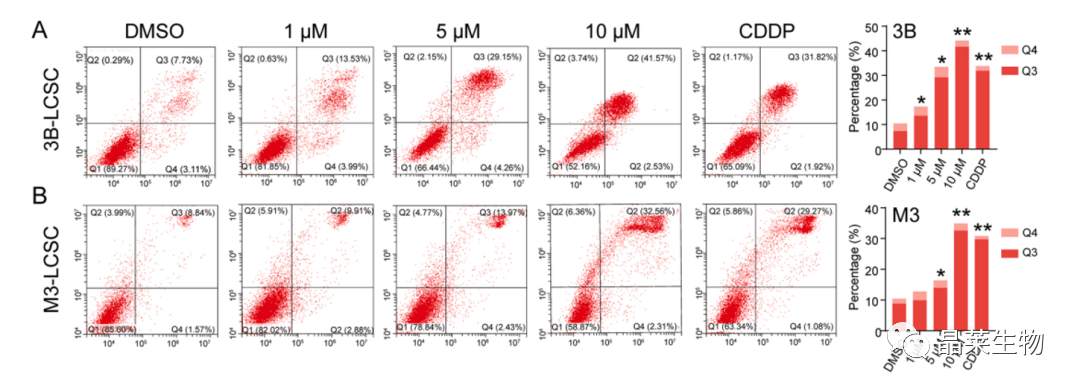
(A,B)采用流式细胞术检测DML在1、5和10 μM处理48 h后的3B-LCSCs和M3-LCSCs的凋亡情况。以2 μg ml-1 CDDP为阳性对照。
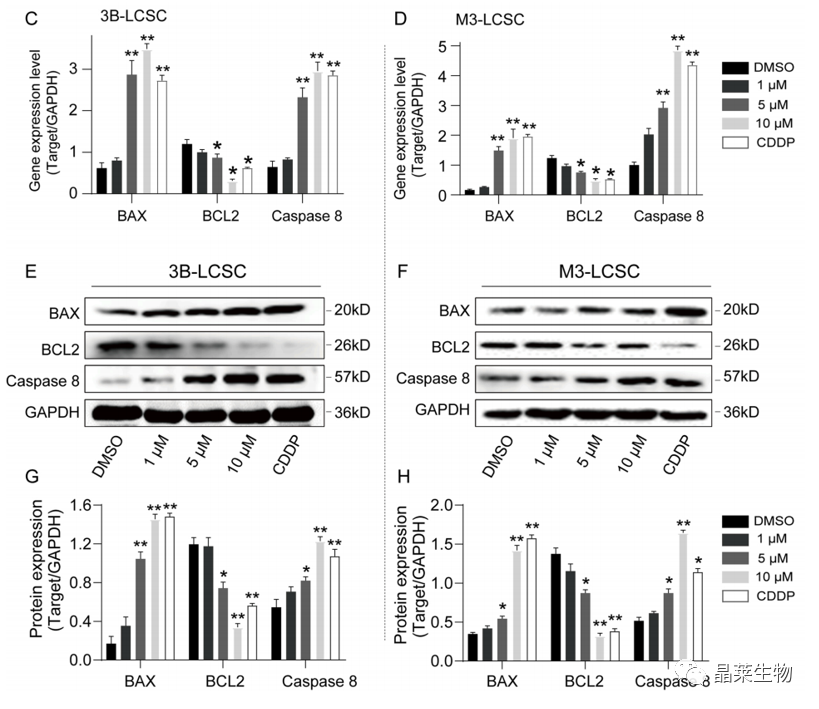
(C,D)qPCR检测3B-LCSCs和M3-LCSCs和M3-LCSCs细胞中BAX、BCL2和Caspase 8的基因表达。
(E,F)WB检测代表性条带。
(G、H)图像分析。
2.4 去甲泽拉木醛抑制肝癌干细胞迁移能力
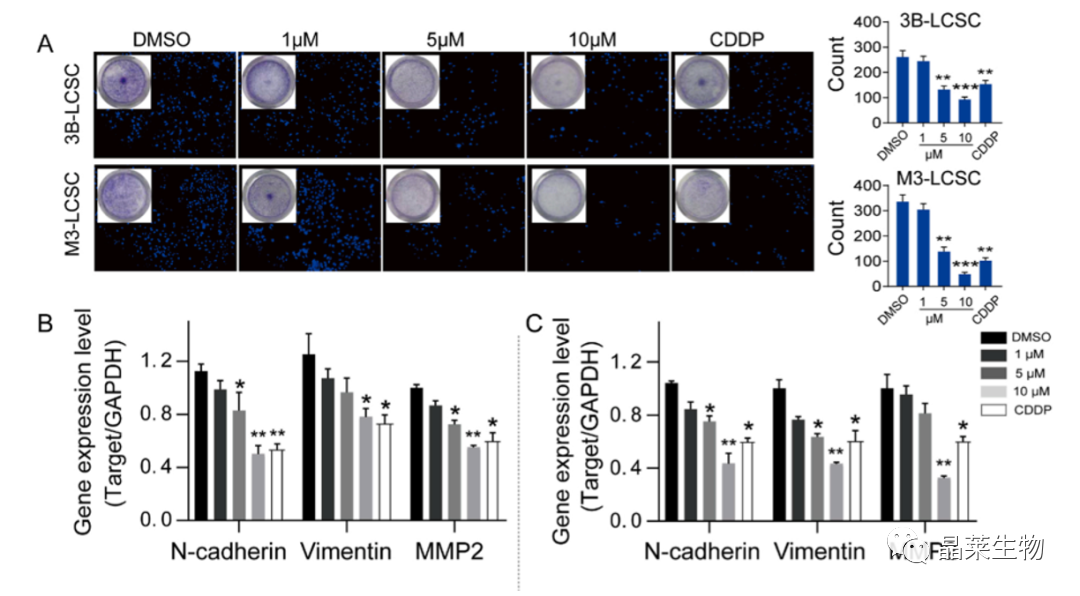
(A)3B-LCSCs和M3-LCSCs在1、5和10 μM处理后的Transwell迁移试验。
(B,C)迁移标志物n-钙粘蛋白、波形蛋白和MMP2的基因表达情况。
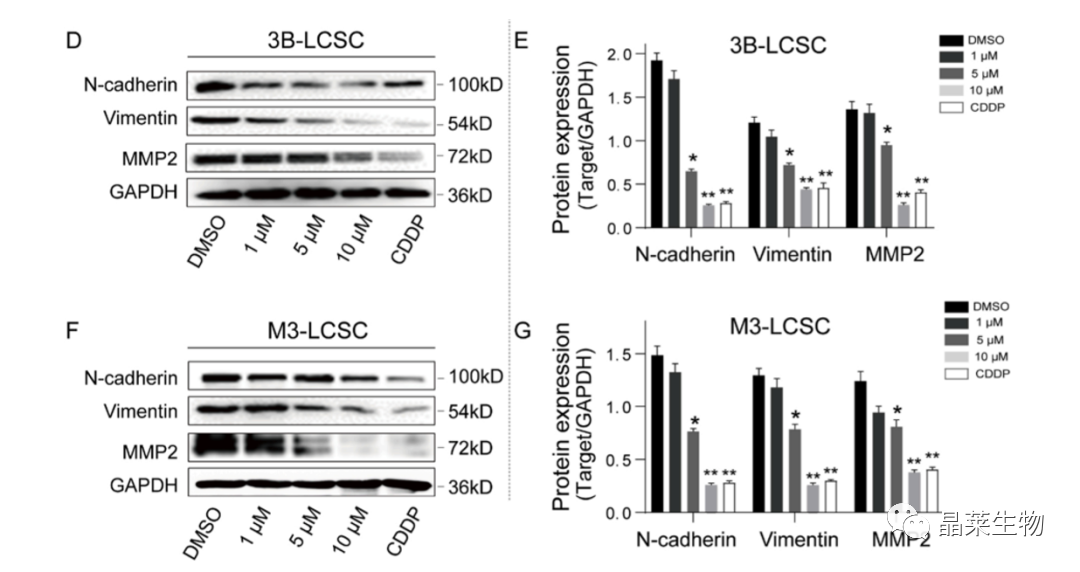
(D,F)3B-LCSCs和M3-LCSCs细胞中钙粘蛋白、波形蛋白和MMP2的代表性条带,处理12 h。(E、G)(D、F)的定量图像分析。
3.1 去甲泽拉木醛干预后转录组测序筛选差异基因
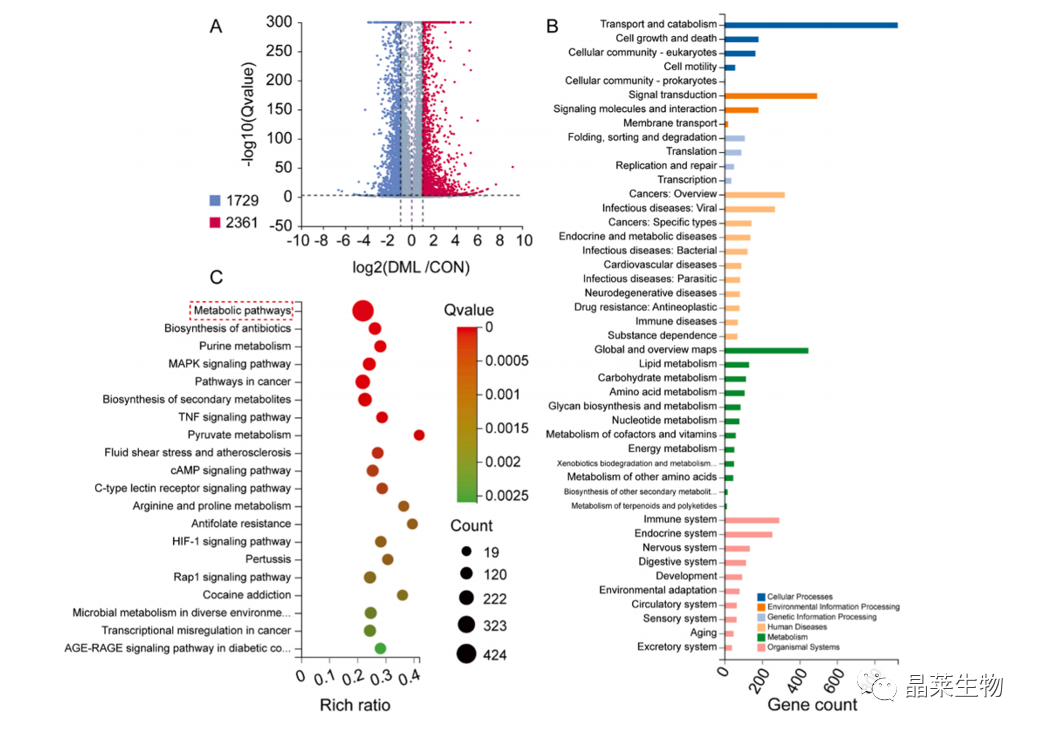
(A) 在火山图中显示了显著差异表达的基因,筛选出上调基因1729个,下调2361个。
(B) 对经DML(5 μM)处理的M3-LCSCs进行GO注释。
(C) KEGG途径富集分析参与经DML处理的M3-LCSCs代谢途径的重要途径。
3.2 GC-MS代谢组学分析,糖酵解/糖异生代谢途径发生变化
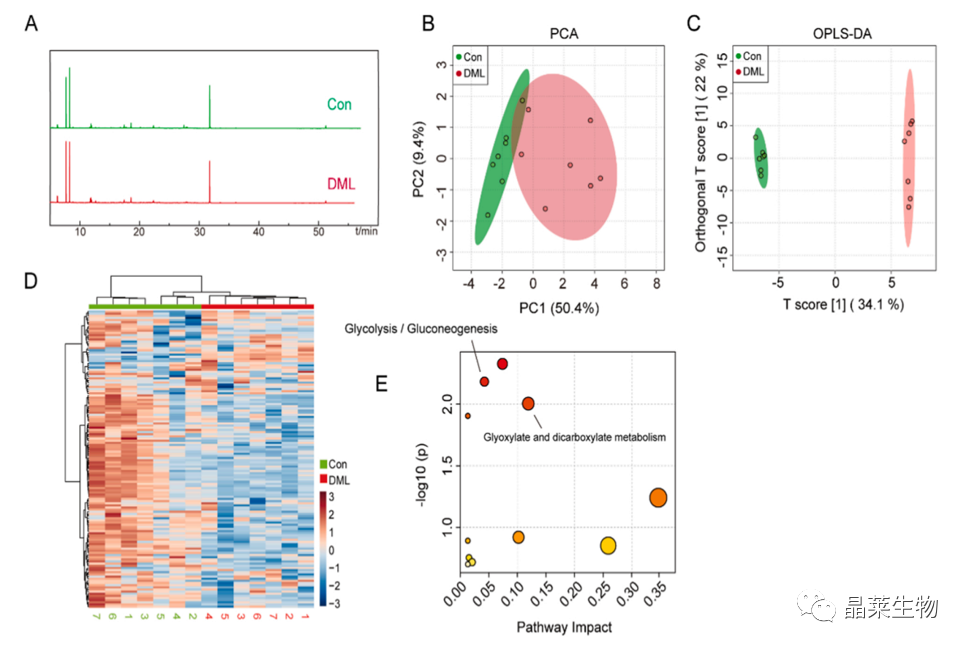
(A) 对照组与药物组(5 μM DML)代谢物的基峰色谱。
(B) PCA评分图,代表各组中的样本彼此紧密聚类。
(C) OPLS-DA评分图显示了训练集中样本的聚类。
(D) 代谢物热图,增加的代谢物用红色表示。代谢物水平下降以蓝色表示。
(E) 影响通路。圆圈的颜色表示富集的显著性水平,黄色低,红色为高。圆的大小与路径的路径影响值成正比。
4.1 DML干预后,乳酸生成途径抑制
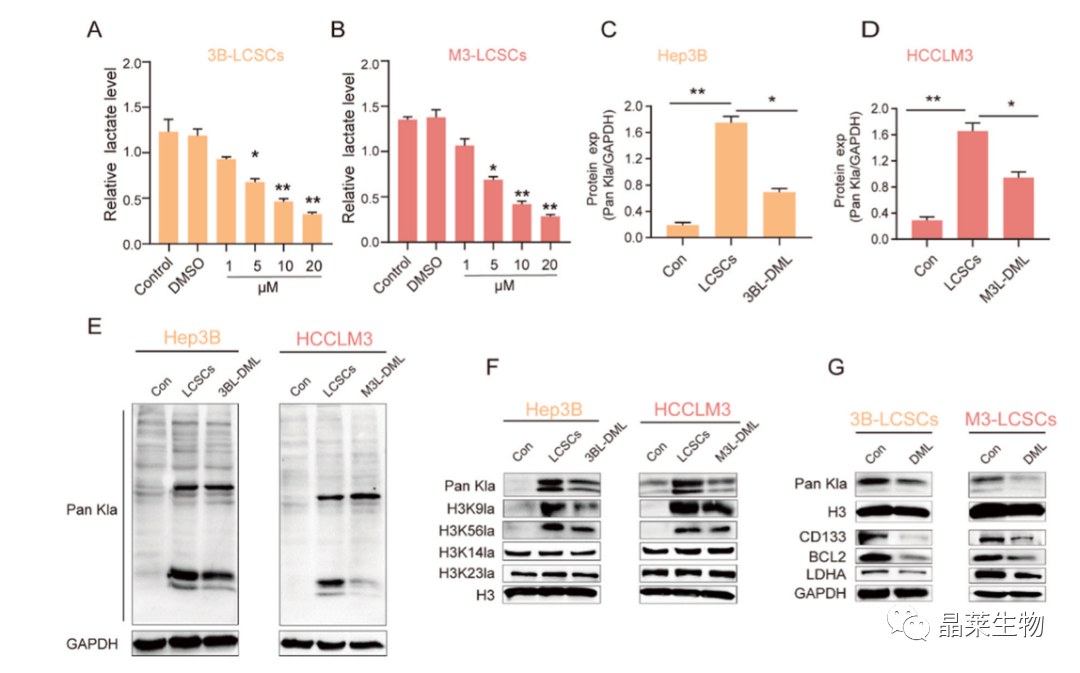
(A,B)用DML处理的3B-LCSCs和M3-LCSCs分别测定细胞内乳酸。
(C,D和E)Pan Kla的蛋白表达。
(F、H和I)H3K9la、H3K14la和H3K23la细胞中的蛋白表达。
4.2 乳酸干预后,细胞乳酸化修饰水平增加,增殖能力增强
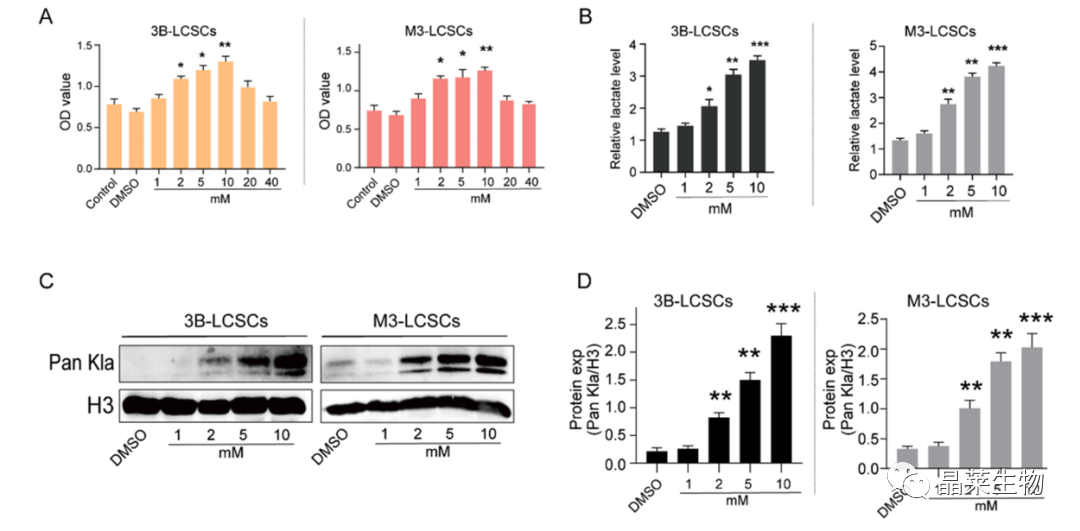
(A) 用CCK8法测定指定浓度下3B-LCSCs和M3-LCSCs的细胞活力(B)细胞内乳酸水平。
(C,D)组蛋白Pan Kla水平的蛋白表达。
4.3 乳酸干预后,细胞迁移能力增强
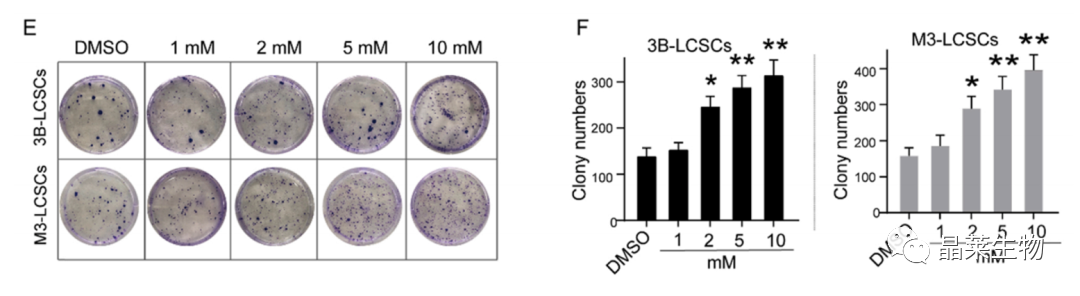
(E,F)在1、5、10和20 mM浓度下处理的3B-LCSCs和M3-LCSCs的克隆形成。
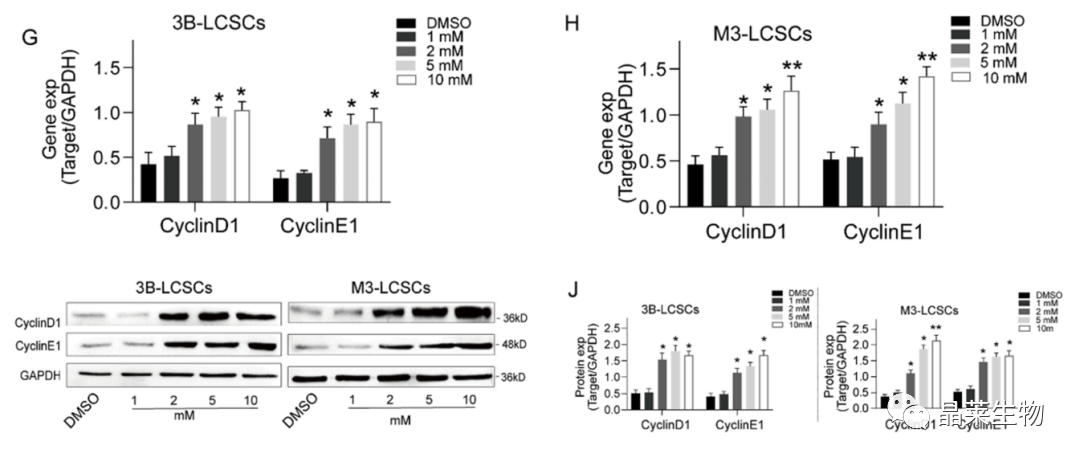
(G,J)细胞周期蛋白的表达
5.1 去甲泽拉木醛体内抑制肿瘤生长

(A)小鼠的肿瘤照片。
(B)小鼠的肿瘤体积。
(C)小鼠的肿瘤重量
5.2 去甲泽拉木醛体内抑制乳酸化修饰、肿瘤细胞增殖
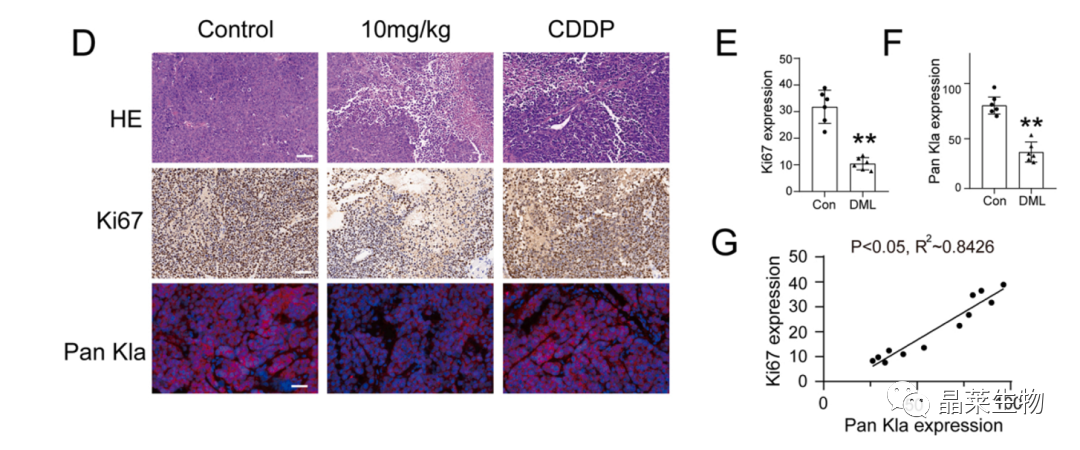
(D) HE,Ki67的IHC和Pan Kla的IF。
(E、F、G)Ki67和KanKla在肿瘤中表达的相关性分析。
文章结论
研究表明,去甲泽拉木醛(DML)在LCSCs中具有抗肿瘤活性,组蛋白乳酸化水平升高促进了肝癌发生、进展,去甲泽拉木醛能降低乳酸表达,进一步抑制组蛋白乳酸化,从而抑制LCSC增殖、迁移,促进LCSCs凋亡。
文献总结
创新点:
首次证明了去甲泽拉木醛(DML)能降低乳酸表达,抑制组蛋白乳酸化,是靶向乳酸调节组蛋白乳酸化来治疗HCC的潜在候选药物。
文献涉及实验技术

关注公众号,了解更多!
