
Matrix metalloproteinase-3 (MMP-3)-mediated genetherapy for glaucoma
基质金属蛋白酶-3 (MMP-3) 介导的青光眼基因治疗

期刊:Sci Adv
发表时间:2023
影响因子:13.6
研究背景
青光眼是仅次于白内障的全球视力丧失的第二大常见原因,以病理性眼压升高引起视神经萎缩和视野缺损为共同特征的眼睛疾病,其对患者最大的威胁就是致盲。目前,全球约有8000万人患有青光眼,预计到2040年将超过1.1亿以上。
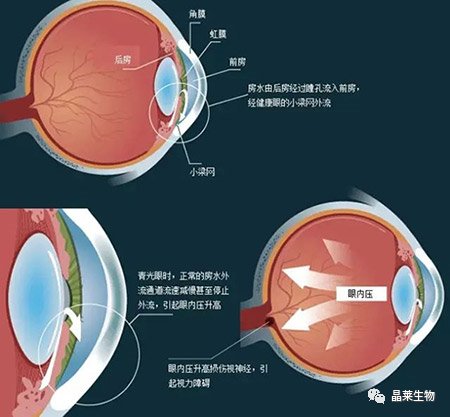
众多的研究发现小梁细胞间存在着丰富的细胞外基质,其不仅对细胞起支持作用,而且具有维持正常房水流出的功能。小梁网中细胞外基质的异常堆积是原发性开角型青光眼的病因之一。

基质金属蛋白酶(MMPs),1962年首先被确定为一种胶原蛋白水解酶,在蝌蚪尾巴的吸收过程中导致ECM蛋白降解,可降解ECM的各种蛋白质组分。研究显示,青光眼患者房水中MMP活性显著降低。
在许多类型的MMPs中,MMP-3具有广泛的蛋白水解靶点,包括IV型胶原蛋白、纤维连接蛋白、层粘连蛋白、弹性蛋白和蛋白多糖,所有这些都存在于流出组织中。此外,MMP-3还可以激活其他MMPs,包括MMP-1和MMP-9,进一步分解ECM。
基因治疗 (gene therapy)的概念起源于20世纪70年代初,是指将外源正常基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,从根本上解决传统疗法存在的一系列问题。腺相关病毒载体(Adeno-associated virus,AAV)由于其独特优势:非整合性、宿主细胞范围广、扩散能力强、表达稳定及组织靶向性,广泛应用于基因治疗中。

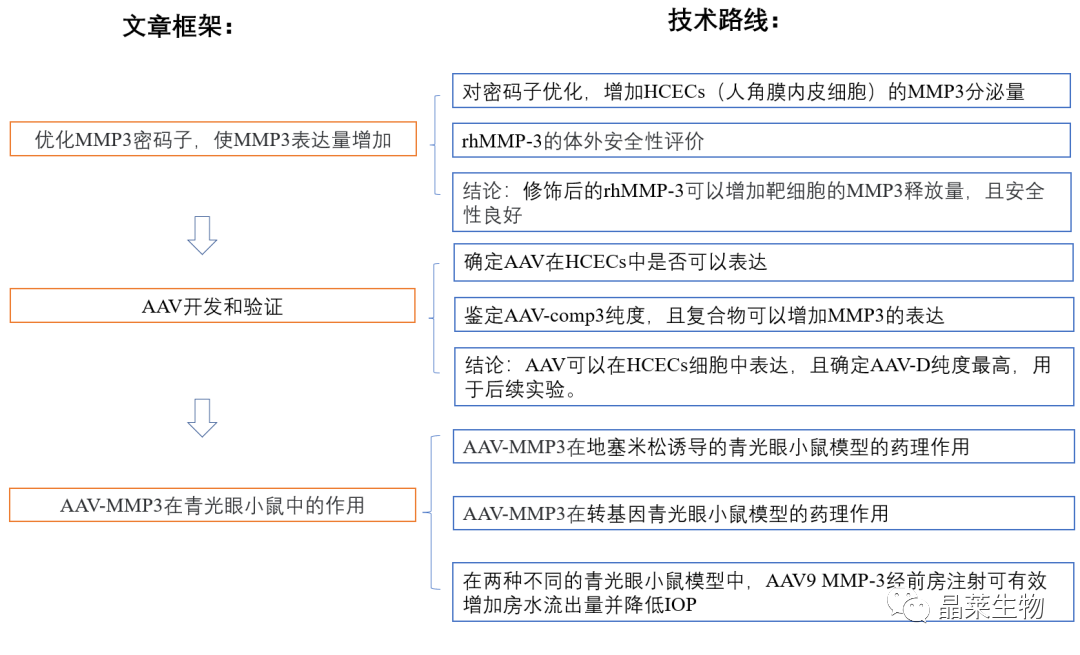
文章框架&技术路线
研究结果及分析
1. 密码子优化可提高MMP-3的表达水平
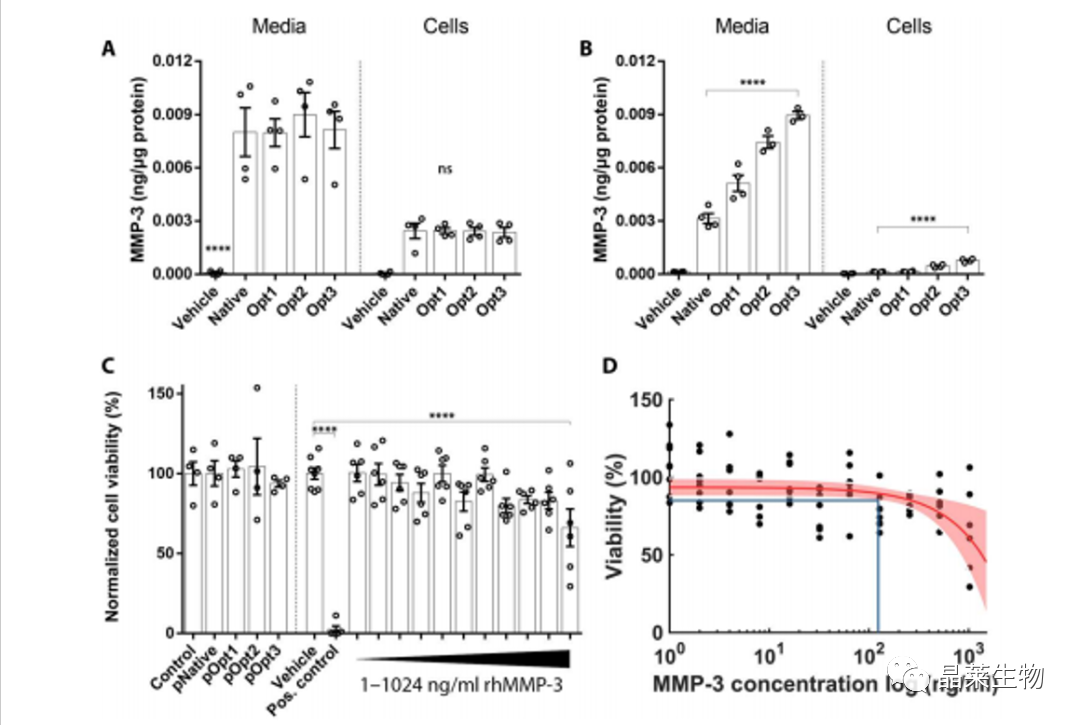
(A) HEK293(人胚胎肾细胞)细胞和(B) HCECs(人角膜内皮细胞)转染 rhMMP-3的表达水平。
(C)转染 rhMMP-3的对细胞活力的影响。
(D) rhMMP-3浓度高达130 ng/ml时,HCEC的平均存活率预计为85%。
2. 1 AAV开发和验证
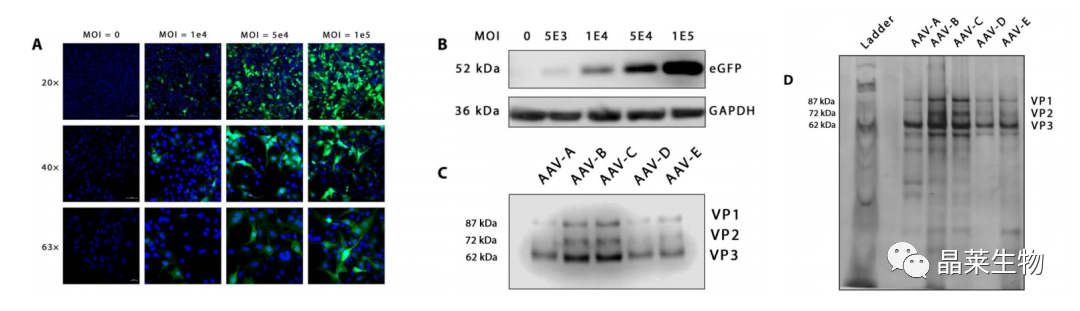
A、B免疫荧光,WB确定AAV在HCECs中可以表达。
C制备不同批次AAV - comp3,转染后检测AAV表达。
D银染色剂鉴定AAV-comp3纯度,AAV-D纯度最高,用于后续实验。
2. 2 AAV - comp3提高体内外MMP-3水平
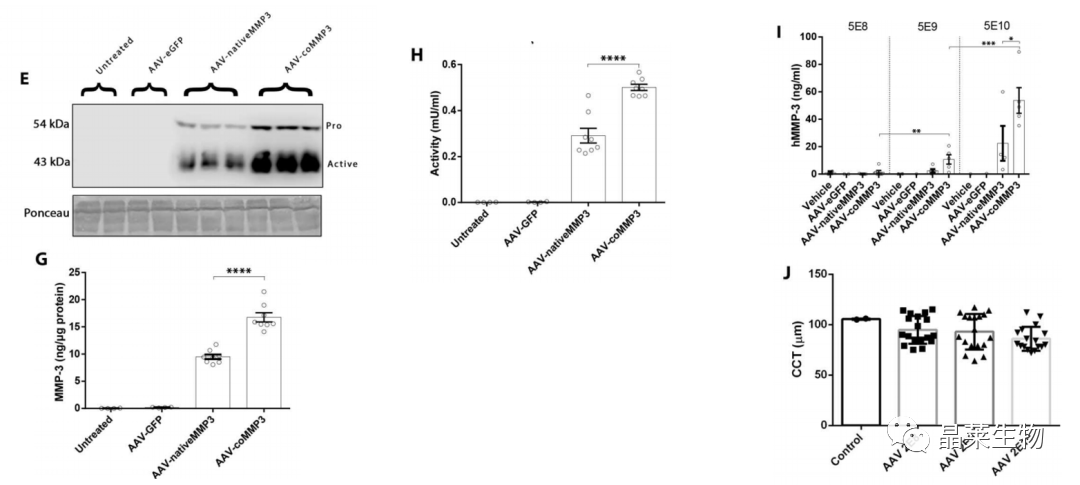
E、G: HCECs中MMP3的表达
H: 活力测定
I: 腹腔注射AAV后,小鼠房水中MMP3的表达
J: 角膜中央后度检测无差异
3. AAV在小鼠体内药效验证
地塞米松小鼠模型
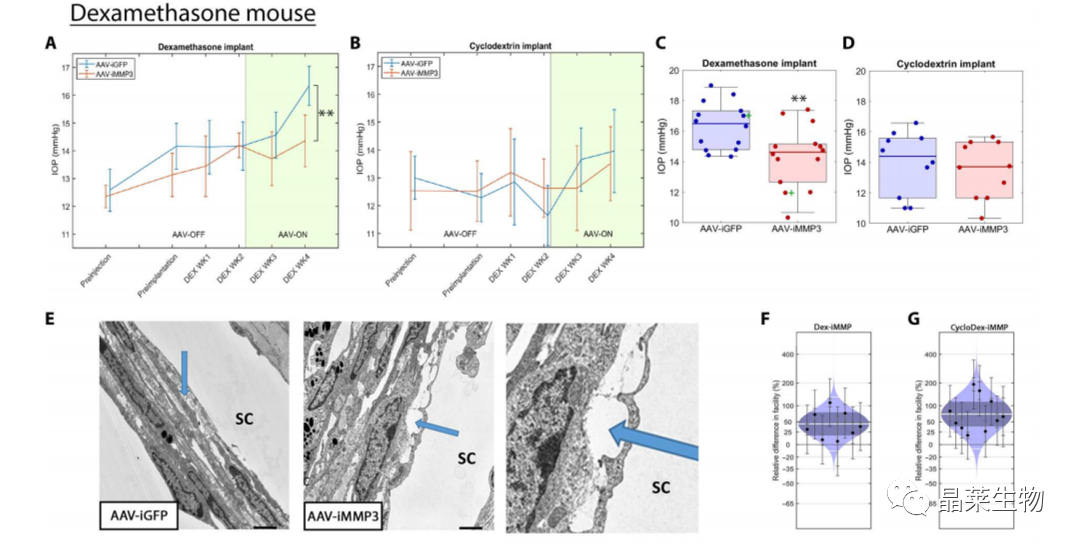
AAV有效降低地塞米松青光眼小鼠模型眼内压,减少眼旁组织和内皮下区域的细胞外基质。
转基因小鼠模型
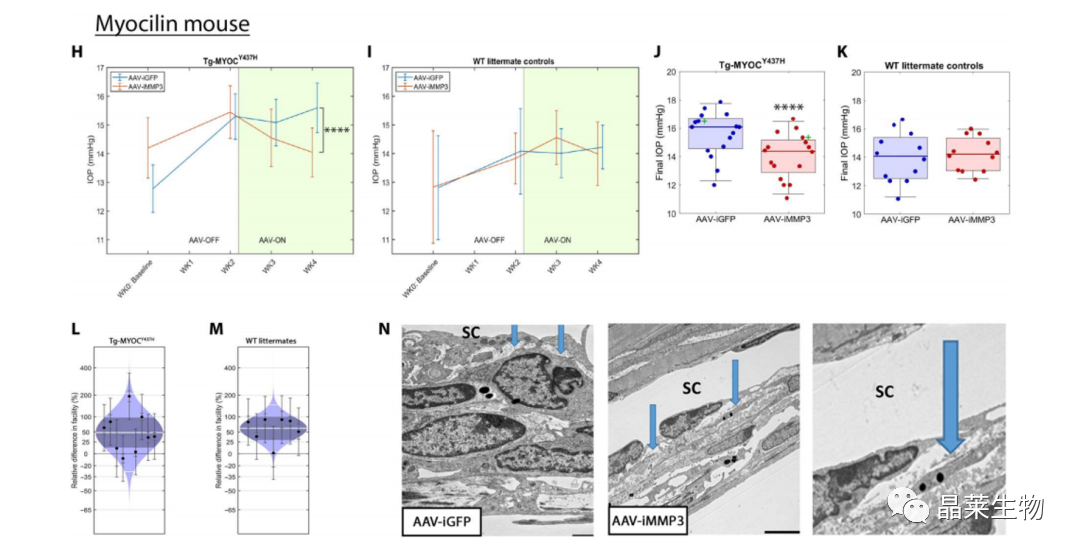
在两种不同的青光眼小鼠模型中,AAV9 MMP-3经前房注射可有效增加眼内液/房水流出量并降低IOP(intraocular pressure ,眼内压)。
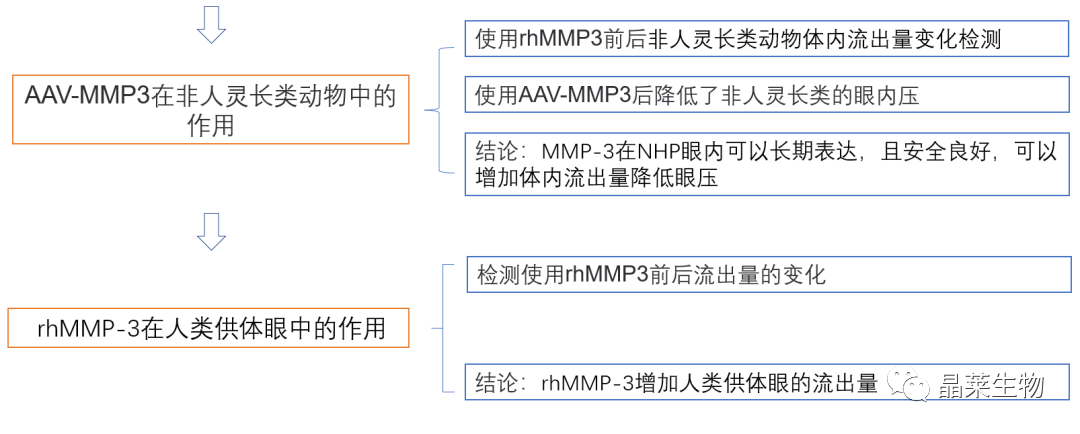
4. 非人灵长类动物体内流出设施测量
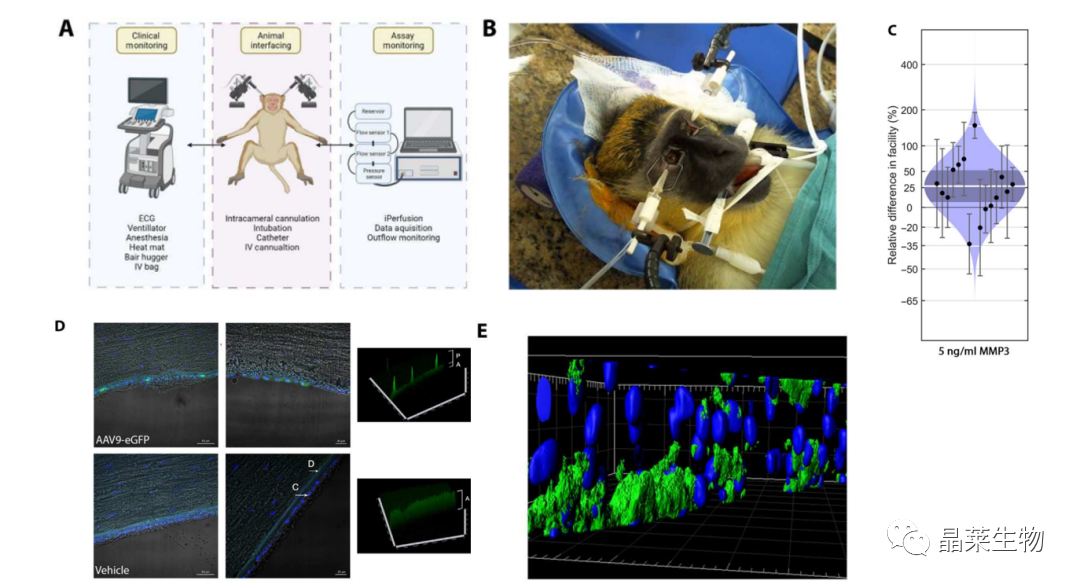
(A)(B)实验装置示意图。
(C)单眼经眼内滴注rhMMP-3 (5 ng/ml) 1小时后,流出设施平均增加27%。
(D)向NHPs注射表达eGFP的AAV9。64天后,取眼球,免疫组化检测GFP表达(角膜内皮细胞有表达,其他组织不表达)。
(E)通过角膜内皮的z-stack的3D渲染。蓝色=细胞核,绿色=绿色荧光蛋白。发现绿色荧光蛋白仅局限于角膜内皮。
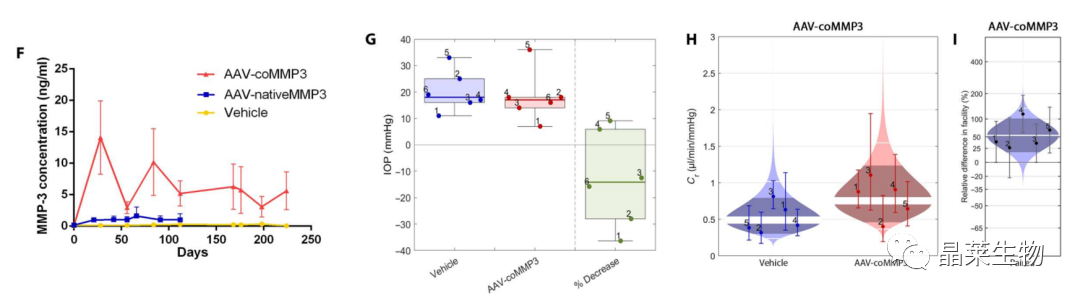
(F) ELISA法测定注射aav后NHP眼房水中MMP-3浓度随时间的变化。
(G) 7个月时灌注前眼压测定。IOP平均降低了13%。
(H)处理组流出量比较。
(I)每只动物眼睛之间流出量的比较。
5. rhMMP-3增加人类供体眼的流出量
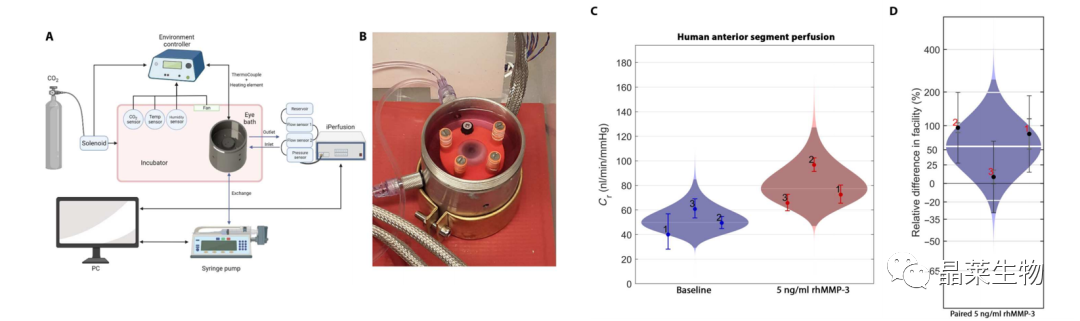
(A)(B)测量人体房水流出量的设备示意图。
(C)在测量前,稳定的流量(蓝色)。将培养基与含有rhMMP-3 (5 ng/ml)的新鲜培养基交换,1小时后再次测量(红色)。
(D)同一眼MMP-3治疗前后的配对百分比差异,治疗后流出量增加56%。
MMP-3的表达增加了供体人眼的眼内液/房水流出。
文献结论
腺相关病毒9 (AAV9)介导的基质金属蛋白酶3 (MMP-3)的表达可以增加两种小鼠青光眼模型和非人灵长类动物及供体人眼的流出量,且长期的AAV9转导角膜内皮是安全且耐受性良好的。
文献总结
创新点:
MMP-3的表达增加了供体人眼的眼内液/房水流出,证明了这种方法在治疗开角型青光眼的临床转化方面的前景。
文献涉及实验技术

关于晶莱
关注公众号,了解更多!
