
肝脏是人体的重要器官,行使着药物解毒、重要蛋白质合成和胆汁代谢等功能在内的多种生理功能。肝细胞是组成肝脏的重要细胞,而由于药物毒性、病毒感染和酒精代谢等因素带来的肝细胞损伤可能会影响整个肝脏的正常功能,从而影响机体的健康。
而对于肝脏疾病的研究以及相应药物的开发大多需要使用原代肝细胞:如一些对于乙肝病毒的研究需要对肝细胞进行体外培养;一些严重肝脏疾病的细胞移植治疗也要涉及到对原代肝细胞进行大量扩增。
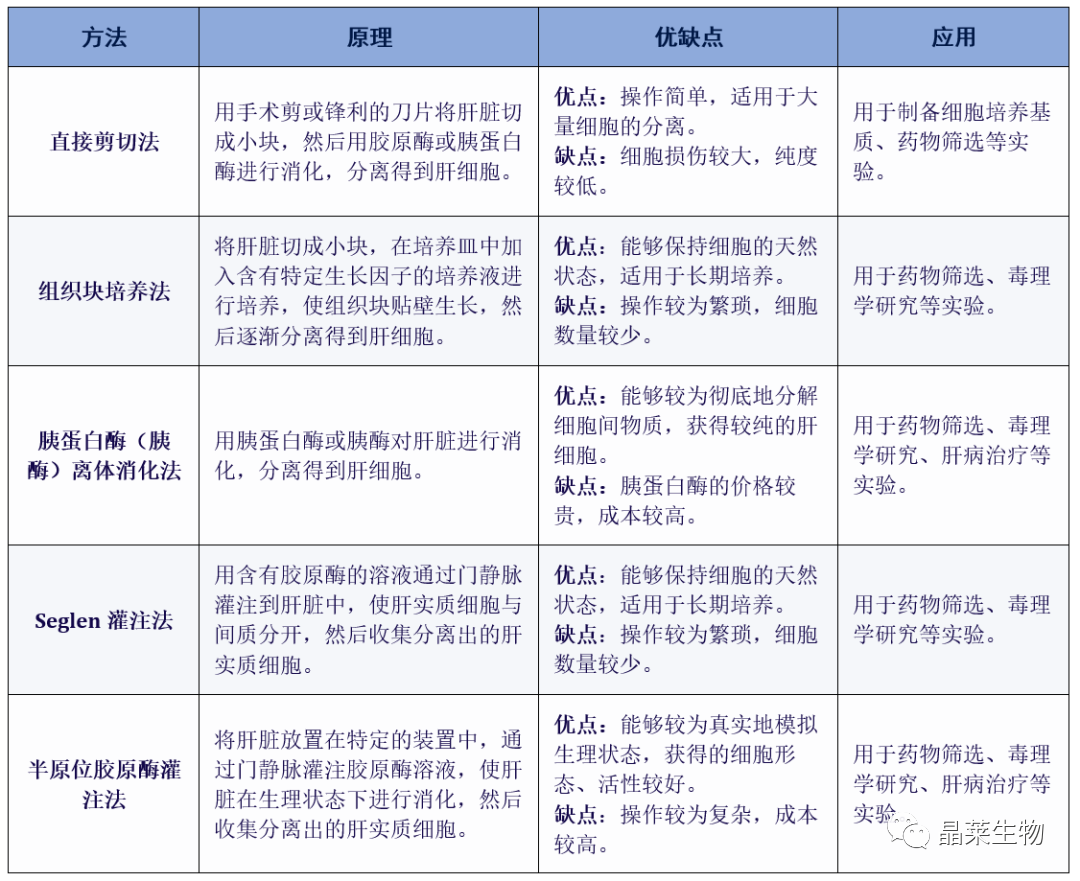
原代肝细胞的分离提取方法有直接剪切法、组织块培养法、胰蛋白酶(胰酶)离体消化法、Seglen灌注法、半原位胶原酶灌注法等。
1. 实验材料
① 动物:健康的6-8周龄雄性C57BL/6小鼠
② 实验试剂:DMEM、胎牛血清
③ 实验器械:饭盒、纱布、剪子、镊子、烧杯、平皿、研磨玻片、滤网、离心、6孔培养板、吸管、移液管、手套、微量加样器。
2. 实验内容
2.1 实验前准备
①Medium:DMEM(10%FBS以及无血清的)。
②用鼠尾Ⅰ型胶原蛋白将细胞接种所需的孔板进行包被,乙酸溶液(0.006mol/L):17.3μL乙酸+50mL无菌水,0.22μm过滤除菌,鼠尾Ⅰ型胶原蛋白(0.012mg/mL):120μL鼠尾胶原蛋白(5mg/mL)+50mL乙酸溶液(6孔板鼠尾Ⅰ型胶原蛋白液体量:1580uL,100mm培养皿鼠尾Ⅰ型胶原蛋白液体量:9170μL)确保胶原蛋白溶液铺满器皿的表面,开盖在超净工作台过夜晾干,也可以室温放置1h后,用PBS洗3-4次后直接使用。包被好的器皿放4℃可以保存3个月以上时间。
③10×PBS、Percoll:实验正式开始前配置1×PB和1×EB。
④在200mL1×EB中,加20mgⅠ型胶原酶,40μLCaCl2(2.5M)。
⑤实验正式开始前用75%酒精清洗灌流器5~10min,最后用无菌水清洗10min。
2.2 小鼠肝原代细胞提取
① 麻醉小鼠,用0.6%戊巴比妥钠,20g小鼠对应注射100μL。
② 用手术剪小心剪开小鼠腹部,暴露门静脉和下腔静脉,留置针插入下腔静脉,采用止血夹固定留置针,拔出钢针,留下灌流针的外套塑料针,连接输液器,再剪开肝门静脉,最后打开灌流器开始灌流,PB大概灌流120-150mL之后换为EB,大概灌流100mL
③ 小心剪下整个肝组织用无菌的PBS清洗一下实验正式开始前配置1×PB和1×EB。
④ 以下步骤在冰上操作,且液体用凉的,将肝组织转移到含无血清的DMEM培养基的培养皿中,将肝组织表面的膜撕开,轻轻吹散,过100目滤网到50mL离心管中离心50xg,1min,去上清液。
⑤ 加入无血清培养基至总体积5mL,转移到15mL离心管中0.48mL10×PBS+4.32mLpercoll混匀,转移到15mL离心管中与上述细胞液混匀离心,50xg,10min,弃上清及表面的悬浮物,下层沉淀即为活着的原代肝实质细胞。
⑥ 加入DMEM完全培养基(10%FBS+1%P/S),小心吹散细胞,细胞计数,接种包被好的6孔板,5×105cell/孔,在恒温培养箱中以37℃、5%CO2以及饱和湿度条件下培养,每2~3d换液一次,4h后换新鲜的培养基DMEM+10%FBS+1%P/S。
3. 实验结果
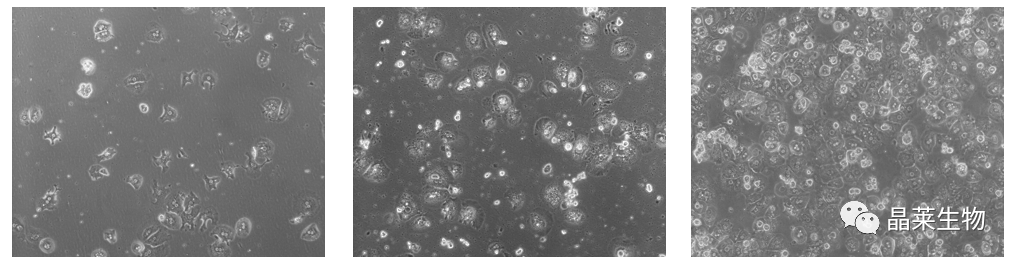
4. 结果分析
① 细胞计数:台盼蓝染色后显微镜下进行细胞计数。细胞折射率较强的圆形细胞为肝实质细胞,被染为蓝色的细胞为死细胞。计算细胞存活率(活细胞数/细胞总数×100%)。
② 肝细胞鉴定:通过糖原 PAS 染色法及免疫荧光细胞化学染色鉴定肝细胞。
③ 细胞活性:采用MTT法检测细胞活性。
1. 自取材开始,保持所有组织细胞处于无菌条件。
2. 在超净台中,组织细胞、培养液等不能暴露过久,以免溶液蒸发。
3. 凡在超净台外操作的步骤,各器皿需用盖子或橡皮塞盖住,以防止细菌落入。
4. 点燃酒精灯,操作在火焰附近进行,耐热物品要经常在火焰上烧灼。金属器械烧灼时间不能太长,以免退火,且冷却后才能夹取组织。吸取过营养液的用具不能再烧灼,以免烧焦形成碳膜。
5. 操作动作要准确敏捷,但又不能太快,以防空气流动,增加污染机会。
6. 瓶子开口后要尽量保持45°斜位。
7. 不管使用何种蛋白酶,在灌注过程中,均需控制灌注用量及时间,避免消化不充分或消化过度,从而保持高活性和高产率。
关于晶莱
关注公众号,了解更多!
