
肿瘤发生是一个复杂的动态过程,包括起始、进展和转移三个阶段。肿瘤被细胞外基质(extracellular matrix, ECM)和间质细胞所包围,肿瘤微环境(tumor microenvironment, TME)的生理状态与肿瘤发生的每一步都密切相关。有证据表明,TME的重要组成部分是成纤维细胞和肌成纤维细胞、神经内分泌细胞、脂肪细胞、免疫和炎症细胞、血液和淋巴血管网络以及ECM。
肿瘤微环境主要特征
目前人们普遍认为,肿瘤微环境受到肿瘤的十个主要特征的广泛影响。癌症患者治愈率低、预后差与癌症的这十大特征密切相关。这十个特征使癌症在复杂的肿瘤微环境中变得更加神秘。
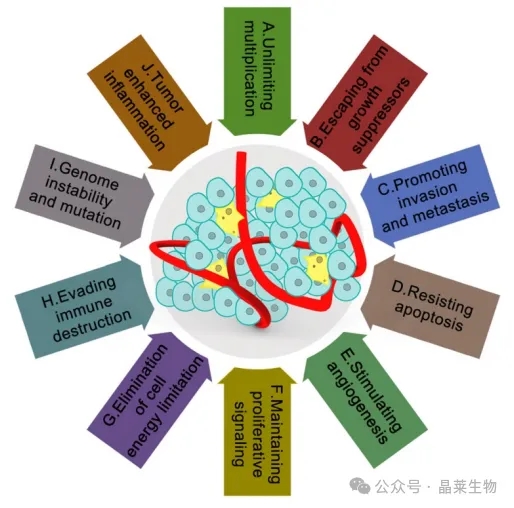
A.无限增殖; B.逃离生长抑制因子;
C.促进侵袭和转移; D.抗细胞凋亡;
E.刺激血管生成; F.维持增殖信号;
G.消除细胞能量限制; H.逃避免疫破坏;
I.基因组不稳定和突变; J.肿瘤增强炎症。
癌细胞和肿瘤微环境的非活性网络
CAF 通过重塑 ECM、诱导血管生成、募集炎症细胞以及通过分泌生长因子、免疫抑制细胞因子和间充质-上皮细胞相互作用直接刺激癌细胞增殖,对癌症进展产生显着影响。
① CAFs中的半乳糖凝集素-1过表达促进了相邻癌细胞的发展并且与几种癌症的不良预后相关,包括乳腺癌和前列腺癌以及喉癌。
② 趋化因子(C-X-C 基序)配体 12 (CXCL12) 在 CAF 中猛烈表达,可诱导癌细胞的上皮-间充质转化 (EMT),以促进胃癌和前列腺癌的癌症进展。
③ 白细胞介素-22 (IL-22) 也由 CAF 表达,通过 STAT3 和 ERK 信号转导促进胃癌细胞侵袭。
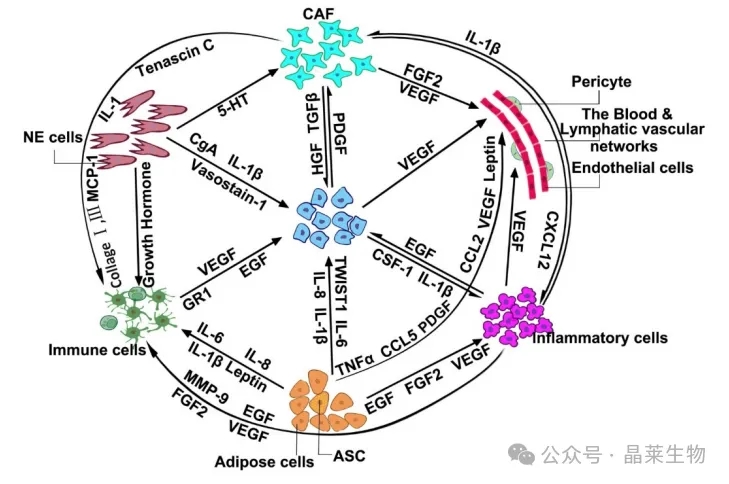
CAF在癌症治疗中以两种主要方式起作用。
一种方法是直接将CAF逆转到正常成纤维细胞中或抑制其生长。该方法强调,重构miRNA表达等努力已被证明可以使CAF失活并抑制宫颈癌发生小鼠模型中的PDGF信号传导;它还可以减少肿瘤增殖。
另一种方法是将 CAF 去分化为静止状态。一组数据显示,维生素 D 受体 (VDR) 配体促进卫星细胞的去分化并消除纤维化。使用结肠癌的小鼠异种移植模型,最近的另一项研究发现,当靶向成纤维细胞活化蛋白 (FAP) 时,CAF 的积累显着减少。FAP有望成为CAF靶向治疗的另一个标志。
不同细胞在肿瘤微环境中的作用
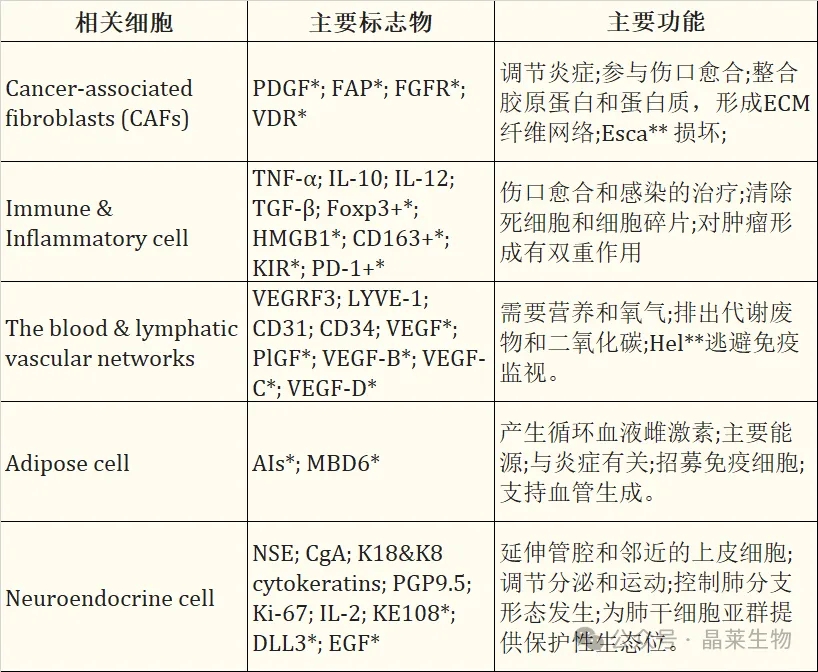
肿瘤微环境中的不同细胞的治疗策略建议
1. 治疗策略举例
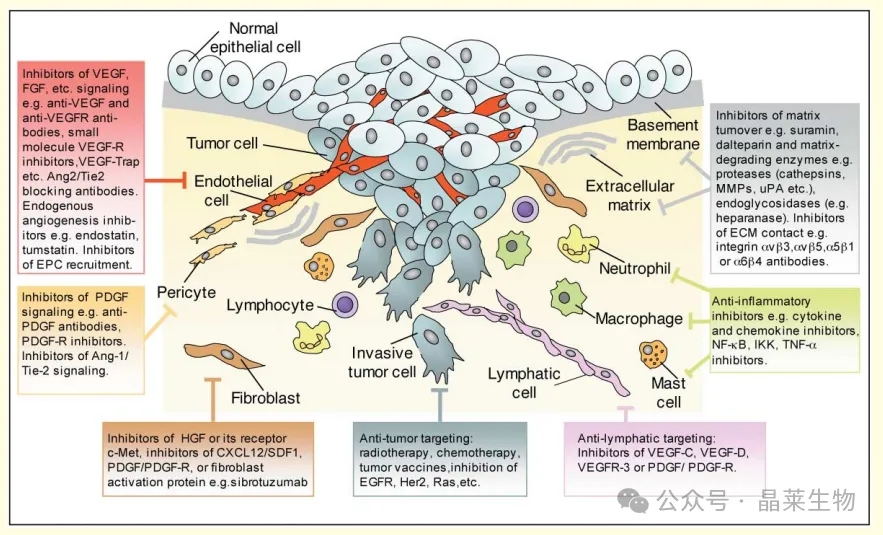
这些策略包括针对肿瘤细胞本身,使用传统疗法,如化疗和放疗(也会杀死正常细胞)和靶向疫苗,或分子方法来抑制癌基因,如Ras、EGFR和Her2。
正常细胞中抑制的靶点包括VEGF/VEGFR家族成员(血管或淋巴内皮细胞)、PDGF/PDGFR家族成员(周细胞和潜在的成纤维细胞和淋巴管)、基质降解酶(主要由炎症细胞产生,BM/ECM成分为底物)和慢性炎症抑制剂。
2. 靶向肿瘤微环境的药物
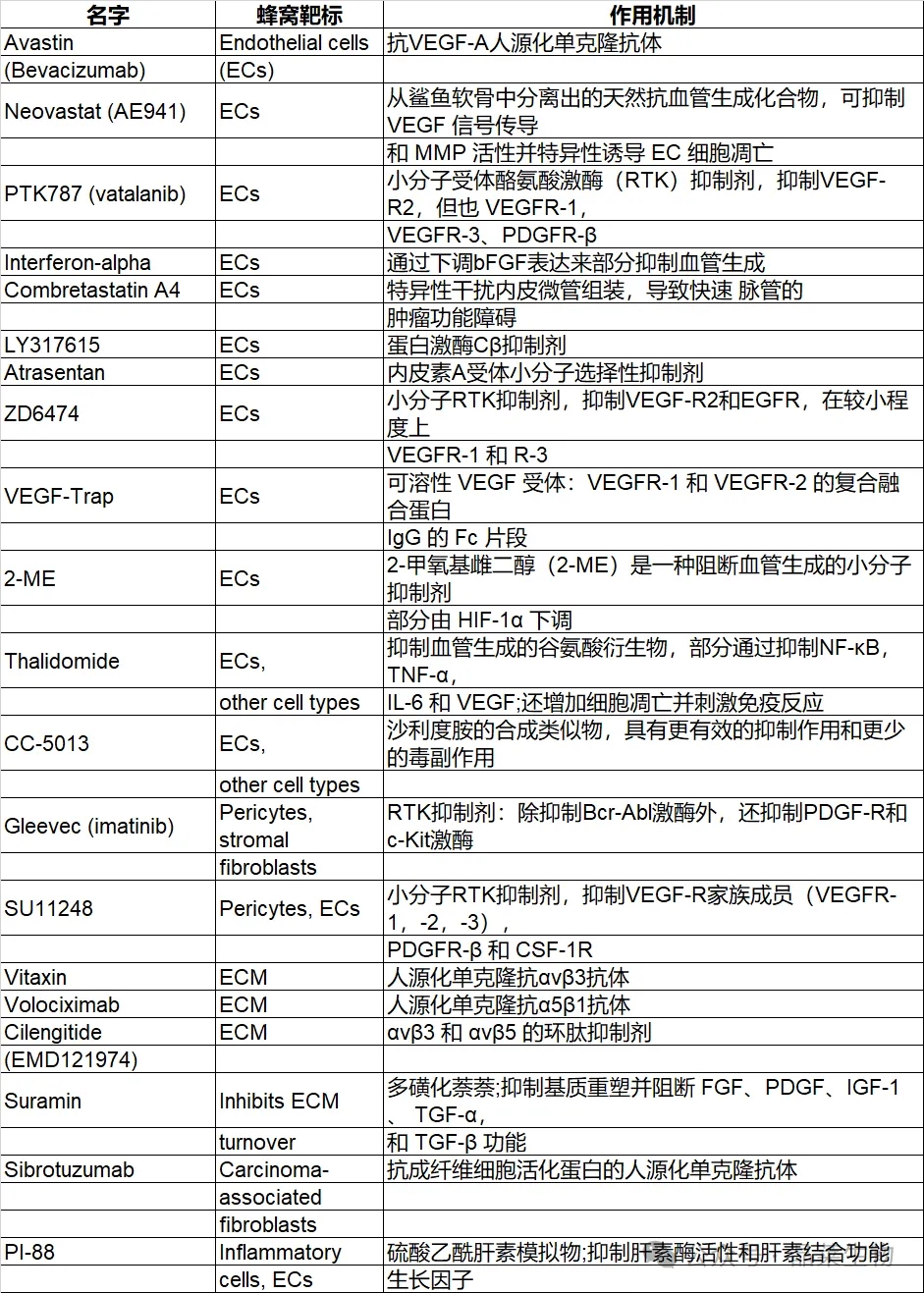
缩写:EC,内皮细胞;VEGF,血管内皮生长因子;bFGF,碱性成纤维细胞生长因子;VEGFR,血管内皮生长因子受体;PDGFR,血小板衍生生长因子受体;EGFR,表皮生长因子受体;HIF-1,缺氧诱导因子;NF-κB,κB核因子;TNF,肿瘤坏死因子;IL-6,白细胞介素6;CSF-1R,集落刺激因子受体;ECM,细胞外基质;IGF胰岛素样生长因子;TGF,转化生长因子。
肿瘤管理策略包括手术治愈或细胞减灭术、放射干预、化疗和生长抑素类似物来控制症状。然而,肿瘤细胞具有极强的弹性,可以迅速适应治疗和环境改变。一旦一个组件被阻塞,其他机制将很快跟进。这可能是导致预后不良的主要因素之一。
了解TME的不同成分在肿瘤治疗和预防中的作用是很重要的。此外,预测性生物标志物的研究可以充分解决生物学的复杂性,将促进针对个体患者的疗法的发展。目前,新兴的靶向微环境疗法已被广泛接受。根据不同组织的特点,靶向多种微环境基质细胞的协同疗法和多种靶标物的不断发现可能是未来研究的方向。
晶莱生物
以上信息来源于文献和网络,如有侵权请联系客服删除。
参考文献:
[1]Therapeutic targeting of the tumor microenvironment .Johanna A. Joyce1,* Cancer Biology and Genetics Program, Memorial Sloan Kettering Cancer Center, New York, New York 10021*Correspondence: joycej@mskcc.org.
[2]Role of tumor microenvironment in tumorigenesis.Maonan Wang1,2, Jingzhou Zhao2, Lishen Zhang2, Fang Wei2, Yu Lian2, Yingfeng Wu2, Zhaojian Gong2, Shanshan Zhang1, Jianda Zhou3, Ke Cao3, Xiayu Li3, Wei Xiong1,2,3, Guiyuan Li1,2,3, Zhaoyang Zeng1,2,3,Can Guo1,2,3.Journal of Cancer2017; 8(5): 761-773. doi: 10.7150/jca.17648.
关于晶莱
关注公众号,了解更多!
