
在往期推文中,我们分享了“实验动物不同脏器取材方法及病理/电镜组织取材注意事项”,讲述常用实验动物各脏器取材部位和大小的标准。
本期我们一起来学习样本采集注意事项及动物血液样本采集基础知识。
样本采集
样本采集是许多动物实验操作中必需的步骤,这些步骤的实施并没有固定不变的规则,只有一般原则。根据实验要求操作是样本采集的大前提,在此前提之下,各类样本要遵循的一般原则如下:
1. 在采集无污染样本时
① 手术器械常规消毒。
② 采集非体表标本时,注意剥皮,避免皮肤给样本带来污染。无须仿临床样本采集操作,无须备皮和体表消毒。
③ 在确定样本采集顺序时,注意取胃肠样本,避免消化道食物对样本的污染。
2. 在采集生物活性样本时
① 实验动物处死后,心脏功能能维持一段时间,应在此期间迅速采集样本。
② 样本采集后应迅速进行下一步处理,如冷冻、固定等。
3. 在采集病理样本时
① 石蜡包埋标本要求形态完好。
a. 血管采集前,用肝素生理盐水冲洗循环系统,可避免血栓堵塞血管。
b. 血管内灌注福尔马林等固定液时,要保持生理血管内压,以保证血管正常形态。组织固定容器要选择大的,避免组织相互挤压,固定液的量要求是组织体积的5倍以上。
c. 取出肺后,要马上排除肺内气体,彻底置换肺内液体。
② 冰冻样本要求快速处理,严格控制冷冻温度。
4. 在采集血液样本时
① 选择合适的采血方式(小量单次/多次采血 大量采血)。
② 选择合适的采血管(不同的实验选择不同的抗凝剂/促凝剂)。
③ 样品的保存和测试时间点(如血常规需要现取现测/血气/血脂/......)。
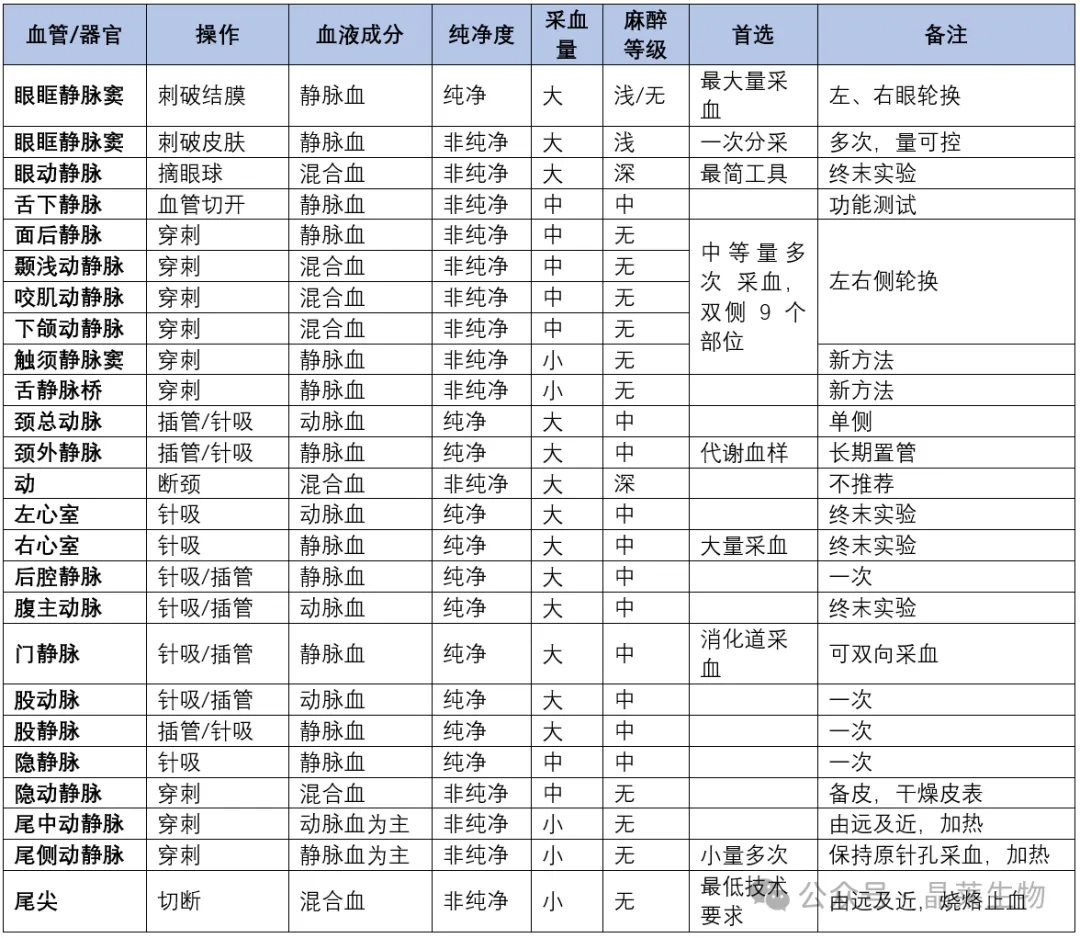
常见动物采血方法的优缺点
1. 穿过皮肤刺破血管采血的方法虽简单快速,但是不能确保采集动脉血或静脉血,而且刺破皮肤后,血液流出易被皮肤、体毛等污染,成为不干净的血样。这种方法的采血部位包括大多数面部血管、隐动静脉、尾中动静脉、尾侧动静脉等处。
2. 令血液外流的采血方法,技术要求低,采血量大,但是无法保证血样的洁净。如摘眼球采血。
3. 针吸采血,可以保证血样洁净,但是技术要求高。如在心脏、后腔静脉、腹主动脉、颈外静脉、颈总动脉等处的采血。
4. 血管内置导管的方法,虽然操作烦琐,但血样的质量可以得到保证。尤其是需要在多个时间点采血时,其血样损伤极小。例如,代谢笼内电脑控制的颈外静脉置管采血。
5. 切断组织器官采血,例如,断尾、断颈等,方法最为简单,但血样成分最为复杂,其中包括动脉血和静脉血,还掺杂了淋巴液或其他可能的体液。
常见采血方法特点对比
小鼠采血原则
1. 表浅血管穿刺采血,只限于非纯净血样。
2. 心脏和大动脉采血用于终末实验。
3. 非终末实验,尽量减小采血造成的机体损伤。
4. 多次采血,小鼠需要身体恢复时间。有些血管可行两侧轮换采血,限制每次采血量,最大安全采血量0.2 (ml)最小致死采血量0.3 (ml)。
5. 残酷采血必须深麻醉,例如断颈、摘眼球。这些残酷方法除了操作简单、采血量大以外,没有其他特殊长处,不推荐采用。
6. 需要最大量采血,要争取延长小鼠心脏有效工作时间,使更多血液进入外周循环同时防止凝血。
7. 若使用抗凝剂,需第一时间让血液接触抗凝剂。
8. 功能采血,要选择特殊的采血方式,例如,测试出凝血功能,必须避免和减小损伤血管内皮。
9. 普通采血操作力争简洁,避免溶血:
10. 需要麻醉的采血,首选异氟烷吸入麻醉,便于随时调整麻醉深度,最大限度减小麻醉药物对于血样的影响。
下一期我们展开来讲讲“不同动物部位采血具体的实验操作细节”,如果你有想了解的动物采血实验操作可以留言或者联系客服获取更多信息!
晶莱生物
以上部分信息来源于文献和网络,如有侵权请联系客服删除。
关于晶莱
关注公众号,了解更多!
