

线粒体自噬是一种选择性自噬过程,对细胞稳态至关重要,可消除功能失调的线粒体。涉及膜内的分离、密封和通过细胞器的溶酶体途径降解。然而,大多数亚细胞结构,不仅仅是线粒体,都是选择性自噬的靶标,包括高尔基体、内质网 (ER)、过氧化物酶体、核糖体、中间体、脂滴和糖原颗粒。
它由内膜去极化激活,在发育过程中起着重要作用,在高度依赖有氧代谢的高度分化的有丝分裂后细胞(如神经元、肌肉细胞和肝细胞)中至关重要。
有缺陷和过度的线粒体自噬都会导致与年龄相关的神经退行性疾病,例如帕金森氏症和阿尔茨海默氏症、代谢疾病、糖尿病血管并发症、心肌损伤、肌肉萎缩症和肝病等。
线粒体自噬调控途径
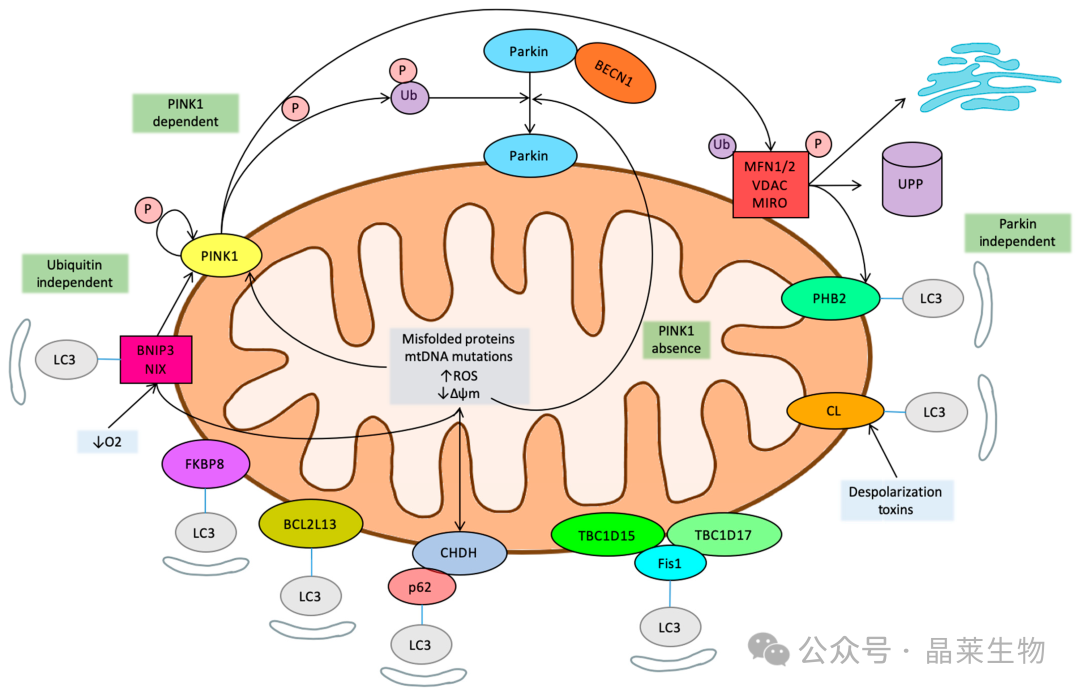
目前认为有三种类型的线粒体自噬:1型由营养限制诱导,2型由损伤信号诱导,3型微线粒体自噬,与小线粒体衍生囊泡有关。
这些过程本质上是不同的,因为 1 型和 2 型需要溶酶体融合才能产生围绕线粒体的自噬体,而后一种类型则不需要。
线粒体自噬在正常发育中起着相关作用,一些组织(如神经系统、肾脏、骨骼肌、心脏和肝脏)表现出较高的基础线粒体自噬活性,而其他组织(如脾脏和胸腺)则表现出较低的线粒体自噬水平。
线粒体自噬所涉及的分子和生化途径首先在衰老、神经退行性和精神疾病、癌症和心血管疾病(CVD)的模型中得到表征。
新的调控途径
① LC3 非依赖性线粒体自噬的生理相关性。线粒体自噬可以通过形成涉及Rab9、Unc-51样激酶1(ULK1)和Drp1的蛋白质复合物来驱动Rab9相关的自噬体。
② 几种连接酶可以调节线粒体自噬,例如SMAD特异性E3(SMURF1),而自噬蛋白卷曲螺旋肌球蛋白样BCL2相互作用蛋白(BECN1)/Beclin 1在自噬体形成和成熟中起着核心作用,已被证明与Parkin相互作用,不需要其易位到线粒体。
异常的线粒体自噬与几种神经退行性、心血管、代谢和骨骼肌疾病的发病机制有关,而靶向分子(如尿石素A和放线菌素)的有益作用已在老年小鼠、阿尔茨海默病小鼠模型以及其他神经退行性疾病和心血管疾病的临床前啮齿动物模型中报道。
线粒体数量和活性的改变已在多种神经精神和神经退行性疾病中被发现。然而,在大多数情况下,对病因和对疾病发展的影响的充分评估仍然模糊不清。一般来说,受损线粒体的积累表明线粒体自噬过程可能失调。迄今为止的证据支持这一一般概念,尽管观察到的变化如何影响疾病发展尚未完全阐明,并且似乎在很大程度上取决于特定的病理背景。有研究表明,与心血管疾病相反,神经退行性疾病中线粒体自噬的上调对神经元的健康可能是有益的,甚至可能是必不可少的。
神经退行性和神经精神疾病中的异常线粒体自噬
① 非酒精性脂肪性肝病
非酒精性脂肪性肝病(NAFLD)是与代谢综合征相关的特征性肝病。
在NAFLD中,线粒体自噬受到显著抑制,因为已经观察到线粒体自噬中间体的积累、AMPK活性降低和线粒体自噬抑制剂水平升高,如巨噬细胞刺激1(Mst1)或酰基辅酶A:溶索心磷脂酰基转移酶-1(ALCAT1)。Mst1 是一种与肝脏再生相关的细胞存活调节因子,已被发现在高脂肪饮食介导的脂肪肝疾病中上调。增加的 Mst1 阻断 AMPK 通路,从而减少 Parkin 表达,抑制与 Parkin 蛋白相关的线粒体自噬通路。反过来,AMPK的药理学激活可恢复NAFLD的线粒体自噬。
另一种被认为参与NAFLD线粒体自噬抑制的机制是由p62-Keap1-Rbx1复合物的形成介导的新的Parkin非依赖性线粒体自噬途径的下调。p62 将 cullin-RING 泛素 E3 连接酶复合物 Keap1 和 Rbx1 的两个亚基募集到线粒体中。然后,p62-Keap1-Rbx1复合物泛素化线粒体并促进线粒体自噬。
② 酒精性肝病
线粒体损伤也由其他肝脏疾病引起。酒精性肝病(ALD)是指酒精过量引起的肝损伤。由于存在受损的线粒体,帕金诱导的线粒体自噬对酒精性肝病起保护作用,防止细胞死亡和组织损伤。在BNIP3和NIX诱导介导的ROS饮酒、线粒体去极化和缺氧下,线粒体自噬被激活。
① Ⅱ型糖尿病
Ⅱ型糖尿病(T2D)的特征是高血糖和胰岛素抵抗(IR)。这些总是与线粒体损伤有关,可能是因为高血糖水平会增强线粒体ROS的产生和氧化应激,从而导致组织损伤。重要的是,线粒体ROS也被证明在IR和T2D中起关键作用。
目前的模型是,糖尿病前期受试者的线粒体自噬增加可能导致功能失调的线粒体消除,从而防止其积累和线粒体氧化应激的进一步加重,而已建立T2D和更高ROS水平的患者可能不仅诱导线粒体损伤增加,还抑制线粒体自噬,从而导致受损线粒体的积累增加.因此,糖尿病前期受试者线粒体自噬的适应性增加可以通过限制线粒体氧化应激和损伤来预防或延缓进展为 T2D,从而支持β细胞功能的保存。
② 肥胖
糖尿病和肥胖密切相关,因为肥胖会增加患 T2D 的风险。因此,它们也显示出线粒体自噬在它们中的作用的相似之处。
线粒体损伤也见于肥胖。在肥胖患者中,骨骼肌中的线粒体含量增加,线粒体生物发生减少,这表明肥胖引起的线粒体含量增加可能是线粒体自噬无法清除的受损和裂变线粒体的积累这些观察结果可能表明,线粒体自噬会因过度脂肪堆积或肥胖而负向调节。
线粒体功能障碍是衰老的标志。在衰老过程中,mtDNA突变和ROS生成增加,ATP产生下降。这些影响会影响衰老和与年龄相关的病理,并且可能至少部分与线粒体自噬有关。
生活方式同样会影响线粒体质量控制系统,例如,身体活跃的男性比久坐不动的男性具有更高的线粒体裂变和线粒体自噬标志物表达,而过度喂养是心血管疾病和肝病等疾病的危险因素,与受损线粒体和氧化应激的积累有关。这可能与AMPK活性降低有关,AMPK是一种蛋白质,通过激活ULK1和PGC-1α来激活线粒体生物发生和线粒体自噬,以应对营养物质可用性低。
在缺氧肿瘤环境中,缺氧诱导因子1亚基α(HIF-1α)激活BNIP3和NIX,由于线粒体自噬通量增加而导致线粒体质量减少,从而促进癌症代谢转换。然而,在几种癌症类型中发现许多线粒体自噬接头突变或沉默,表明线粒体自噬具有肿瘤抑制作用。
PINK1/Parkin或BNIP3的缺失导致线粒体自噬通量减少,并导致受损线粒体的积累,从而产生高水平的ROS,促进HIF-1α的稳定,而肿瘤抑制因子和DNA损伤传感器p53诱导BNIP3并促进线粒体自噬,从而限制代谢重布线。
免疫细胞(M1巨噬细胞、Th1和Th17淋巴细胞、树突状细胞和小胶质细胞)的促炎反应与高水平的厌氧糖酵解有关,而M2巨噬细胞和调节性T细胞严重依赖线粒体OXPHOS代谢线粒体自噬有助于以NIX介导的方式调节M1巨噬细胞极化中向糖酵解的代谢转换。此外,PINK1的缺失会诱导神经胶质细胞中的促炎标志物,表明线粒体自噬在炎症中具有保护作用。
线粒体自噬在所有与代谢控制相关的疾病中的核心相关性现已得到充分确立。由于线粒体自噬是控制代谢稳态或去除受损或不必要的线粒体所必需的,因此它可以防止线粒体功能障碍和随后导致疾病发展的分子事件,例如氧化应激。在患病状态下,线粒体自噬有时可以部分补偿其他缺陷,从而缓解它们,但是当线粒体活性受到损害时,线粒体自噬实际上可以发挥有害作用。这在正常线粒体自噬活性受到遗传或调节事件影响的疾病中尤为明显。这些结果促进了该领域的药理学研究,因为线粒体自噬途径上有几个潜在的可成药靶点。
Mitophagy in Human Diseases.by Laura Doblado,Claudia Lueck,Claudia Rey,Alejandro K. Samhan-Arias,Ignacio Prieto,Ignacio Prieto,Alessandra Stacchiotti,Maria Monsalve, nt. J. Mol. Sci. 2021, 22(8), 3903;
关于晶莱
