

在实验操作中,准确区分小鼠和大鼠的性别至关重要。主要依据以下特征进行判断:
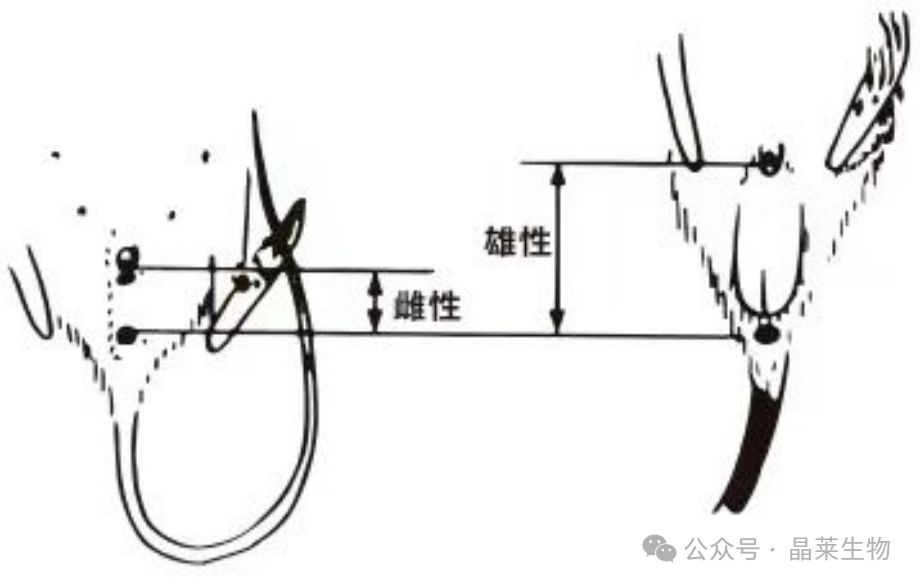
1. 生殖器与肛门的距离:雄性小鼠和大鼠的生殖器与肛门距离较远,而雌性则较近。这一特征在幼龄仔鼠中尤为明显,因为此时它们的外生殖器尚未成熟。
2. 毛发覆盖情况:雄性小鼠和大鼠在生殖器与肛门之间通常有毛发生长,形成一条明显的毛带;而雌性则无毛,呈现一条清晰的纵沟。
3. 乳头的明显程度:雌性小鼠和大鼠的乳头相较于雄性更为突出和明显。
4. 生殖器官特征:雄性阴茎朝向头部方向突出,可通过轻轻挤压包皮使其露出;雌性则可见闭合的阴道口,挤压时亦可张开。
5. 外观差异:在某些情况下,雄鼠可能体型稍大于雌鼠,但这一特征并非绝对,还受到品种、年龄和营养状况等多种因素的影响。
对于新生仔鼠和成年鼠的性别区分,可分别参考以下建议:
① 新生仔鼠:主要依据外生殖器与肛门之间的距离进行判断,距离近者为雌性,远者为雄性。
② 成年鼠:雄性阴囊明显可见;雌性阴道开口清晰,且乳头明显。
为确保实验数据的准确性,对小鼠和大鼠进行编号是必要的。常用的编号方法包括染色法、耳孔法和剪趾法等。
1. 染色法:使用毛笔或棉签蘸取不同颜色的化学药品(如苦味酸或中性红)涂染在小鼠特定部位的毛发上。编号次序遵循九分法原则,即先左后右、由前至后。此方法适用于短期实验,因染料易褪色。
2. 耳孔法:使用专用打孔器在小鼠耳朵上打孔或剪出不同的缺口,通过位置和孔数进行标记。一般右耳表示个位数,左耳表示十位数。对于黑色或棕色小鼠及裸鼠,可采用特殊编号方法。此方法同样适用于短期实验,且需确保编号不对动物生理或实验反应产生影响。
3. 剪趾法:根据对新生小鼠前肢4趾和后肢5趾的切断位置进行编号。应切断一段趾骨以确保编号清晰持久。此方法常用于出生7天内的小鼠,并需在小仔5-7日龄内进行断趾。
正确的抓拿与固定方法是确保实验顺利进行的关键。
1. 小鼠:习惯用右手者,用右手抓住小鼠尾部中部提起,放在鼠笼铁纱网上或粗糙物上。待小鼠向前挣脱时,用左手拇指和食指抓住其颈部皮肤,小指和掌部夹住尾部。空出的右手进行后续实验。习惯用左手者则相反操作。注意避免抓拿尾尖以防断裂。
2. 大鼠:习惯用右手者,戴上防护手套后,用右手抓住大鼠尾巴中部提起,左手按住背部皮肤。可使用手术台固定大鼠四肢。空出的右手进行后续实验。习惯用左手者则相反操作。注意大鼠门齿较长,抓取时应避免被咬伤。
根据实验需求和动物福利原则选择合适的采血方法至关重要。以下以小鼠和大鼠为例介绍几种常用的采血方法:
1. 尾尖采血:将小鼠固定并暴露尾巴,浸泡在温水中或擦拭酒精使血管充盈。用无菌手术刀快速剪去尾尖1-2mm,血液自然流出。此方法简便易行,适用于多次少量采血。
2. 摘眼球采血:抓取小鼠颈部头皮并固定尾巴,轻压眼部皮肤使眼球充血突出。剪去胡须后,用眼科弯镊夹取眼球并快速摘取,使血液流入EP管中。此方法适用于需要大量血液样本的实验。
3. 眼眶静脉丛采血:适用于多次重复采血。无需麻醉,但需注意不能采集到无菌血样。采血后需给予组织修复时间。
4. 心脏采血:将小鼠麻醉后仰卧固定于动物台上,剪去胸前区被毛并消毒皮肤。使用注射器在左侧第3-4肋间心搏动最强处进针刺入心脏获取血液样本。此方法较为复杂且对动物伤害较大。
5. 颈静脉采血:无需麻醉,直接从穿刺点进针采集血液。要求操作者技术娴熟且需确保动物固定良好以避免挣扎。
6. 隐静脉采血:常用于少量血液采集且无需麻醉。剃毛后暴露采血点并用采血针刺入即可获得血液样本。
7. 颌下静脉丛采血:快速、简单且人性化的小鼠采血方法。通过面部进针点采集血液,将对动物的影响降到最低。
注意事项:
① 操作应迅速、轻柔以避免对动物造成不必要的伤害。
② 采血前后需进行适当的止血措施以防止出血过多。
③ 尾尖在长期反复取血的情况下应逐渐向近心端穿刺。
④ 尽量在满足实验要求的基础上选择简单易行且对动物伤害较小的采血方法。
处死小鼠和大鼠时需遵循动物福利原则并确保操作规范。常用的处死方法包括颈椎脱臼法和二氧化碳窒息法等。
1. 颈椎脱臼法:先将大、小鼠麻醉后提起尾巴根部并放在粗糙面上固定枕寰关节。用力拉向后上方使枕寰关节脱臼导致脊髓与脑干断离从而迅速死亡。此方法简便易行且对动物伤害较小。
2. 二氧化碳窒息法:将小鼠或大鼠放入盛有二氧化碳气体的密闭容器中通过替换氧气达到窒息效果。需确保容器干净透明并装有通气孔以及提供适应低氧环境的空气或氧气。持续增加CO₂浓度直至达到100%并确保动物在引起疼痛之前已失去意识。给药后观察动物反应并确认死亡。此方法使用简便、危害小且成本低廉但不适用于大型动物。
在进行以上所有操作时,务必确保人身和动物的安全,遵循动物福利原则并尽量减少对动物的伤害和痛苦。
关于晶莱
