

抗酒石酸酸性磷酸酶染色,又称Trap染色,是用于检测骨、骨细胞中破骨细胞的染色,使破骨细胞呈红色,细胞核浅蓝色,用以显示破骨细胞的分布及数量变化。
抗酒石酸酸性磷酸酶染色,又称Trap染色,是用于检测骨、骨细胞中破骨细胞的染色,使破骨细胞呈红色,细胞核浅蓝色,用以显示破骨细胞的分布及数量变化。
Trap染色是用于检测骨组织、骨细胞中特征物质的染色,使破骨细胞呈红色,背景呈绿色或蓝色。抗酒石酸酸性磷酸酶(Trap)为破骨细胞的标志酶,特异地分布于破骨细胞中,为破骨细胞所特有,通常作为鉴别破骨细胞的重要标志物。在含酒石酸的酸性条件下,trap能将萘酚AS-BI磷酸盐水解,产生的萘酚AS-BI立即与fast red或六偶氮副品红结合,在酶活性部位形成不溶性的红色染料,通过观察红色染料的形成可间接了解酸性磷酸酶的活性,进一步鉴别及分析破骨细胞的状态。
骨组织切片及trap染色实验步骤
1、 骨组织脱钙:新鲜骨组织固定于4%多聚jia醛24h以上。将组织从固定液取出置于EDTA脱钙液内脱钙(不能用含酸的脱钙液脱钙),每3天换一次脱钙液,至骨组织针扎可以顺利通过为止。
2、 取材:在通风橱内用手术刀将目的部位组织修平整,将修切好的组织和对应的标签放于脱水盒内。
3、 脱水:将脱水盒放进吊篮里于脱水机内依次梯度酒精进行脱水。75%酒精4h-85%酒精2h-90%酒精2h-95%酒精1h-无水乙醇I 30min-无水乙醇II 30min-醇苯5-10min-二甲苯I 5-10min-二甲苯II 5-10min-蜡I 1h-蜡II 1h-蜡III 1h。
4、 包埋:将浸好蜡的组织于包埋机内进行包埋。先将融化的蜡放入包埋框,待蜡凝固之前将组织从脱水盒内取出按照包埋面的要求放入包埋框并贴上对应的标签。于-20°冻台冷却,蜡凝固后将蜡块从包埋框中取出并修整蜡块。
5、 切片:将修整好的蜡块置于石蜡切片机上切片,片厚4μm。 切片漂浮于摊片机40℃ 温水上将组织展平,用载玻片将组织捞起,并放进60℃ 烘箱内烤片。待水烤干蜡烤化后取出常温保存备用。
6、 石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ20min-二甲苯Ⅱ20min-无水乙醇Ⅰ10min-无水乙醇Ⅱ10min-95%酒精5min-90%酒精5min-80%酒精5min-70%酒精5min-蒸馏水洗。
7、 染液配制:A液:0.1mol/L醋酸缓冲液PH5.0:醋酸Na1.3608g+蒸馏水100ml溶解,用Bing醋酸调PH值到5.0。B液:六偶氮副品红 4%亚肖酸Na:2g亚肖酸Na+去离子水50ml
副品红溶液:副品红2.5g+去离子水50ml+浓盐酸7.5ml,加热至90°溶解后过滤,4°棕色瓶保存。临用前4%亚肖酸Na与副品红溶液等比例混合。
C液:萘酚AS-BI磷酸酯20mg+N,N-2甲基甲酰胺1ml溶解。
孵育液配制:A液18ml+B液1ml+C液1ml混匀,用1M NaOH或1M盐酸调pH至5.0,再加酒石酸钾Na0.282g,充分溶解过滤后备用即为TRAP孵育液。
8、 染色:切片置于TRAP孵育液内37°孵育50min,镜下观察破骨细胞呈酒红色为止。蒸馏水漂洗。
9、 苏木素染细胞核:切片入Harris苏木素染3-8min,自来水洗,1%的盐酸酒精分化数秒,自来水冲洗,0.6%氨.水返蓝,流水冲洗。
10、 脱水封片:将切片依次放入95%酒精I 5min -95%酒精II 5min-无水乙醇Ⅰ5min -无水乙醇Ⅱ5min -二甲苯Ⅰ5min -二甲苯Ⅱ5min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。
11、 显微镜镜检,图像采集分析。
染色结果:破骨细胞胞浆呈酒红色,核蓝色。
注意事项
1、试剂配制的过程中,各个试剂的PH值一定要准确,PH不准会导致酶不能被有效激活,导致染色结果不佳。
2、亚硝酸Na溶液不稳定,容易被氧化,在使用时避免带入杂质,并且为了确保染色结果,最好一到两个星期更换一次。
3、染trap的骨组织最好用EDTA脱钙,用酸脱钙的组织切片trap为阴性。
结果展示
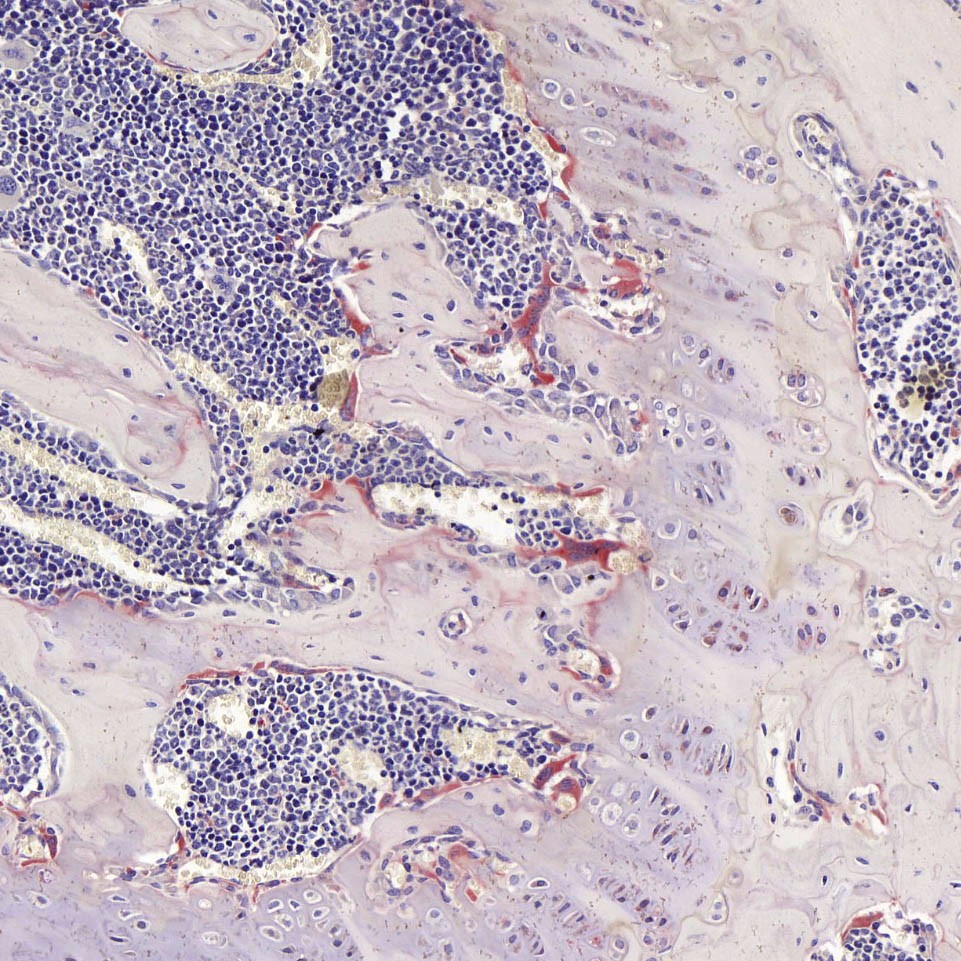
结果判读:
破骨细胞呈酒红色或浅红色,细胞核呈浅蓝色
送样运输要求:
1.样本放置于20倍样本体积的固定液中固定24h以上,常温运输送样。切勿固定时间过长,切勿冷冻结冰。
2.石蜡切片常温运输。