
铁蛋白自噬介导的铁死亡参与脓毒症心肌损伤

期刊:FREE RADICAL BIOLOGY AND MEDICINE
影响因子:6.078
脓毒症心肌病
脓毒症(sepsis)是由微生物及其毒素引起的全身炎症反应综合征,脓毒症心肌病是脓毒症引起的并发症,轻者出现心肌病变,心肌收缩和或舒张功能下降,可逆性心功能减退,严重者导致心力衰竭、甚至心源性休克导致死亡,是一个亟待解决的临床问题。
铁死亡(Ferroptosis)
铁死亡是一种铁依赖性的,区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式 ,主要机制是,在二价铁或酯氧合酶的作用下,催化细胞膜上高表达的不饱和脂肪酸,发生脂质过氧化,从而诱导细胞死亡;前期研究表明,抑制焦亡、自噬或凋亡只能部分减轻脂多糖诱导的心肌细胞损伤,提示其他类型的细胞死亡形式可能参与了脓毒症诱导的心脏损伤。探究铁死亡是否与脂多糖诱导的心脏损伤和功能障碍有关。
铁蛋白自噬
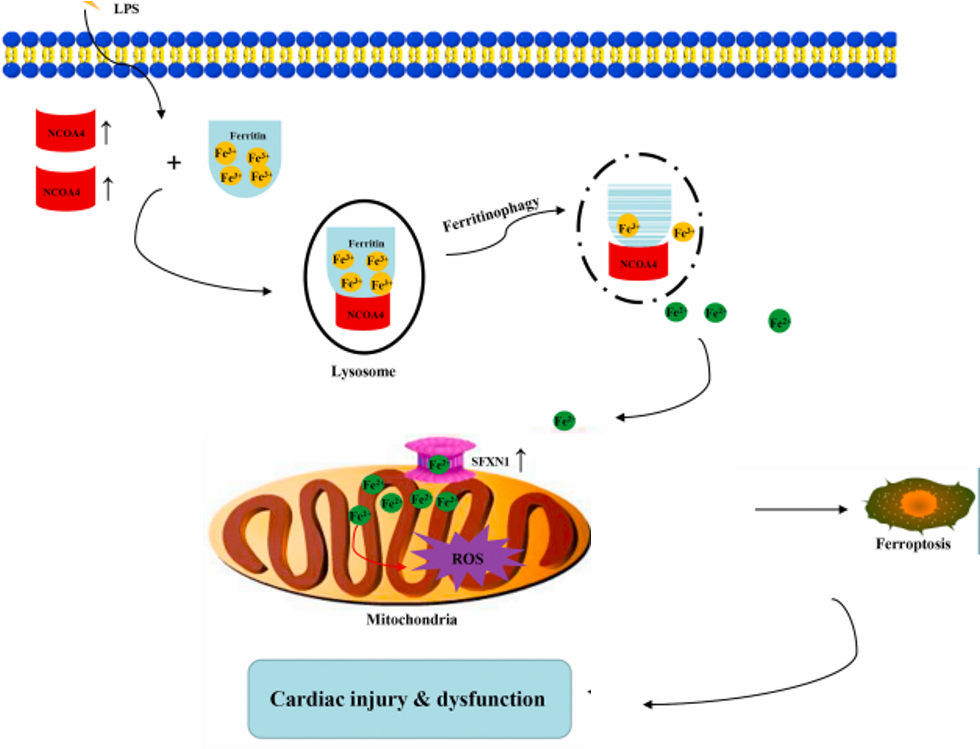
核受体共激活因子4(NCOA4)是介导铁蛋白自噬的货物受体,介导铁蛋白选择性自噬,增加细胞内Fe2+水平和脂质过氧化水平,触发铁死亡。已有研究表明,ncoa4介导的自噬铁蛋白降解是导致细胞铁死亡的主要发生机制,然而,ncoa4介导的铁蛋白自噬在脓毒性心肌病中的作用尚未见报道。探究脓毒性心肌病中铁死亡发生机制。
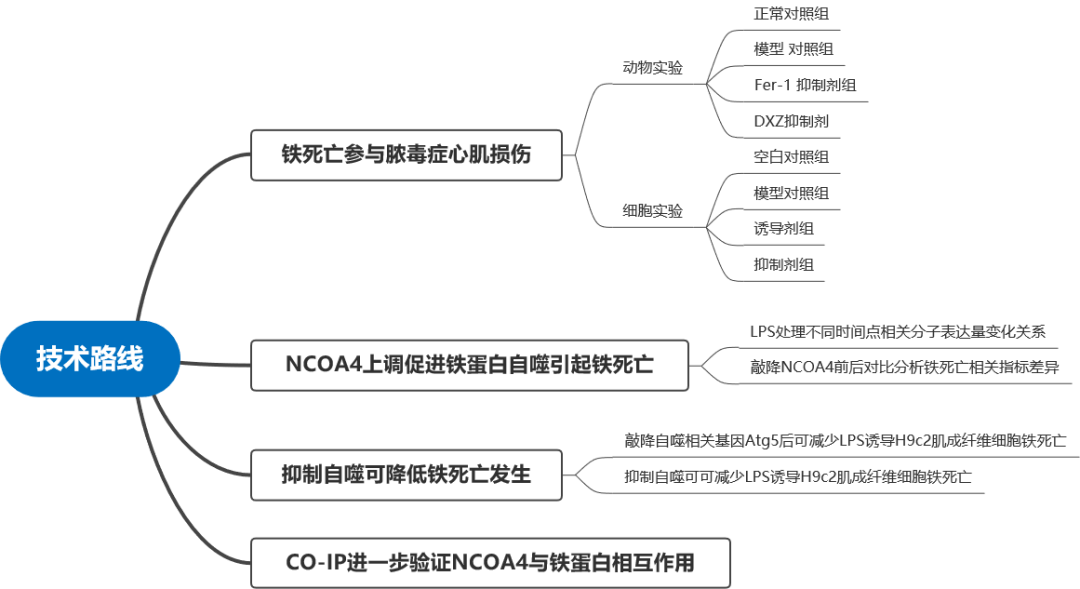
1.超声心动影像学评估
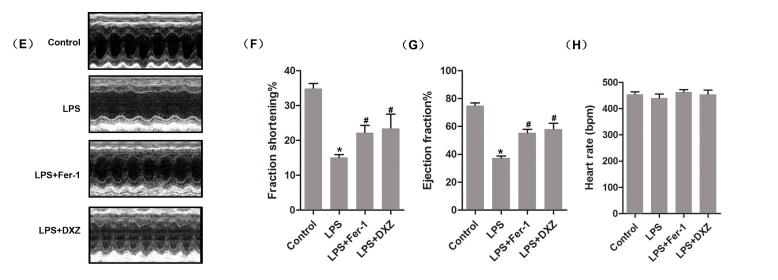
(E)超声心动图图像。各组左心室缩短分数左心室射血分数。H.各组的心率。
2. 常规病理
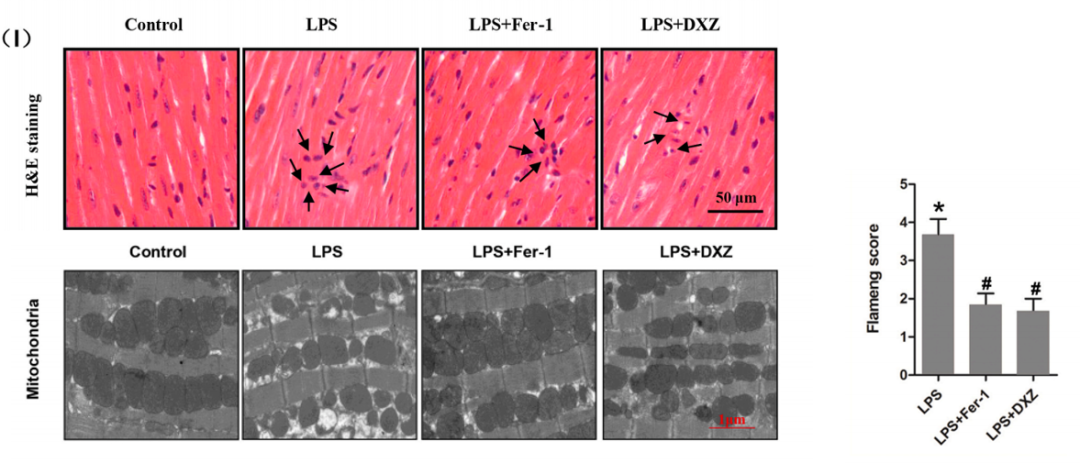
(I)HE染色、线粒体超微结构透射电镜图。
3.血生化
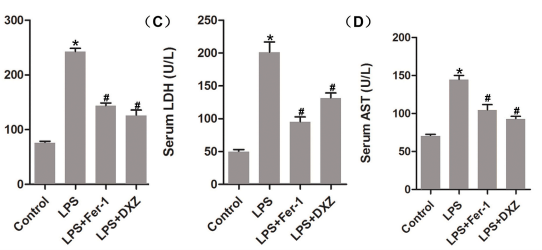
注射LPS(10mg/kg)12h的小鼠血清CK-MB、LDH和AST水平。
4.铁死亡相关分子检测
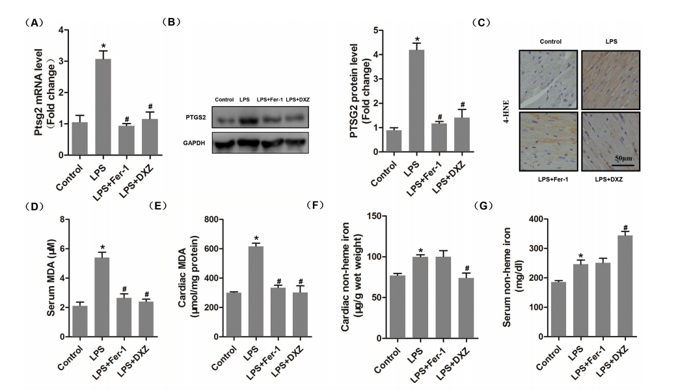
(A)-(B)PTGS2的mRNA和蛋白水平。
(C) 4-HNE蛋白的免疫组化染色。
(D)-(E) 血清和心脏MDA水平。
(F)-(G)指定组的心脏非血红素铁和血清非血红素铁。
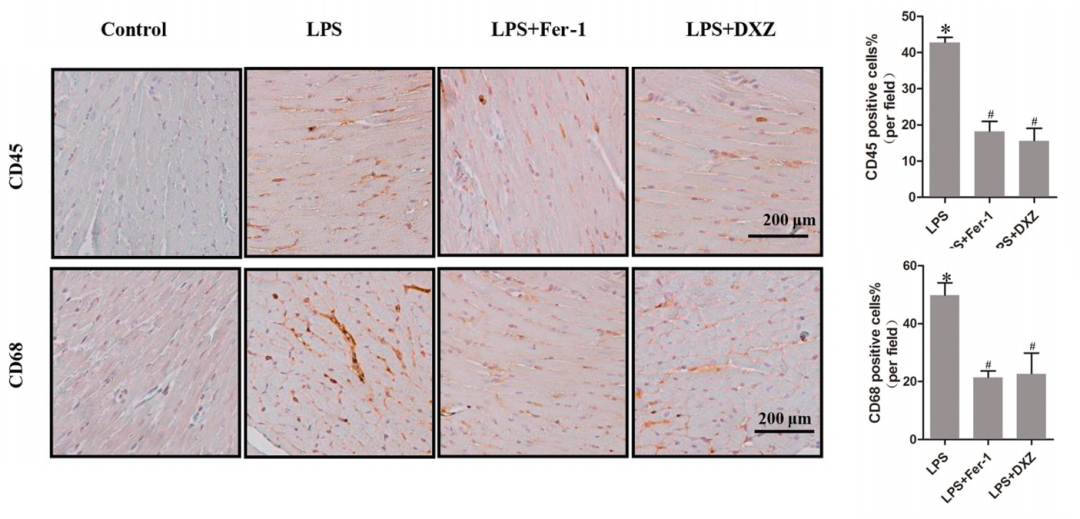
5.炎性细胞浸润
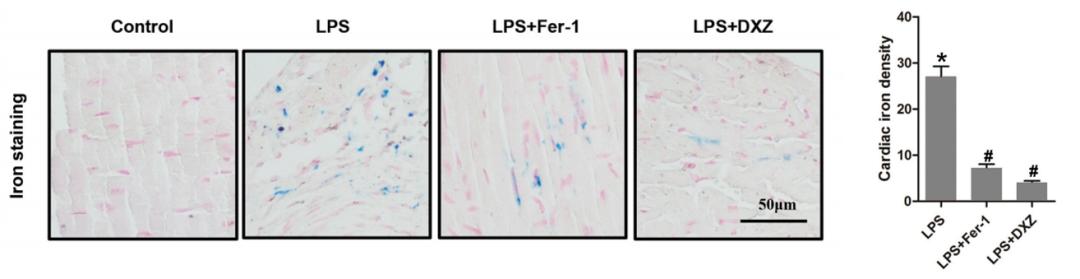
6.普鲁士蓝染色显示游离二价铁离子
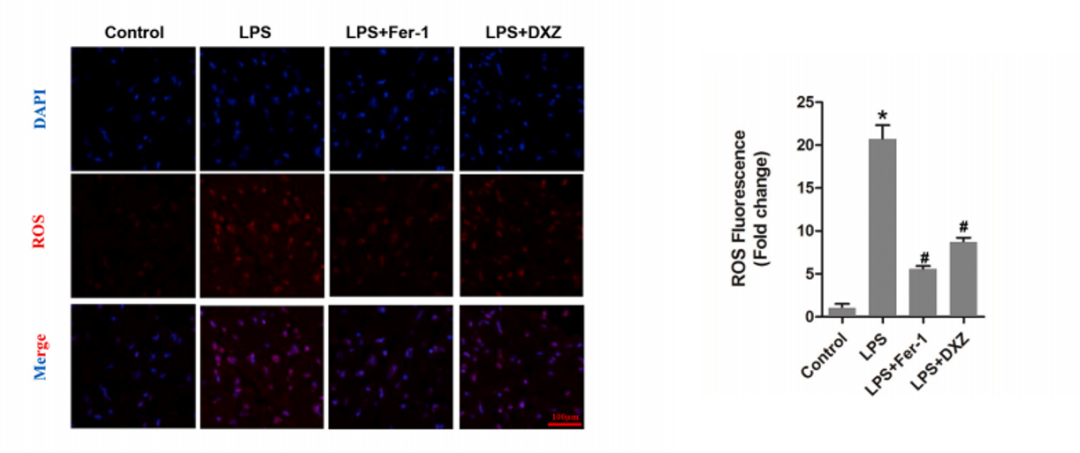
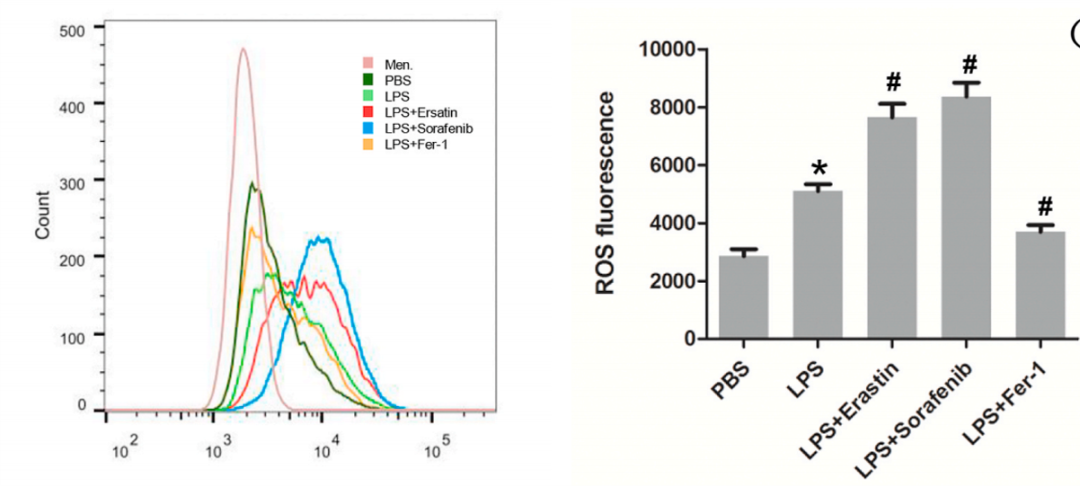
7.心肌活性氧ROS水平
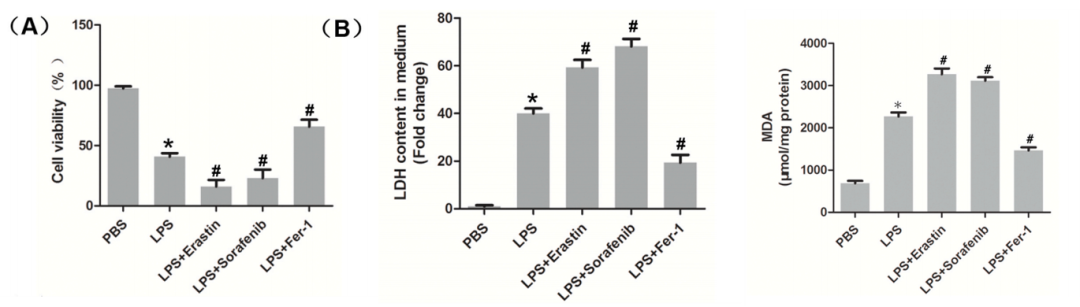
(A)细胞活力。
(B)乳酸脱氢酶LDH、丙二醛MDA水平。
8.诱导剂、抑制剂处理后铁死亡相关分子检测
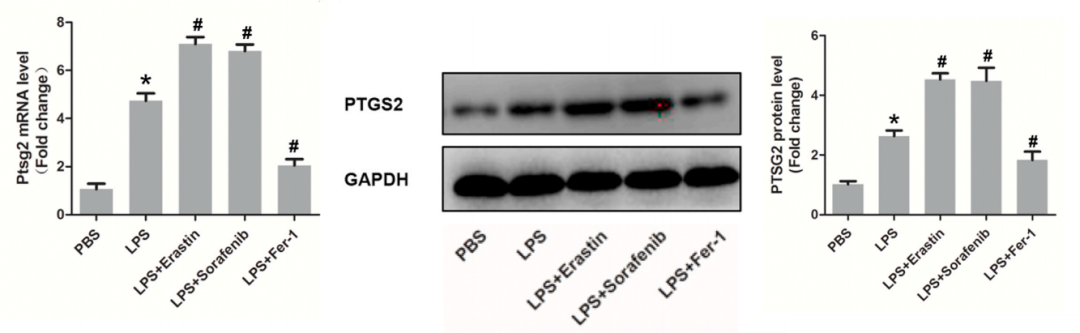
(D)qPCR检测Pstg2表达量。WB检测Pstg2表达量。
9.线粒体ROS水平流式检测
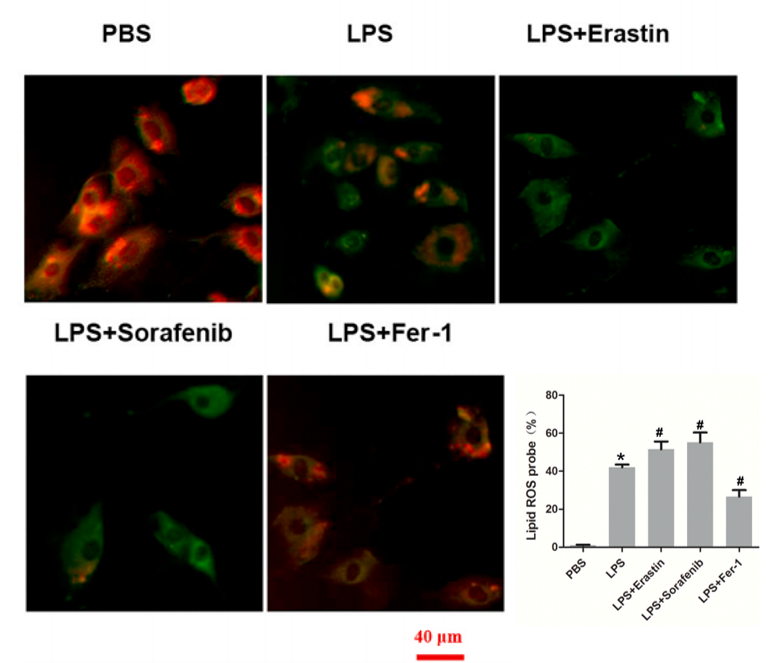
10.脂质ROS水平检测
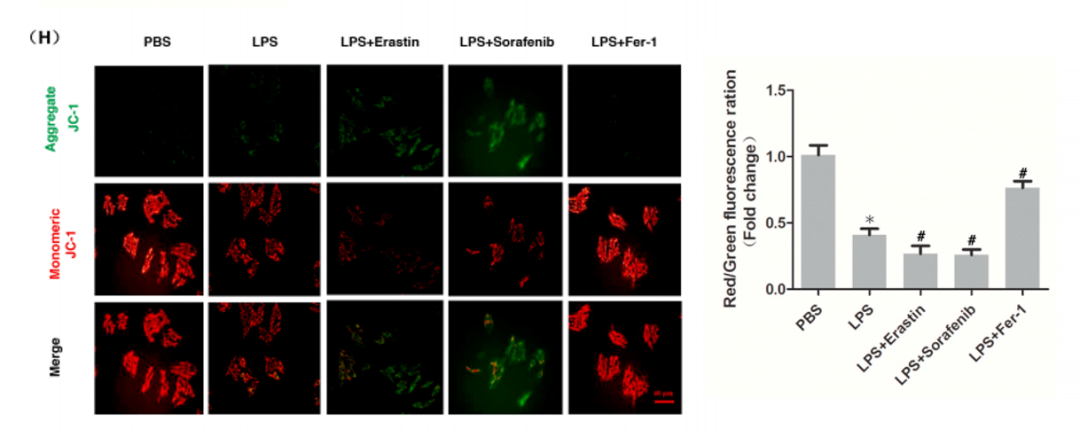
11.线粒体膜电位检测
1.LPS诱导不同时间点分子水平变化关系
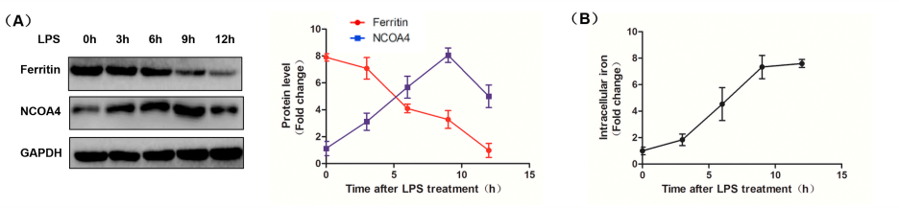
(A)LPS(1μg)刺激0、3、6、9和12h后H9c2肌成纤维细胞中铁蛋白和NCOA4的蛋白水平。
(B)LPS(1μg)刺激0、3、6、9、12h后H9c2肌成纤维细胞的胞内铁水平。
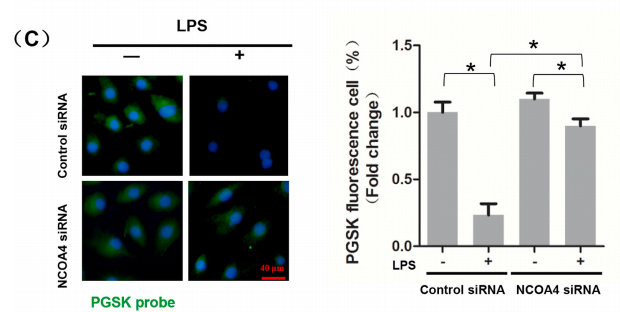
2.敲降NCOA4原位杂交检测PGSK水平
3.敲降NCOA4后相关分子表达量变化
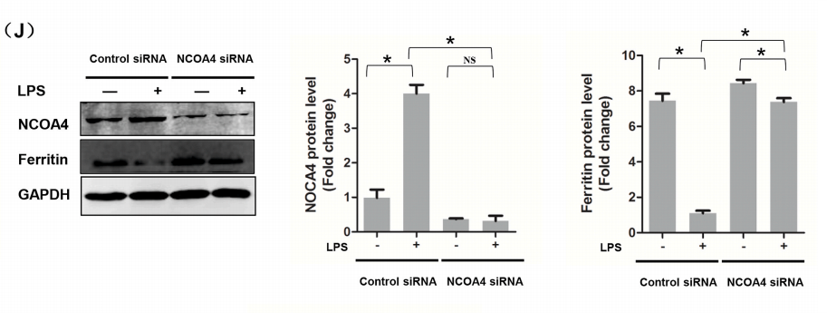
(J)转染NCOA4siRNA的LPS刺激H9c2肌成纤维细胞中NCOA4和铁蛋白的表达水平。
4.LDH、脂质ROS、 PTGS2水平
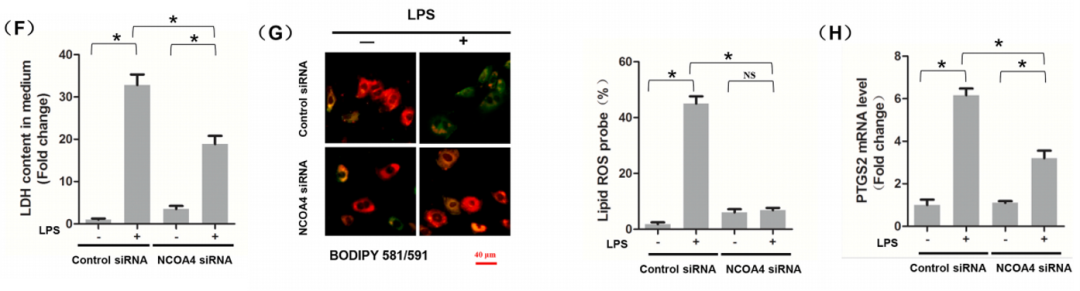
(F) LDH的含量
(G) 细胞内脂质ROS用BODIPY探针染色
(H)转染NCOA4siRNA6h后,LPS(1μg)刺激H9c2肌成纤维细胞中PTGS2的mRNA水平。
5.抑制自噬可减轻刺激后H9c2肌成纤维细胞铁死亡
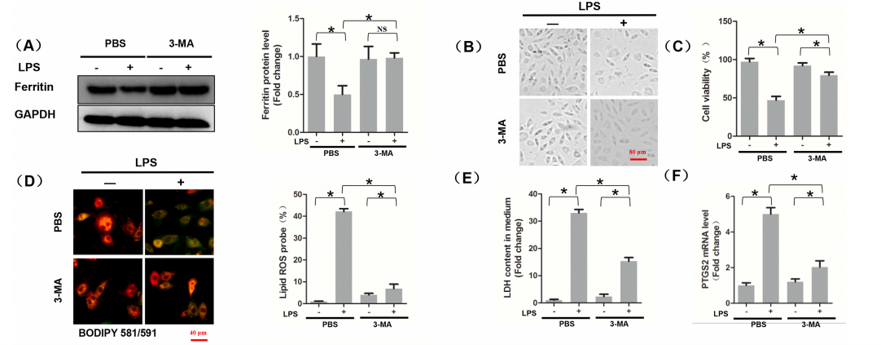
(A)铁蛋白的蛋白水平。
(B) 细胞形态。
(C) CCK8法检测细胞活力。
(D) 细胞内脂质ROS用BODIPY探针染色。
(E) LDH的含量。
(F) PTGS2mRNA水平。
6.敲降自噬相关基因Atg5后相关分子表达量变化
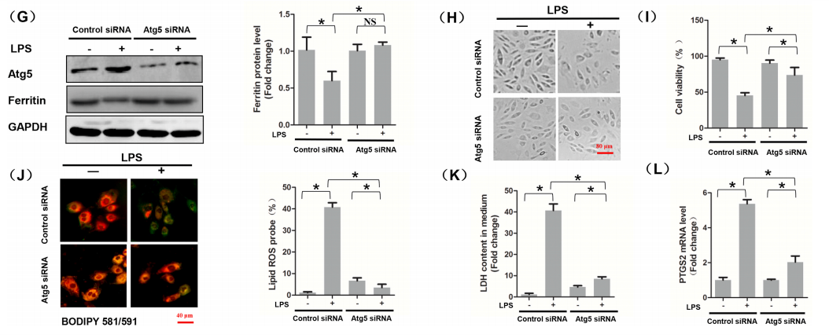
(G)转染NCOA4siRNA的LPS刺激H9c2肌成纤维细胞中Atg5和铁蛋白的蛋白水平。
(H) 细胞形态。
(I) CCK8法检测细胞活力。
(J)细胞内脂质ROS用BODIPY探针染色。
(K)LDH的含量。
(L)各组PTGS2mRNA水平。
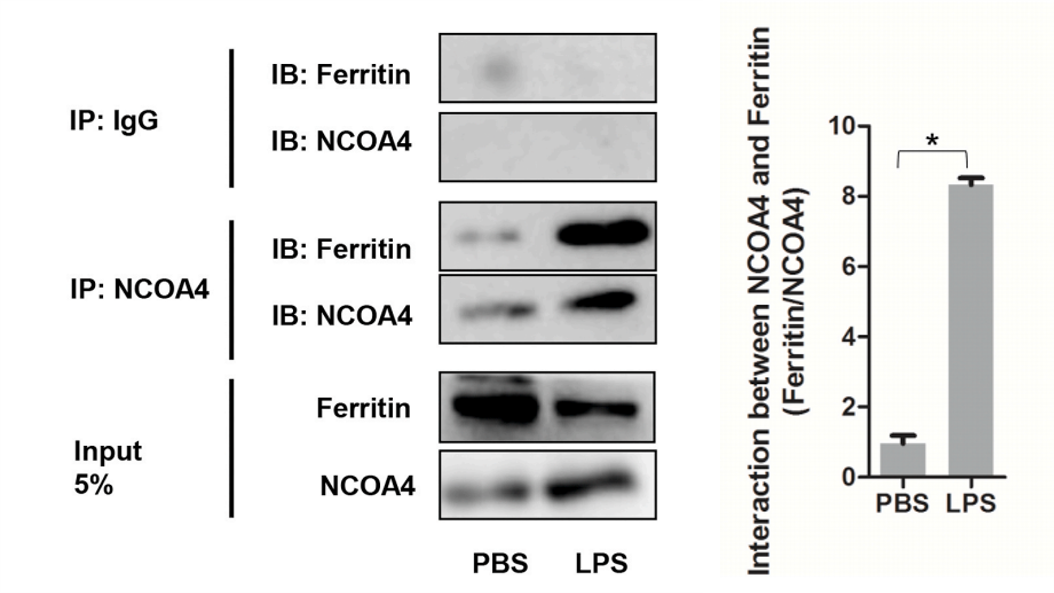
7.NCOA4、铁蛋白直接相互作用验证-COIP
①治疗脓毒症心肌病有效靶标
通过研究发现了,Fer-1或DXZ预处理降低了体内和体外心肌细胞的PTGS2和脂质ROS水平,表明靶向抑制铁死亡可能是治疗脓毒症心肌病的一种很有效的方法。
②抑制自噬也可减少铁死亡发生
在用apelin-13处理的H9c2肌成纤维细胞中,NCOA4触发铁蛋白自噬,通过增加游离铁水平进一步导致心肌细胞发生铁死亡,脂多糖诱导的心肌细胞铁死亡可以通过抑制自噬来阻断。
③验证NCOA4和铁蛋白直接相互作用
验证了NCOA4和铁蛋白直接相互作用关系,且LPS促进了NCOA4和铁蛋白之间的相互作用。
④有效治疗药物
使用Def线粒体铁螯合剂,能通过抑制线粒体ROS的产生显著减轻脂多糖诱导的小鼠心脏功能损伤和炎症激活,线粒体铁螯合剂可能作为一种更有效的药物治疗脂多糖诱导的心脏损伤。


