

期刊名:CEll DEATH DIS
影响因子:6.28
发布时间:2020年
研究背景
阿尔茨海默病(AD)是一种不可逆的神经衍生性疾病,发病机制复杂,影响全球 4700 万人。AD 患者的高死亡率主要归因于复杂的病因和有限的治疗干预。除了存在Aβ外,脑缺氧是AD的高危因素,可能导致细胞和组织损伤,导致细胞功能障碍和细胞衰老,然后是认知和记忆缺陷。
间充质干细胞(MSC)是一种独特的基质细胞类型,在神经退行性疾病(包括AD5)中具有功能和结构益处。越来越多的证据已经证明了MSCs由于其独特的性质,包括相对容易获得,快速增殖能力和多能性,具有治疗效果。
最近的数据还表明,间充质干细胞可以通过其旁分泌作用6使AD受益,尽管障碍仍有待克服,特别是细胞存活率差和组织相容性差。外泌体被认为是MSCs的有效分泌产物,含有小RNA和蛋白质的特定有效载荷,它们在MSC介导的生物效应中起重要作用。来自MSCs的外泌体是直径为30-120nm的纳米级囊泡,起源于特定细胞,可以介导神经元保护和神经再生,这可能会减缓甚至逆转AD的进展。
一项研究证实,miR-223被选择性地包装到外泌体中,并且外泌体包封的miRNA可以通过避免核酸酶降解来稳定储存。MiR-223已成为神经保护的推定预测因子,据报道,它能够限制炎症,以防止感染期间的附带损害,并防止致癌性骨髓转化。
在我们的研究中,发现miR-223与PTEN相关,PTEN控制多种细胞反应,如细胞凋亡,作为PI3K / Akt信号转导途径的关键调节因子。我们之前的研究证实,miR-223被偶然地包装在外泌体中,并且在AD患者和健康对照组之间显着不同,并且它可能干扰AD作为保护性fac-tor16的进展。在这项研究中,我们旨在探索MSC衍生的外泌体是否对神经元凋亡具有保护作用,以及这种作用是否是miR-223含量。
研究意义
缺氧限制了神经元在阿尔茨海默病发展中的生存和功能。外泌体依赖性细胞间通讯是一种参与组织修复和再生的新兴信号传导机制;然而,间充质干细胞衍生的外泌体在调节神经元细胞凋亡中的作用和潜在机制尚未确定。
文中表明AD细胞模型的建立伴随着HIF-1α表达和细胞凋亡的增加,细胞迁移受损和miR-223的降低。MSC衍生的外泌体被AD细胞共培养模型以时间依赖性方式内化,导致细胞凋亡减少,细胞迁移增强和miR-223增加,这些效应被缺氧抑制剂KC7F2逆转。此外,MSC衍生的外泌体miR-223通过靶向PTEN在体外抑制神经元的凋亡,从而激活PI3K / Akt途径。此外,从AD患者的血清中分离出的外泌体促进细胞凋亡。
研究表明,MSC衍生的外泌体miR-223通过PTEN-PI3K / Akt途径保护神经元细胞免受凋亡,并为AD提供了一种潜在的治疗方法。
技术路线
研究内容
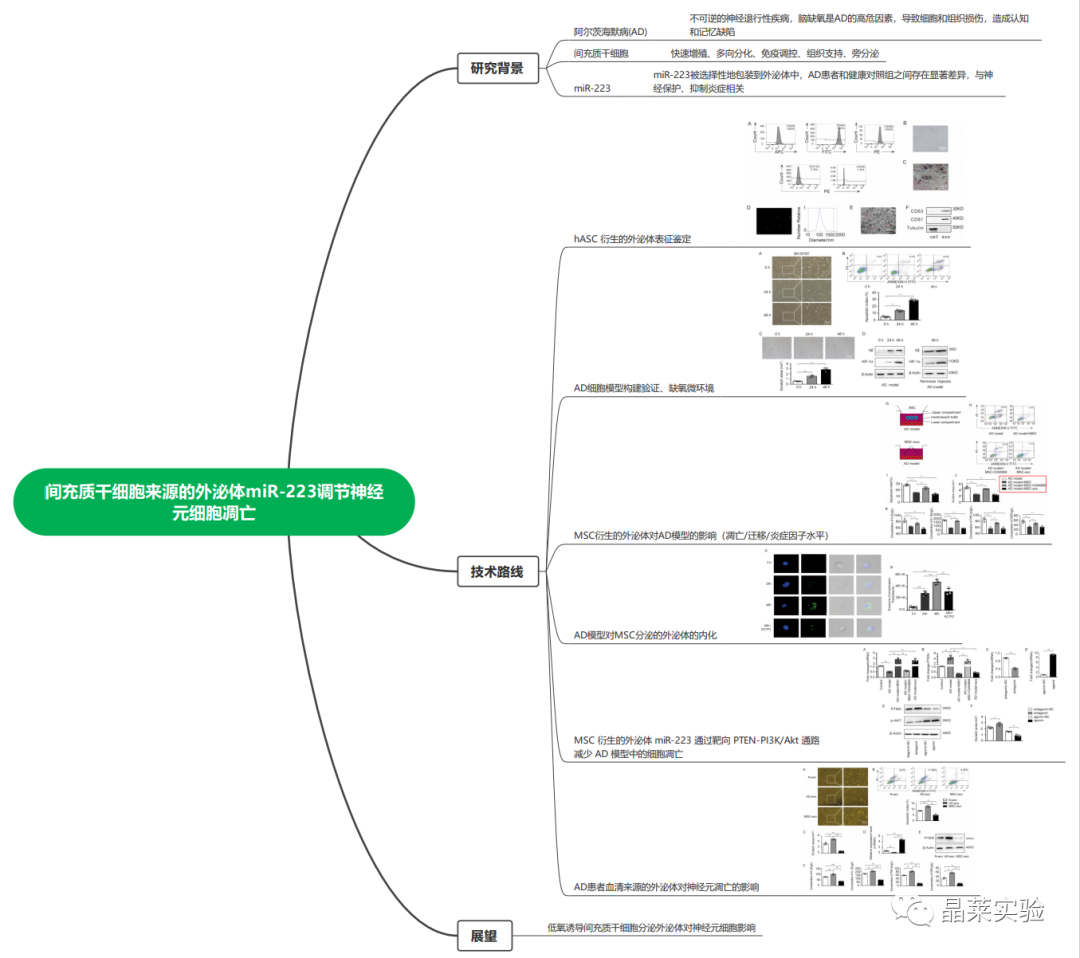
hASC衍生的外泌体表征鉴定
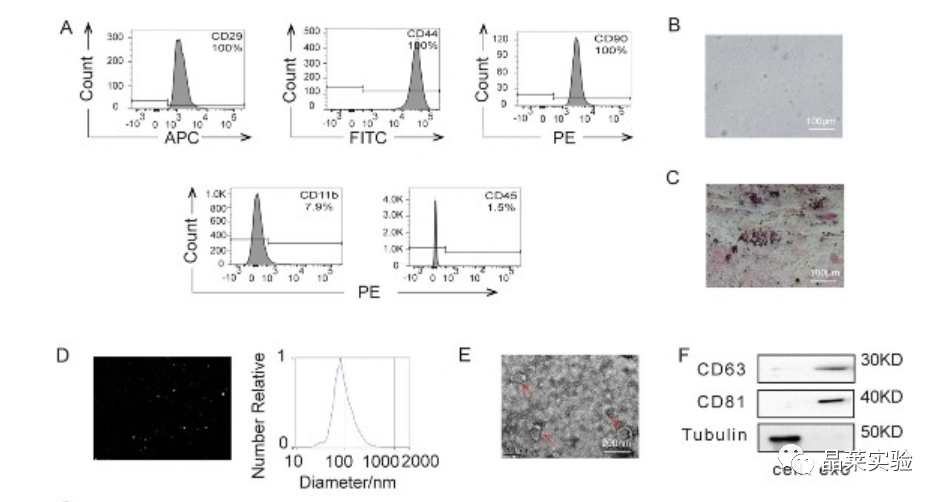
AD细胞模型构建、验证缺氧环境

HIF-1 α在AD模型中以瞬态方式升高,这表明缺氧应激增加。在常氧和缺氧条件下建立了AD模型,发现缺氧增强了A β的表达。巧合的是,具有SH-SY5Y细胞的AD模型是成功的 - 由A β 1-40完全建立,并且该AD模型在缺氧条件下运行。
A. β1–40处理0、24或48 h的SH-SY5Y细胞的形态学特征。
b. AD模型的凋亡。
c. 通过伤口愈合测定法分析细胞迁移能力,用ImageJ定量暴露于Aβ1–40的SH-SY5Y细胞中的划伤区域0或24小时。
MSC衍生的外泌体对AD模型的影响
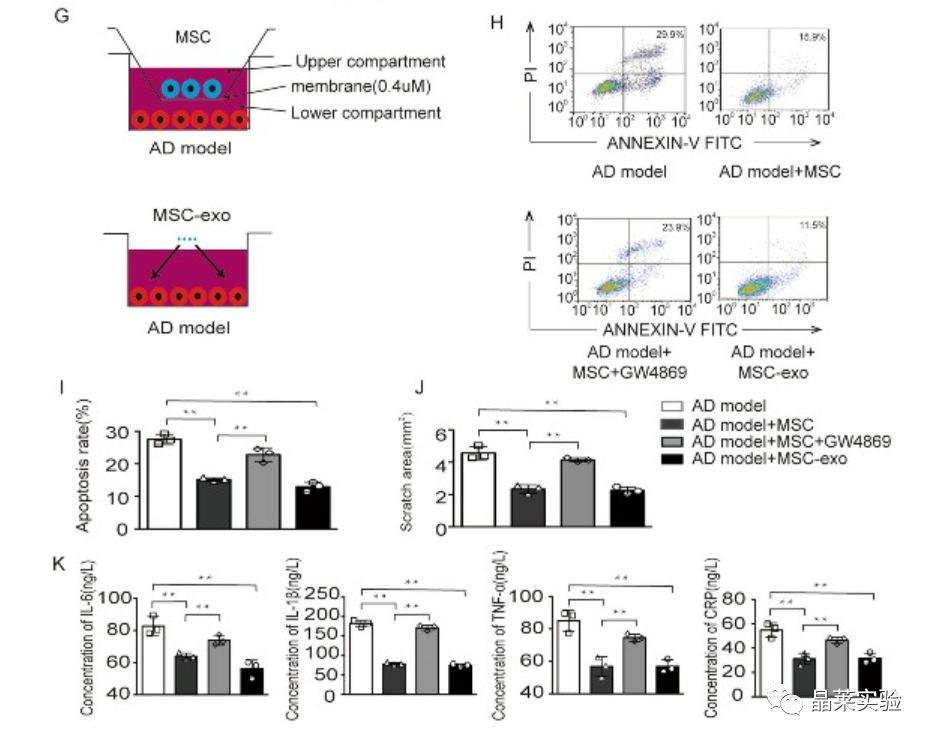
MSCs和外泌体共同培养的AD模型的凋亡率显着降低。同样,我们发现MSCs及其外泌体减少了伤口愈合测定中的划痕区域。MSCs和外泌体中炎症因子的共生体显著降低。在用外泌体抑制剂GW4869预处理后,这些保护作用被抑制。
这些发现表明,外泌体保护AD模型免受破坏性影响。来自MSCs的MSCs和外泌体表现出相似的神经保护作用。
AD模型对MSC分泌的外泌体内化

随着共培养时间的延长,细胞防止凋亡的能力增加,细胞迁移增强,这可能是由于AD模型内化的外泌体的增加。这种效应显着降低,同时缺氧条件得到抑制。
AD模型对MSC衍生的外泌体的内化通过缺氧得到增强。
MSC衍生的外泌体miR-223通过靶向PTEN-PI3K / Akt途径减少AD模型中的细胞凋亡
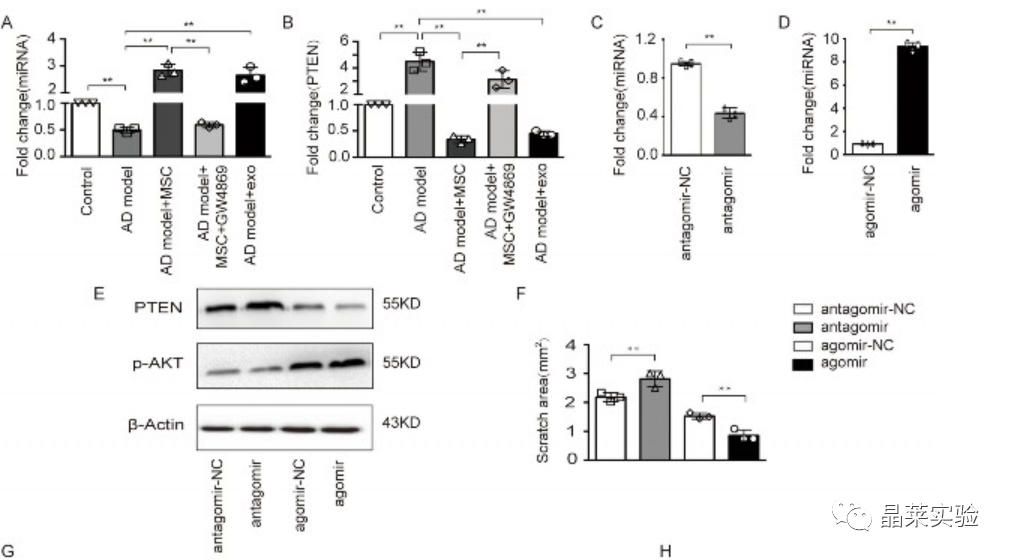
在miR-223过表达MSC来源的外泌体治疗AD模型中,炎症因子的表达显着下调。MSC衍生的外泌体miR-223在调节神经元细胞凋亡中的作用模型显示在附加文件5中。
这些结果表明,MSC衍生的外泌体miR-223可能通过PTEN-PI3K / Akt途径抑制神经元凋亡。
AD患者血清外泌体对神经元凋亡的影响
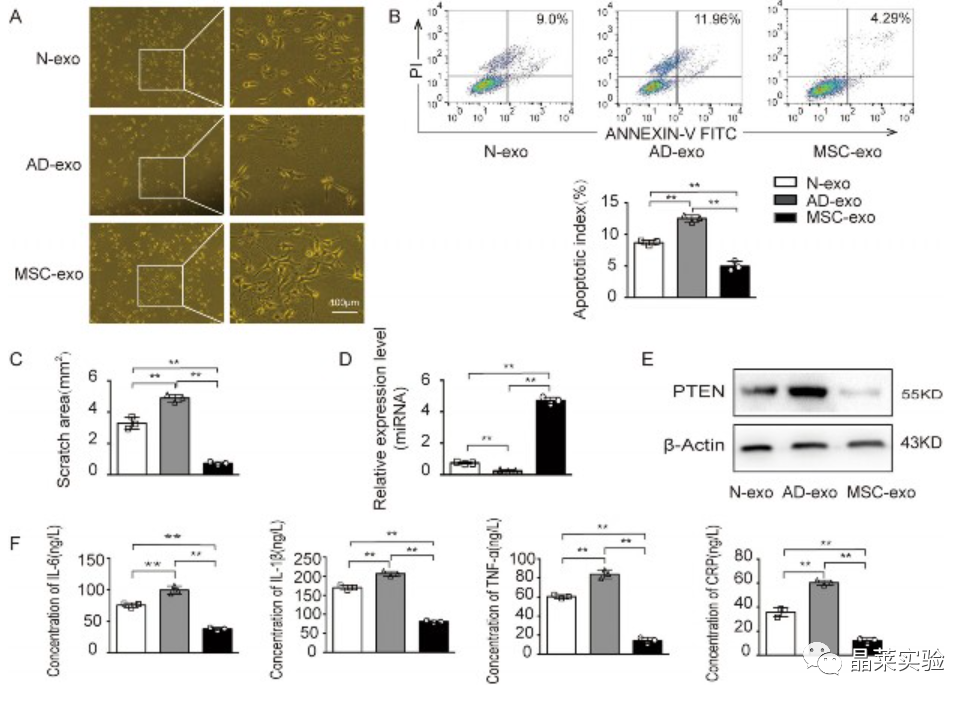
为了测试从AD患者血清中分离出的外泌体是否对神经元流行性遗传有任何生理作用,将来自人血清和MSCs的外泌体添加到AD模型中进行接触共培养。在AD模型中观察到与血清外泌体或MSC衍生的外泌体共培养的细胞形态发生显着变化。用AD患者血清外泌体处理的AD模型直接减少了细胞的数量并缩短了突触,而用来自MSCs的外泌体处理的AD模型促进了这些细胞特性。评估外泌体对细胞生物学功能的生理作用。与AD模型中健康样本相比,AD患者血清的外泌体细胞凋亡增加,而MSC衍生的外泌体减少细胞凋亡。
这些结果表明外泌体货物组成可能转移与AD细胞凋亡相关的物质。
文献总结
1. 我们的研究进一步证实,缺氧是AD的危险因素。
2. 干细胞疗法已成为治疗AD的一种新颖且有前途的候选方法,可能是由于分泌各种神经因子提供了神经保护。已经提出转基因和转染MSCs来加强MSCs的旁分泌作用,这在临床前研究中成功地保护了大脑。与其他干细胞相比,MSCs在有效性和便利性方面的优势更为明显。
3.文献数据表明,MSC-外泌体的递送降低了AD中的细胞凋亡反应并促进了功能恢复,并揭示了MSC衍生的外泌体miR-223通过PI3K / Akt信号通路充当AD的保护因子。
4. 文献研究结果为开发一种即用型,无细胞和基于MSC的治疗方法提供了一个比率,该方法对AD的治疗非常有效。这一假设应该具有价值,以加强MSC衍生的外泌体的临床吸引力,使这种治疗简单,无创,容易获得和经济上负担得起。
文献中涉及的实验技术
以上文献涉及的实验技术,均可在晶莱生物展开。
【晶莱生物】是一家专注于生物医学领域内科研学术服务的高新技术企业,致力于打造国内一流的生物技术服务品牌。拥有超3000平的综合实验室,有SPF级动物房,可饲养将近4万只动物,可构建200余种动物模型,拥有多个大型实验中心和生物资源库。可为您提供包括基因组学、细胞生物学、蛋白鉴定及分析、病理组化、表观遗传学、动物造模等多个实验平台服务。