Bone Marrow Mesenchymal Stem Cell-Derived Exosomal MicroRNA-126-3p Inhibits Pancreatic Cancer Development by Targeting ADAM9
骨髓间充质干细胞衍生的外泌体MicroRNA-126-3p通过靶向ADAM9抑制胰腺癌的发展
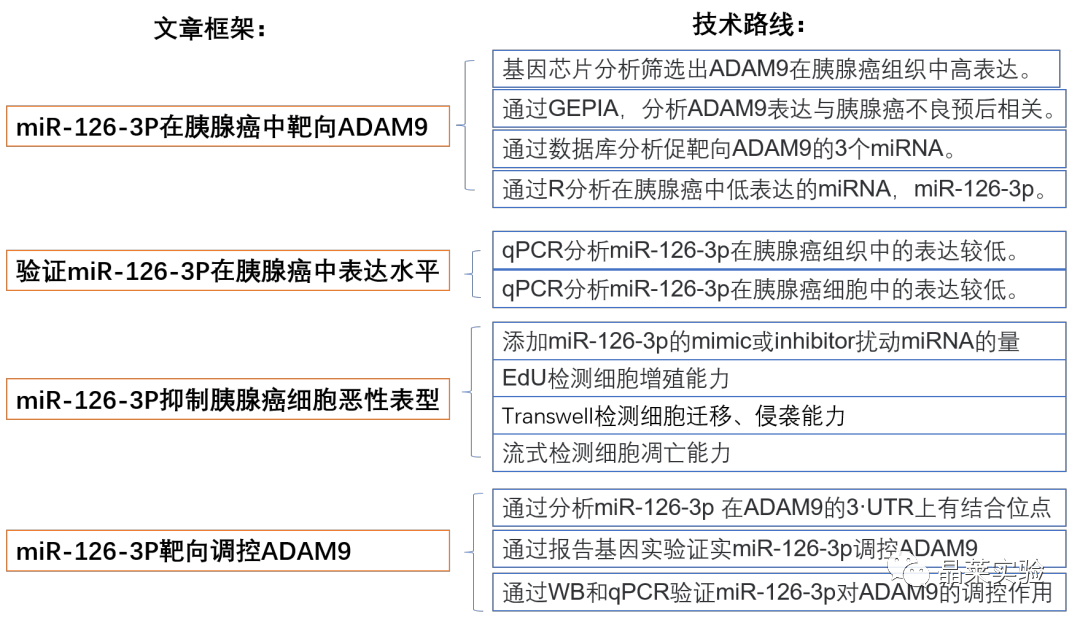
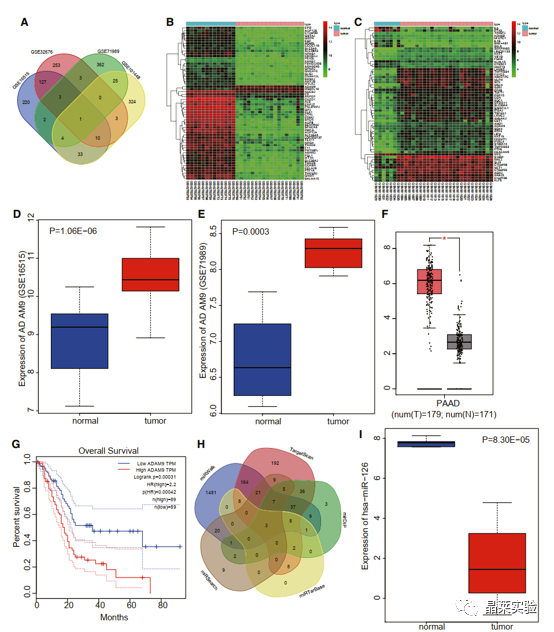
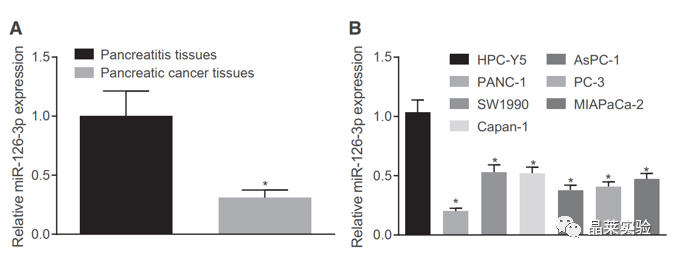
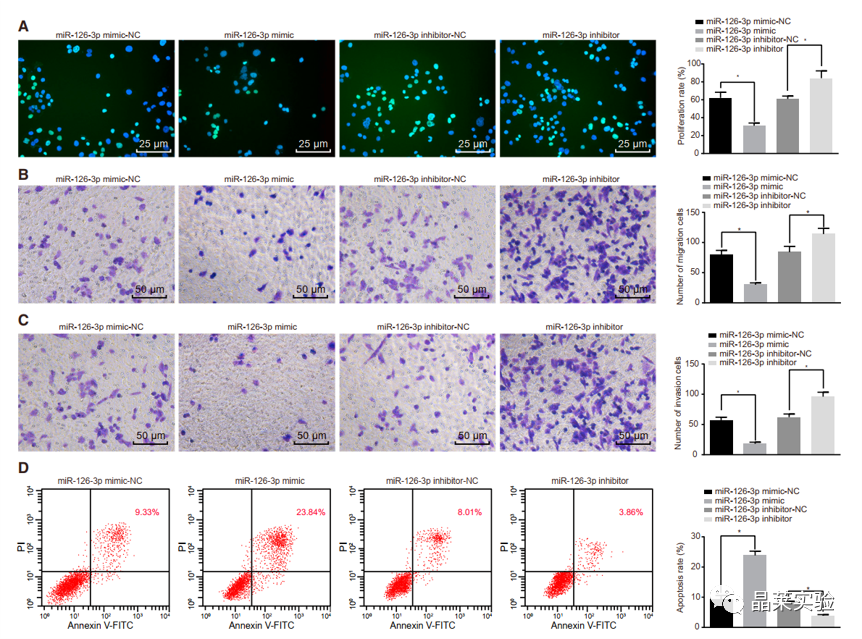
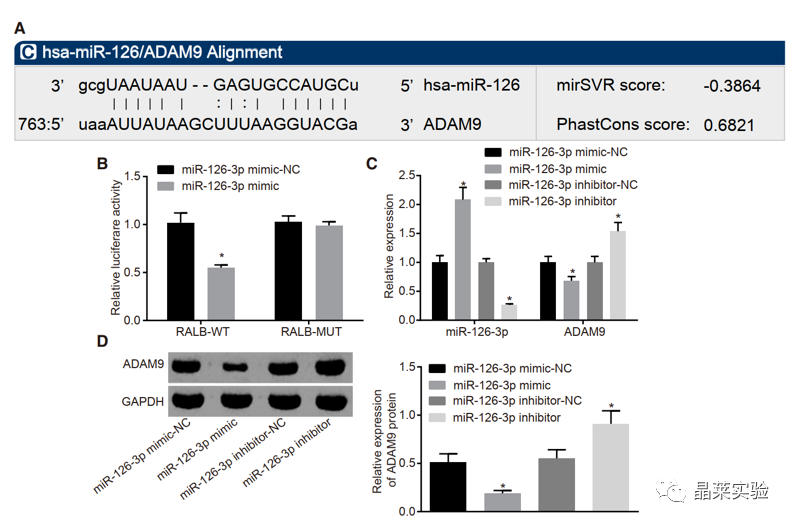
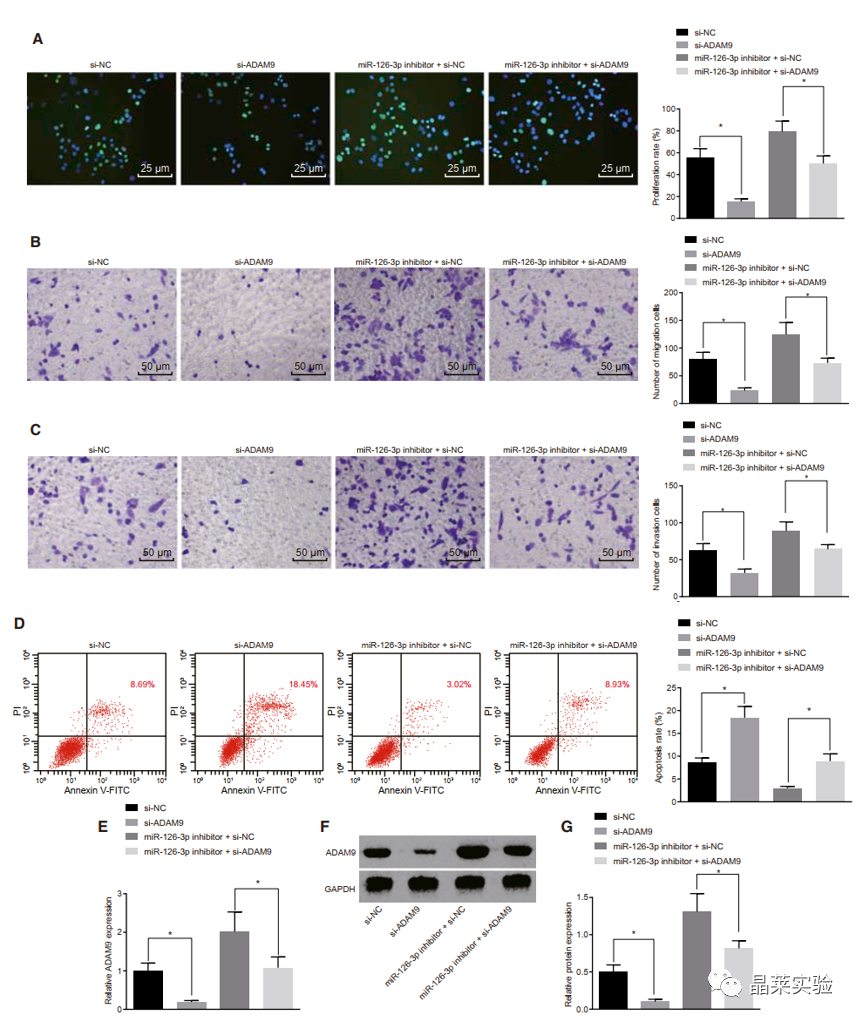
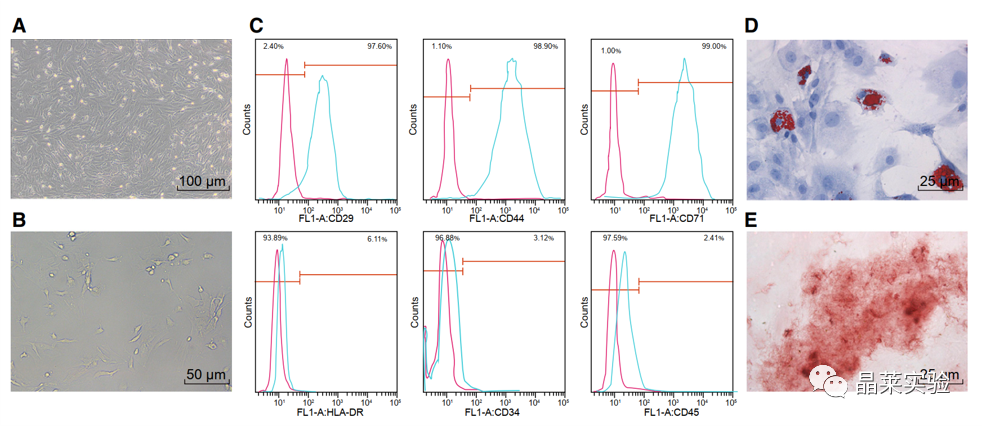
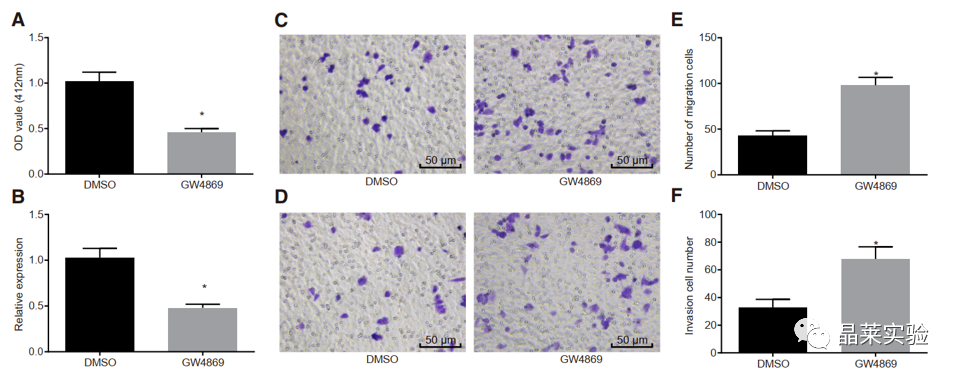
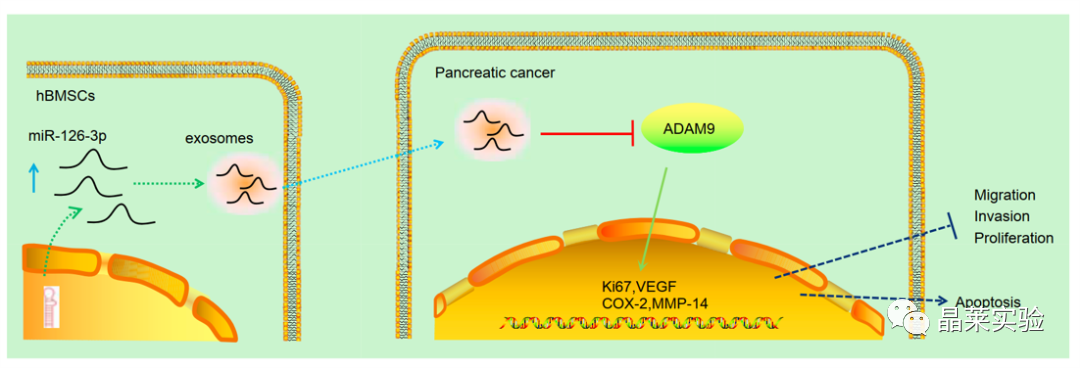
期刊:Molecular Therapy-Nucleic Acids 影响因子:8.88 研究背景 胰腺癌是一种致命的恶性肿瘤,有效的治疗方法相对较少,是癌症的第四大死因,其生存率非常。尽管胰腺癌的治疗方法有所改进,但在过去几十年里,胰腺癌的死亡率几乎没有变化,这主要是由于缺乏足够的筛查方法和早期诊断的生物标志物。 骨髓间充质干细胞(BMSC)可以被定义为一种类似于成纤维细胞的非造血细胞家族,最初被用作多能祖细胞。骨髓间充质干细胞已经被证明能够迁移到肿瘤组织中,有研究推测它们在胰腺癌基因治疗中具有一定的潜力。 外泌体是一种小的、膜包裹的囊泡(30-150纳米),可将蛋白质、脂质和核酸等物质从原始细胞运送到受体细胞。研究表明从骨髓间充质干细胞(BMSC)来源的外泌体释放的小泡可以将功能性RNA转移到受体细胞。特别是有报道称外泌体可以携带microRNAs (miRNAs),参与癌细胞增殖、分化和凋亡。 miR-126-3p,一种miRNA亚型,已被证明是一种肿瘤抑制因子,而报告表明,它可能能够抑制癌症的进展。miR -126-3p在食管鳞状细胞癌(ESCC)中表达下调,与患者的不良预后相关。此外,有报道称miR-126-3p能够抑制胰腺癌患者血浆中的细胞转移、侵袭和调节失调。有报道称miR-126-3p负调控一种分解整合素和一种金属蛋白酶-9 (ADAM9)。 科学问题 探讨经BMSC来源的外泌体转移的miR-126-3p在胰腺癌中的作用。 文章框架&技术路线 研究结果及分析 1、miR-126-3P在胰腺癌中靶向ADAM9 通过分析4组胰腺癌表达芯片数据,比较每个芯片前400个差异基因并绘制venn图,得到ADAM9是4组中的共同的差异基因。 分别绘制GEO: GSE101448和GSE32676芯片前60个差异表达基因的热图谱表达情况。 与正常组织相比,从GEO: GSE16515和GSE71989芯片中,ADAM9在胰腺癌组织中高表达。 利用表达谱交互分析(Expression Profiling Interactive Analysis, GEPIA)数据库,测定和检索ADAM9在胰腺癌组织和正常组织中的表达,分析表达与生产条件的相关性。证明ADAM9在胰腺癌组织中的表达高于正常组织。 生存分析显示,ADAM9表达越高,胰腺癌患者的总生存率越低。 通过分析TargetScan, miRSearch, miRTarBase, miRWalk, 和 mirDIP数据库,预测调控ADAM9的miRNA,得到三个候选miRNAs, hsa-miR-26b-5p, hsa-miR-126-3p, and hsa-miR-373-3p。 通过R筛选胰腺癌miRNA表达芯片GEO: GSE28955,在上述三个靶向ADAM9的miRNA中,只有hsa-miR-126-3p在胰腺癌组织中表达较低,提示miR-126在胰腺癌中可以靶向ADAM9。 2、miR-126-3P在胰腺癌中表达较低 通过qPCR检测到miR-126-3p在胰腺癌组织中的表达显著降低。 在胰腺癌细胞中PANC-1/SW1990/Canpan-1/AsPC-1/PC-3/MIAPaCa-2的表达显著低于正常胰腺癌细胞HPC-Y5。 miR-126-3p在胰腺癌细胞PANC-1中的表达最低。 3、miR-126-3P抑制胰腺癌细胞侵袭、转移,促进凋亡 miR-126-3p mimic组细胞的增殖能力、侵袭能力降低,凋亡能力增加; 相反, miR-126-3p inhibitor组细胞的增殖、侵袭能力增加,凋亡能力降低。 4、miR-126-3P靶向调控ADAM9表达 通过分析miR-126-3p 在ADAM9的3·UTR上有结合位点,报告基因实验证实miR-126-3p调控ADAM9,通过WB和qPCR验证miR-126-3p对ADAM9的调控作用。 5、miR-126-3P通过负向调控ADAM9抑制胰腺癌细胞侵袭、转移,促进凋亡 在胰腺癌细胞中,通过si干扰ADAM9的表达,可以降低细胞的增殖能力、侵袭能力和促进细胞凋亡; 与抑制miR-126-3p组相比,同时抑制miR-126-3p和干扰ADAM9可以抑制细胞的增殖、侵袭和促进凋亡。 6、分选BMSC及鉴定 通常认为CD29、CD44和CD71被认为是BMSC表达的标志,CD34和CD45被认为是造血干细胞标志物。 通过流式分析CD29(97.60%)、CD44(98.90%)、CD71(99%)阳性,HLA-DR(6.11%)、CD34(3.12%), CD45(2.41%)均为阴性,提示培养的细胞为BMSCs。 油红O染色验证了脂质成分的沉积,凸显了BMSC的脂质分化能力。 诱导培养3 天后,细胞呈短梭形,体积增大。培养第7天,细胞呈多角形,胞浆内可见钙颗粒。培养第14天,整个细胞充满钙颗粒,细胞呈菌落状生长。中心的细胞除了失去其典型的细胞结构外,还逐渐融合,形成透明的钙结节。 7、BMSC来源的外泌体携带miR-126-3p 通过超速离心方法分离BMSC来源的外泌体。 外泌体鉴定:电镜、NanoSightNS300、WB测CD63、HSP70 外泌体与PANC-1细胞共培养,miR-126-3p在BMSC、外泌体和PANC-1中升高,ADAM9降低。 8、GW4869抑制BMSC来源的外泌体释放,抑制miR-126-3p的表达 使用GW4869抑制外泌体的释放,可以抑制miR-126-3p的表达,促进细胞的侵袭。 9、BMSC来源的外泌体转移miR-126-3p到胰腺癌细胞,影响细胞生物学功能 与BMSCs-miR-126-3p NC 组相比, BMSCs-miR-126-3p mimic组细胞的移行、侵袭和增殖能力显著降低,凋亡能力增加。 WB检测结果显示MMP-14、COX-2、Ki67、VEGF的表达均降低。 10、过表达miR-126-3p抑制癌细胞增殖 通过皮下移植瘤实验证实miR-126-3p抑制移植瘤的增殖,肿瘤体积及重量均显著低于对照组;ADAM9表达; 肿瘤组织种ADAM9、MMP-14、COX-2的蛋白水平降低。 文献结论 BMSC来源的外泌体转移的miR-126-3p到胰腺癌细胞中,抑制ADAM9表达,抑制Ki67、COX-2、MMP-14的表达,抑制胰腺癌的侵袭、转移和增殖,促进其凋亡。 文献总结 优点: 1.文章现有数据库入手,通过生信分析手段得到miR-126-3p与ADAM9可能是潜在的调控胰腺癌恶性表型的分子。 2.文章不仅仅通过简单的改变胰腺癌细胞miR-126-3p的水平,更是通过BMSC外泌体转递miR-126-3p到胰腺癌细胞的方式检测miR-126-3p对胰腺癌细胞的生物学影响,为胰腺癌治疗提供新的思路。 不足: 文章证实miR-126-3p可以调控ADAM9的表达,影响胰腺癌的生物学功能,但是并未详细的证实ADAM9是如何影响胰腺癌细胞恶性表型。 研究思路总结 外泌体作为miRNA的载体,用于疾病治疗研究模式。 文献涉及的实验技术 关于晶莱 晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。







晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),组建了数十名来自全球知名高校的硕博研究生研发团队。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型,为生物医药公司、高校、医药搭建了多管线研发服务平台。
与国500+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。