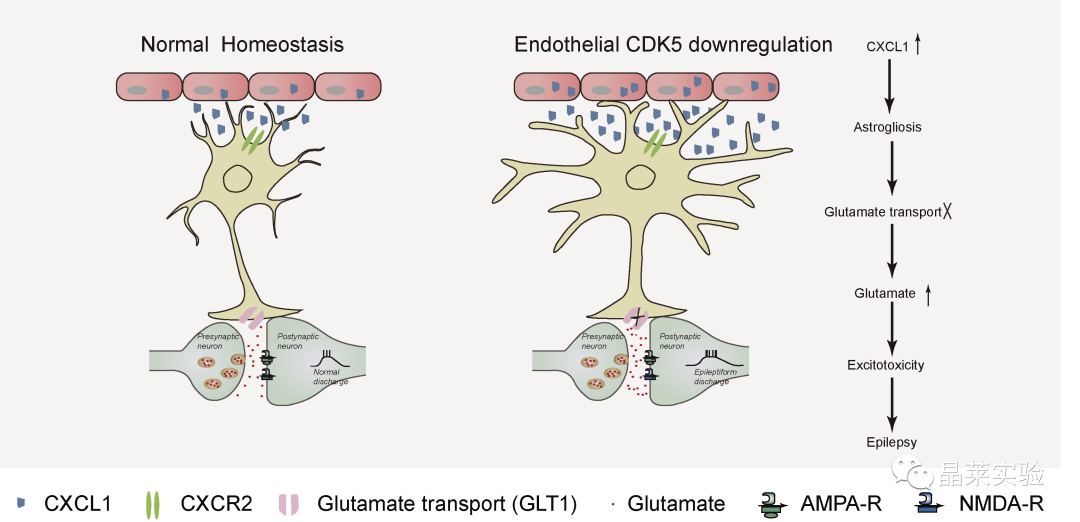
Endothelial Cdk5 deficit leads to the development of spontaneous epilepsy through CXCL1/ CXCR2-mediated reactive astrogliosis
内皮细胞Cdk5缺失通过CXCL1/CXCR2介导的反应性星形胶质细胞增生导致自发性癫痫的发展
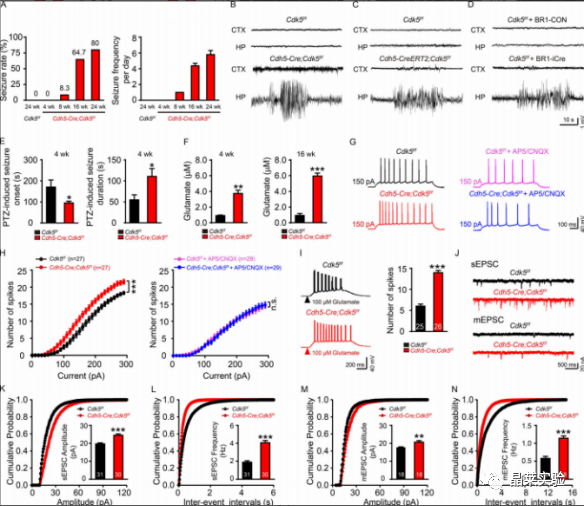
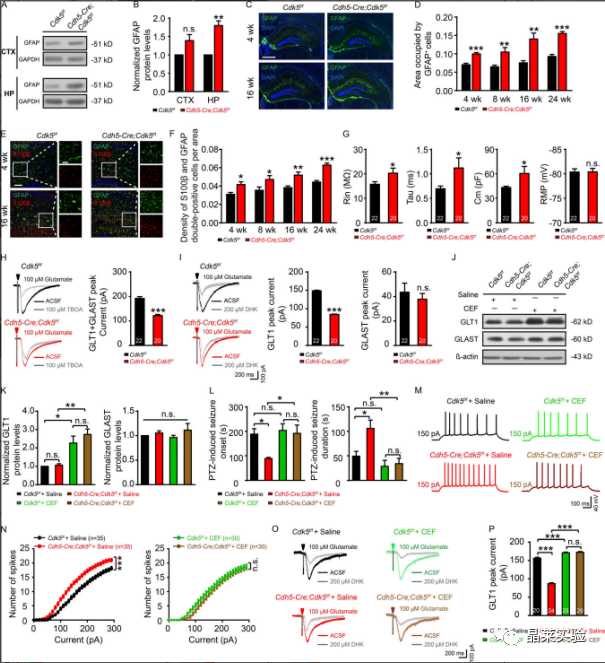
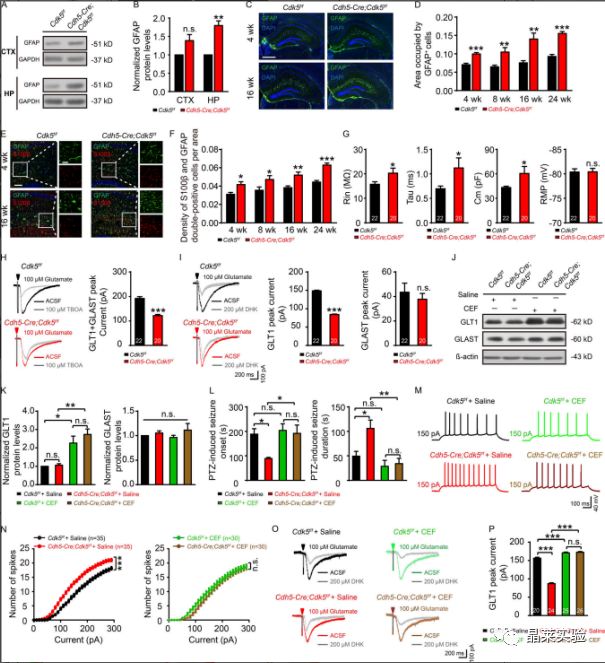
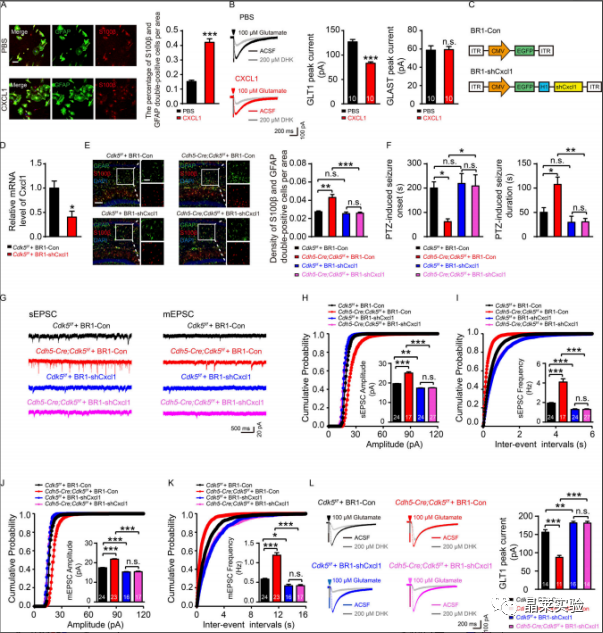
杂志:Journal of Experimental Medicine IF:14.307 研究背景 以反复发作为特征的癫痫,影响着全球6500-7000万人。尽管癫痫背后的过度兴奋性被认为是由突触兴奋和抑制的失衡引起的,直接针对神经元兴奋性的抗癫痫方法已被证明在大量患者中是不够的。这一不足表明,需要确定兴奋和抑制之间不平衡的原因。 针对这种失衡的潜在机制的药物可能被证明比目前的抗癫痫药物更有效。血脑屏障(BBB)处的微血管系统在维持大脑内稳态中起着重要作用。血脑屏障微血管功能障碍被认为与包括癫痫在内的大脑疾病有关。然而,将微血管病理与癫痫联系起来的分子机制仍然难以确定。细胞周期蛋白依赖性激酶5(CDK5)在多个生物过程中起着重要作用,包括细胞增殖、出芽和迁移。 CDK5能够抑制肝细胞癌和人内皮细胞的血管生成,并延缓内皮细胞衰老和动脉粥样硬化的发展。小鼠内皮特异性Cdk5KO也能抑制黑色素瘤的生长,提高抗血管生成治疗的敏感性。 到目前为止,对癫痫患者微血管功能的研究还不广泛,也缺乏实验性的微血管病理相关癫痫模型。 文章主要内容 1. 文献研究发现小鼠内皮特异性Cdk5KO诱导了一种年龄依赖性的自发性海马癫痫放电。 2. 研究结果进一步表明,内皮细胞Cdk5缺失通过内皮趋化因子(C-XCmotif)配体1(CXCL1)及其受体趋化因子受体2(CXCR2)诱导的进行性反应性星形胶质细胞增生,下调了星形胶质细胞glt1介导的电流。 3. GLT1功能的降低增加了谷氨酸突触电流,因此,可能导致癫痫的发展。 研究结果及分析 1、内皮细胞Cdk5条件缺失诱发自发性癫痫发作 A:不同年龄的Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠的自发性癫痫发作率和频率; B-D:Cdk5f/f和Cdh5-Cre中皮层(CTX)和海马(HP)记录的典型脑电图; E:PTZ诱导的Cdh5-Cre;Cdk5f/f和Cdk5f/f小鼠在第4周时的癫痫发作潜伏期和持续时间; F:Cdh5-Cre;Cdk5f/f和Cdk5f/f在4周(左)和16周(右)小鼠海马谷氨酸浓度; G:在4周龄的Cdh5-Cre;Cdk5f/f/f和Cdk5f/f小鼠中,在有150pA或没有AP5(20mM)和CNQX(40mM)的正电流注射治疗的AP反应的示例痕迹; H:0-300pA10-pA电流注射的定量; I:Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠经500ms处理后诱导的代表性痕迹和AP放电频率; J:在Cdh5-Cre;Cdk5f/f和Cdk5f/f/f小鼠中记录的sEPSC和mEPSC的痕迹; K-N:累积概率图总结sEPSC平均振幅。 这些数据表明,EC中Cdk5的选择性缺失会增加CA1神经元的过度兴奋性和癫痫发作的产生。 2、内皮 Cdk5 缺失导致进行性星形胶质细胞增多和星形细胞谷氨酸摄取减少 A&B:GFAP的代表性WB检测; C-F:Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠在第4周和第16周时海马中GFAP(绿色、C)和S100β(红色、E)免疫染色的合成图像; G:在Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠的海马星形胶质细胞中记录的固有膜特性,包括Rin、τm(Tau)、Cm和RMP; H&I:在Cdh5-Cre、Cdk5f/f和Cdk5f/f中100µM TBOA(H)或200µM DHK(I)小鼠的脑切片中注射100µM谷氨酸500 ms后,评估星形胶质细胞对谷氨酸的摄取; J&K:星形胶质细胞中GLT1和GLAST的wb检测和表达定量分析; L:PTZ诱导的Cdh5-Cre;Cdk5f/f/f和Cdk5f/f小鼠在4周时的癫痫发作潜伏期和持续时间; M:Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠在150pA加生理盐水或CEF的正电流注射处理后AP反应的代表性痕迹; N:在10-pA步骤中进行0-300-pA电流注射的定量; O:4周龄Cdh5-Cre、Cdk5f/f/f和Cdk5f/f有无CEF小鼠海马中DHK孵育后的代表性GLT1转运电流; P:定量分析CEF给药对GLT1转运电流的影响。 上述结果表明在Cdh5-Cre中观察到的表型;Cdk5f / f小鼠至少部分地由海马星形胶质细胞中GLT1功能的降低引起,并且可以通过增加GLT1表达来逆转它们。 3、趋化因子CXCL1的表达在Cdh5-Cre中增加;Cdk5f/f 鼠标 A:内皮细胞Cdk5缺失对4周和16周小鼠血脑屏障渗漏的影响; B:Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠海马中生物细胞素-TMR、蓝色、40kd右旋糖酐和凝集素阳性微血管的共聚焦显微镜图像; C:Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠海马中纤维蛋白原和IgG和凝集素阳性微血管的共聚焦显微镜图像; D:Cdh5-Cre、Cdk5ff/f和Cdk5f/f小鼠在第4周和第16周时海马内皮紧密连接的透射电镜图像; E:Cdh5-Cre、Cdk5f/f和Cdk5f/f小鼠在16周时微血管中紧密连接蛋白变化的Wb检测和定量分析; F:Cdh5-Cre、Cdk5f/f和对照组小鼠海马中Glut1和ZO-1的双免疫染色。通过微血管进行z-叠加,以确认ZO-1与内皮标记物Glut1的共定位; G:Cdh5-Cre、Cdk5f/f与对照组小鼠中所有差异表达基因的热图; H:来自4周龄的Cdh5-Cre;Cdk5f/f和Cdk5f/f小鼠分析的RNA测序谱的IGV基因组浏览器视图; I:采用qRT-PCR检测Cdh5-Cre、Cdk5f/f和Cdkf5f/f小鼠4周时脑微血管中趋化因子的表达; J:ELISA检测CXCL1蛋白水平; K:各组海马CA1锥体层中Cxcl1探针和CD31标记结果图。 4、CXCL1的沉默阻止了内皮细胞cdk5缺陷小鼠海马神经元的过度兴奋性 A:在PBS和重组CXCL1孵育6h后,原代培养的Cdk5f/f小鼠海马星形胶质细胞的免疫染色图和相应的GFAP与S100β定量; B:重组CXCL1 6h培养组和对照组在吸入100µM谷氨酸500 ms后,检测原代培养的海马星形胶质细胞对谷氨酸的摄取情况; C:AAV-BR1结构示意图表明两端的反向末端重复序列(ITR)和CMV启动子驱动EGFP(BR1-Con)或CMV启动子驱动shCxcl1与EGFP D:在BR1-Con-和BR1-shCxcl1注射Cdk5f/f小鼠的第4周时,检测原代培养的脑微血管ec中Cxcl1的相对mRNA水平; E:注射BR1-Con和Cdk5f/f和Cdh5-Cre;Cr1和shCdk5f/f小鼠中GFAP和S100β的共聚焦图像及定量; F:PTZ诱导的Cdk5f/f和Cdh5-Cre;注射CR1-Con和BR1-shCxcl1的小鼠的癫痫发作潜伏期和持续时间; G:在注射BR1-Con-和BR1-shcxcl1的小鼠中记录了sEPSC和mEPSC; H-K:累积概率图对sEPSC平均振幅的总结; L:注射BR1-Con和BR1-shCxcl1的Cdh5-Cre和Cdk5f/f/f小鼠海马中DHK孵育后的代表性GLT1转运电流。 这些结果为内皮CXCL1在内皮Cdk5 KO小鼠表型中的作用提供了进一步的证据。这些发现可能有助于深入了解EC与星形胶质细胞之间与突触稳态和/或神经系统疾病病理机制相关的相互作用。 5、内皮细胞CXCL1通过CXCR2调节星形胶质细胞中的星形胶质细胞增生和星形胶质细胞谷氨酸摄取。 A:Cdh5-Cre;Cdk5f/f和Cdk5f/f小鼠第4周时CA1中星形胶质细胞中CXCR2表达的免疫染色图; B:GFAP-Cre依赖的AAV载体CXCR2沉默示意图; C:在4周时注射病毒的Cdh5-Cre;Cdkff/f和Cdk5f/fCdk小鼠海马中CXCR2的表达检测及定量分析; D:注射病毒混合物的5-Cdhe;Cdk5f/f/f和Cdk5f/f小鼠海马星形细胞CXCR2表达的免疫染色图; E:在Cdh5-Cre-Cre;Cdk5f/f和Cdk5f/f小鼠中评估PTZ诱发癫痫的发作潜伏期和持续时间; F&G:各组海马CA1区锥体神经元的代表性sEPSC(F)和mEPSC(G)痕迹; H&I:指定组小鼠的sEPSC的振幅和事件间间隔的累积概率图; J&K:所示组小鼠mEPC的振幅(J)和事件间间隔(K)的累积概率图; L:在指定组的4周龄小鼠的海马中,DHK孵育后的代表性GLT1转运电流(左)。右侧显示了GLT1传输电流的量化。 上述研究结果支持一种工作模型,其中CXCL1通过激活星形胶质细胞上的CXCR2受体来减少GLT1介导的谷氨酸摄取。 文献总结 本文揭示了内皮来源的Cdk5信号在大脑中先前未知的功能。内皮细胞Cdk5缺乏症以年龄依赖性的方式诱发自发性癫痫。这种效果与glt1介导的谷氨酸摄取减少和海马锥体神经元兴奋性的增加有关。 结果进一步表明,这些作用依赖于ECs释放CXCL1,以及随后通过CXCL1激活星形胶质细胞CXCR2受体。重要的是,这些作用可以通过GLT1功能(CEF)的药理恢复、CXCL1的基因沉默或免疫中和化,或抑制星形胶质细胞上的CXCL1受体CXCR2来逆转。 这些发现为进一步研究内皮细胞Cdk5及其下游通路作为癫痫治疗的潜在新靶点提供了依据。 文献涉及实验技术 关于晶莱 晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。

晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),组建了数十名来自全球知名高校的硕博研究生研发团队。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型,为生物医药公司、高校、医药搭建了多管线研发服务平台。
与国500+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。