DNAJB8 in small extracellular vesicles promotes Oxaliplatin resistance through TP53/MDR1 pathway in colon cancer
小细胞外囊泡中的DNAJB8通过TP53/MDR1途径促进结肠癌中的奥沙利铂耐药性

Journal :cell death & disease
IF:9.685
研究背景
•结肠癌是全球最常见的癌症之一,近些年总体发病率和死亡率一直在下降;然而,结肠癌的预后仍然很差。鉴定新型有效的化疗药物或提高抗结肠癌药物的疗效将对结肠癌治疗非常有帮助,特别是对于晚期结肠癌。
•奥沙利铂(L-OHP)是常规用于治疗复发风险高的结肠癌患者或晚期或转移性疾病患者。然而,接受 L-OHP 治疗的患者中有很大一部分变得化学耐药。因此, 了解 L-OHP 耐药的潜在机制至关重要。
•小细胞外囊泡(sEV)是直径为40-150nm的纳米囊泡。它们通过与质膜融合通过内体囊泡途径释放到细胞外环境中。多种细胞分泌sEV,包括T/B、上皮细胞、树突状细胞和肿瘤细胞。sEV对于细胞间通讯至关重要。来源于肿瘤的sEV包括递送DNA片段、RNA、蛋白质和脂质,据报道,这些片段、DNA片段、蛋白质和脂质在癌症进展中起主要作用,包括化学阻滞性。然而,来自耐药结肠癌细胞的sEV是否可以对敏感细胞产生耐药性,需要阐明。
•DNAJ(热休克蛋白40 [HSP40])同源物,亚科B,成员8(DNAJB8)属于DNAJ/HSP40蛋白家族,其调节伴侣HSP70活性。DNAJB8通过其C端尾部抑制聚谷氨酰胺蛋白的聚集。最近,有报道称DNAJB8是睾丸癌抗原和参与肾细胞癌的癌症干细胞样细胞抗原。我们之前的比较基因组杂交数据显示,与原发性肿瘤相比,DNAJB8基因在转移性结肠癌中的表达更高。
文献主要研究内容
1.DNAJB8在抗L-OHP的COAD细胞中过表达 。
2.DNAJB8沉默使COAD细胞对L-OHP化疗敏感 。
3.DNAJB8在抗L-OHP的COAD细胞中与TP53相互作用 。
4.DNAJB8与COAD中TP53/MDR1通路表达呈正相关 。
5.血清中的 DNAJB8 水平与 COAD 患者的 L-OHP 反应相关 。
6.小细胞外囊泡的DNAJB8转移在COAD中得到证实 。
7.sEV对DNAJB8的细胞间转移增加L-OHP耐药性。
研究结果及分析
1.DNAJB8在抗L-OHP的COAD细胞中过表达
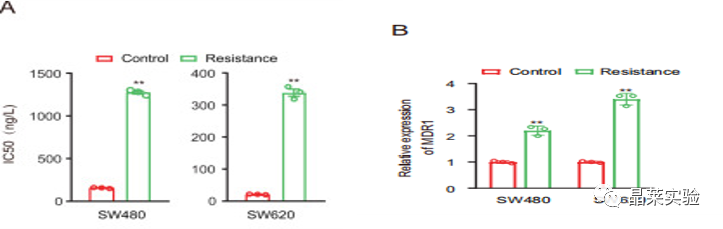
IC50:指被测量的拮抗剂的半抑制浓度。它能指示某一药物或者物质(抑制剂)在抑制某些生物程序(或者是包含在此程序中的某些物质,比如酶,细胞受体或是微生物)的半量。
图B qRT-PCR显示,与亲本细胞相比,ATP结合盒转运蛋白家族成员P-糖蛋白(P-gp)的超家族的mRNA和蛋白质表达在化学抗性细胞中上调这表明L-OHP耐药结直肠癌细胞系的建立是成功。
P-gp:P糖蛋白是一种能量依赖性药物排出泵,也就是说它可以与一些抗肿瘤药物结合,一旦与抗肿瘤药物结合,通过ATP提供能量,就可将药物从细胞内泵出细胞外,使药物在细胞内浓度不断下降,并使其细胞毒作用减弱直至散失,出现耐药现象。
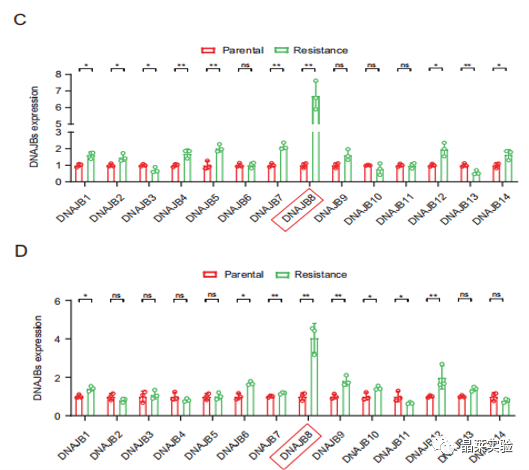
图C 图D评估了所有DNAJB家族蛋白在SW620 / L-OHP和SW480 / L-OHP细胞中的表达。与亲本细胞相比,DNAJB8是L-OHP抗性细胞中表达最强的DNAJB。
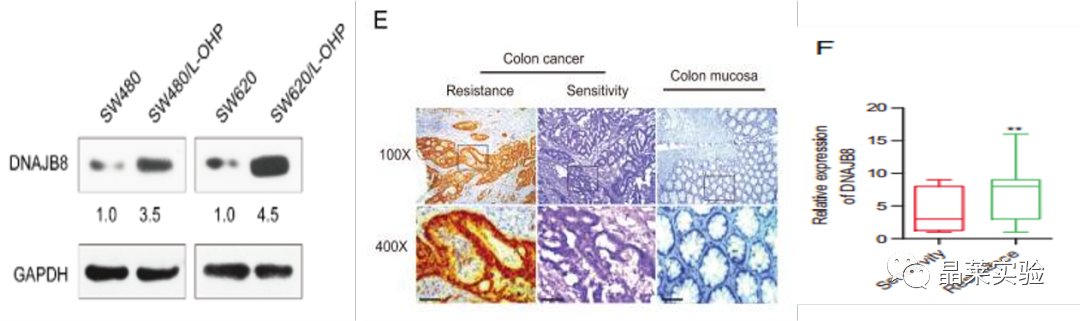
图S1通过WB分析,与亲本细胞相比,L-OHP抗性细胞中表达DNAJB表达高于亲本细胞表达。
图E 免疫组化(IHC)在220名接受术后L-OHP化疗的COAD患者中定量了DNAJB8的表达。根据应答评估标准,将患者分为应答组和非应答组。我们发现,无反应患者的DNAJB8表达水平远高于有应答患者。
图F DNAJB8在有应答和无应答组患者的表达。
2.DNAJB8沉默使COAD细胞对L-OHP化疗敏感
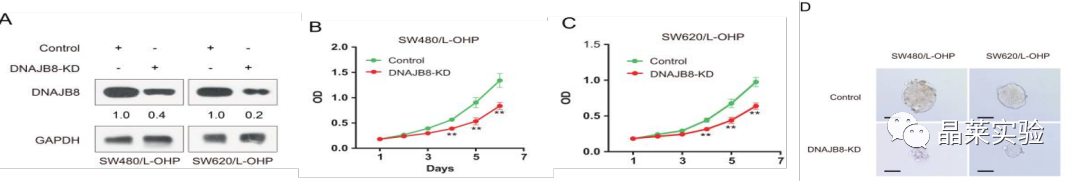
图A显示,siRNA转染后,通过蛋白质印迹法在L-OHP抗性COAD细胞中检测到DNAJB8表达。
图B、C显示SW620 / L-OHP和带有DNAJB8敲低的SW480 / L-OHP细胞接种用于细胞增殖。
图D肿瘤乳球形成测定:成球能力是肿瘤干细胞体外鉴定的一个重要方法。其判断的是单个细胞在合适的条件培养基中自我更新的能力,一般用细胞球形成效率。
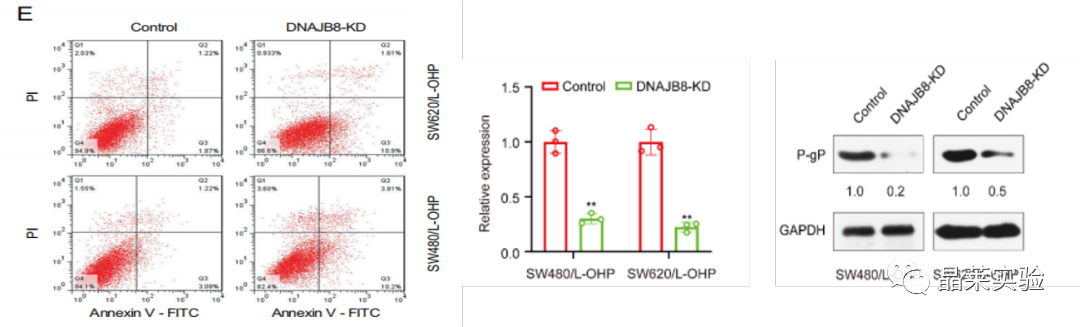
E图:流式检测两株细胞的凋亡。
S2 A DNAJB8沉默后,采用qRT-PCR分析MDR1(P-gP)的表达
S2 B DNAJB8沉默后,采用WB分析P-gP的表达。
这些数据表明,P-gP对COAD中DNAJB8介导的L-OHP耐药性非常重要。
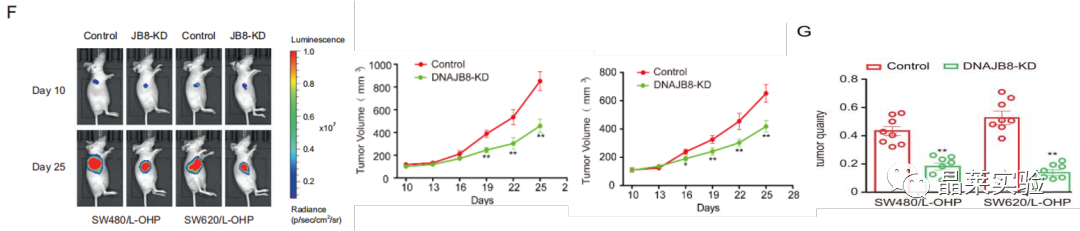
F G图:皮下异种移植测定注射DNAJB8敲低L-OHP抗性细胞和对照细胞,并检测移植肿瘤重量。
图S2 C D:DNAJB8敲低SW620 / L-OHP和SW480 / L-OHP细胞与对照组肿瘤体积比较。
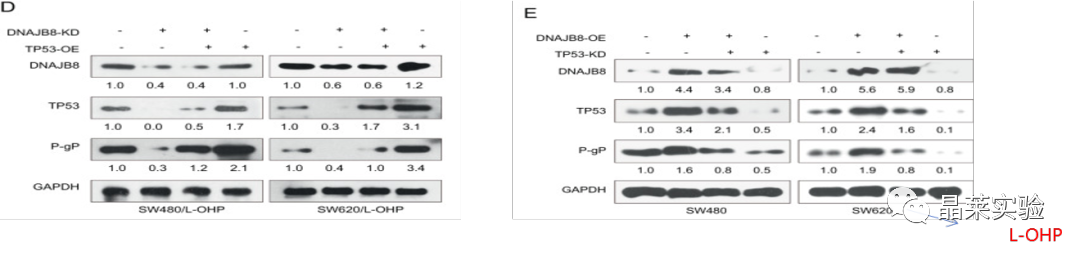
3.DNAJB8 促进 TP53 在抗 L-OHP COAD 细胞中的稳定性
先前的数据显示,HSP40家族蛋白(DNAJB8属于DNAJ/HSP40)蛋白家族可影响TP53在乳腺癌和COAD细胞中的蛋白表达。
基于越来越多的证据表明MDR1作为几种癌症的靶基因之一参与TP53信号通路。
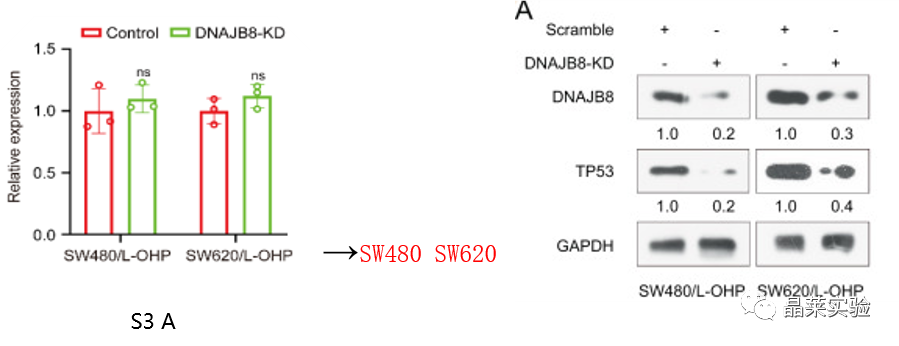
S3 A图:在DNAJB8敲低后,使用qTR-PCR TP53在SW480和SW620细胞系评估TP53的mRNA表达没有受到影响。
图A:当DNAJB8在SW480 / L-OHP和SW620 / L-OHP细胞中被敲低时,TP53的蛋白质表达显着下调。
图B C:使用荧光素酶报告基因测定:MDR1启动子ID2 和CXCL5结合活性通过TP53在L-OHP抗性结肠癌细胞和亲本结肠癌细胞的表达。
荧光素酶报告基因测定:上游刺激对下游靶基因在转录水平的影响,即对靶基因mRNA表达水平的影响,可以通过实时荧光定量PCR来验证;
Western blot是测定上游刺激对下游靶基因对应的蛋白表达水平的影响。
启动子结合活性:使下游基因顺利转录成mRNA的能力。
S3 B C:使用荧光素酶报告基因测定在L-OHP耐药结肠癌细胞检测TP53的(B)ID2和(C)CXCL5启动子结合活性。
D 使用TP53(R273H)过表达载体和DNAJB8敲低L-OHP抗性结肠癌细胞。通过WB检测两者表达影响。
E 图使用TP53(R273H)特异性siRNA恢复DNAJB8过表达L-OHP耐药结肠癌细胞。通过WB检测两者表达的影响。
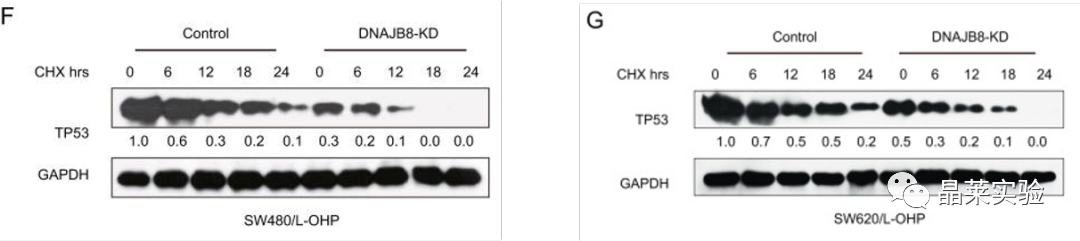
F G:为了确定DNAJB8是否调节TP53蛋白稳定性,我们用环己酰亚胺(CHX)处理L-OHP抗性细胞以阻断蛋白质合成,然后评估TP53降解的速率,结果表面DNAJB8敲低细胞中TP53降解的速度显着高于对照细胞(表明DNAJB8可以控制TP53蛋白水平。
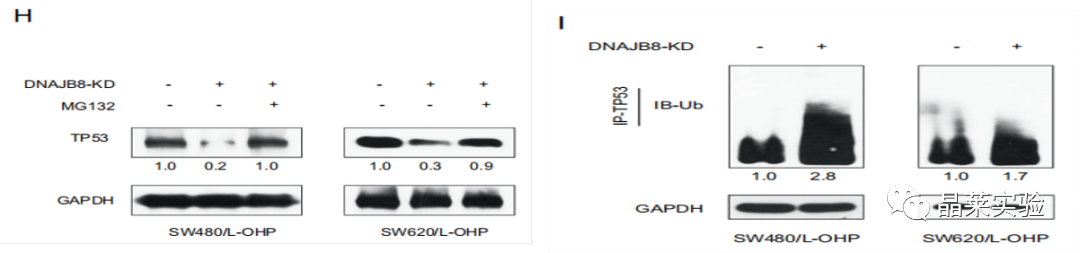
H图:考虑到TP53是一种被蛋白酶体降解的不稳定蛋白质,我们推测DNAJB8可能通过泛素降解途径影响TP53的稳定性。事实上,当用蛋白酶体抑制剂MG132处理DNAJB8敲低SW480 / L-OHP和SW620 / L-OHP细胞时,TP53蛋白表达没有进一步降低。
I图:免疫沉淀实验,结果表明,当DNAJB8被抑制时,TP53多泛素化增加。
泛素化是指泛素(一类低分子量的蛋白质)分子在一系列特殊的酶作用下,将细胞内的蛋白质分类,从中选出靶蛋白分子,并对靶蛋白进行特异性修饰的过程。
泛素-蛋白酶体途径是是较普遍的一种内源蛋白降解方式。需要降解的蛋白先被泛素化修饰,然后被蛋白酶体降解。
表明DNAJB8通过泛素化途径抑制TP53降解。
4.DNAJB8在抗L-OHP的COAD细胞中与TP53相互作用
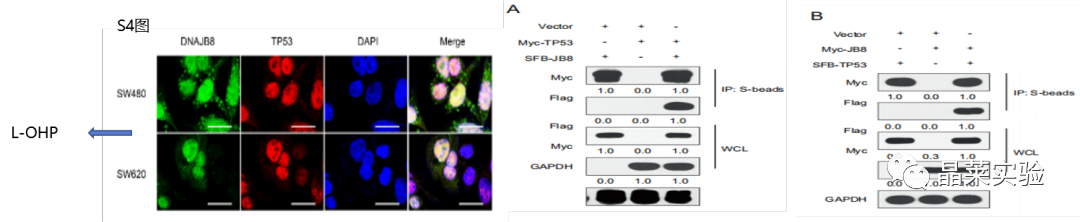
S4图:使用共聚焦显微镜在L-OHP抗性癌细胞中评估DNAJB8和TP53的共定位。
图A:外源表达的DNAJB8与TP53免疫共沉淀。
图B:内源性免疫共沉淀实验,并检测到含有DNAJB8和TP53的复合物。
将计划研究的一种蛋白质的抗体与细胞提取液孵育,以使抗体和蛋白质在溶液中结合。
然后用蛋白 A/G 耦合的琼脂糖凝胶,从样品中将抗体 / 抗原复合物提取出来。这种物理方法可将所需蛋白质从样品中分离出来。然后样品可以通过 SDS-PAGE 分离出来进行 Western blot 分析。

图C:使用S-蛋白琼脂糖进行免疫沉淀(IP ),并用所示抗体进行蛋白质印迹重组GST标签表达的TP53 (R273H)与异位表达的DNAJB8免疫沉淀,表明DNAJB8在体外直接与TP53结合。
图D:AlphaLISA检测在SW480/L-OHP和SW620/L-OHP细胞中进行了特异性检NDAJB 8–TP53相互作用,用GST或GST-TP53融合蛋白包被的珠子与SFB-DNAJB8蛋白一起孵育过夜。用指定的抗体对GST下拉进行免疫印迹。
AlphaLISA技术是基于增强的化学发光的一种均相免疫检测,利用作为供体和受体的微珠来进行生物分子的检测。如果样品中存在检测目标,供体微珠和受体微珠会由于抗体的特异性识别而相互接近,从而激发受体微珠上级联放大的化学发光反应,最后将信号传递到铕(yǒu)上,产生信号
E图:DNAJB8敲除的SW480/L-OHP和SW620/L-OHP细胞中,内源性DNAJB 8–TP53相互作用显著降低。
F G图:DNAJB8和TP53之间以结合相对发光单位表示的结合信号,结果表明,随着siRNA浓度增高 DNAJB8和TP53结合作用显著降低。
这些数据强烈表明DNAJB8在体内和体外直接结合TP53。
5.DNAJB8与COAD中TP53/MDR1通路表达正相关
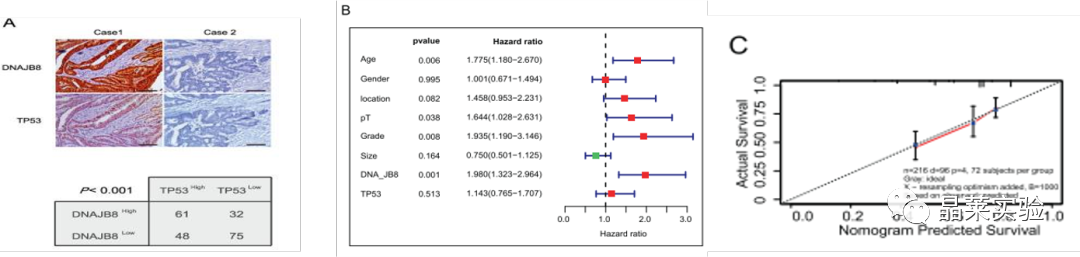
图A:IHC结果显示DNAJB8和TP53共定位在结肠肿瘤细胞的细胞核上。统计分析显示,DNAJB8和TP53在被测COAD组织中的表达呈显著正相关。
图B:COX回归模型:该模型以生存结局和生存时间为因变量,可同时分析众多因素对生存期的影响,能分析带有截尾生存时间的资料,且不要求估计资料的生存分布类型。
图C:根据校准曲线,观测3年,5年和7年总生存期(OS)的概率,预测值与观察到的值一致。
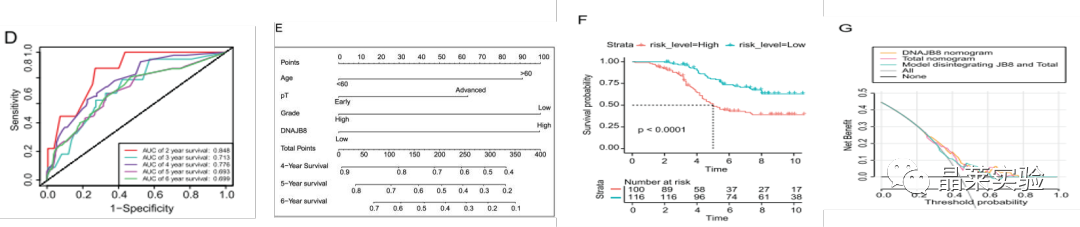
图D:ROC 曲线 (AUC) 值下 2 年、3 年和 4 年生存率的面积分别为 0.848、0.713 和 0.776。
图E;根据列线图模型中的每个预测变量计算总风险评分。
Kaplan-Meier分析显示,高风险评分患者的OS(总体生存期)明显比低风险评分的患者差。
Kaplan-Meie(单因素生存分析):可用于研究1个因素对于生存时间的影响,在医疗领域中使用广泛。
诺莫图(Nomogram图),它是建立在多因素回归分析的基础上,将多个预测指标进行整合,然后采用带有刻度的线段,按照一定的比例绘制在同一平面上,从而用以表达预测模型中各个变量之间的相互关系。
6.血清中的 DNAJB8 水平与 COAD 患者的 L-OHP 反应相关
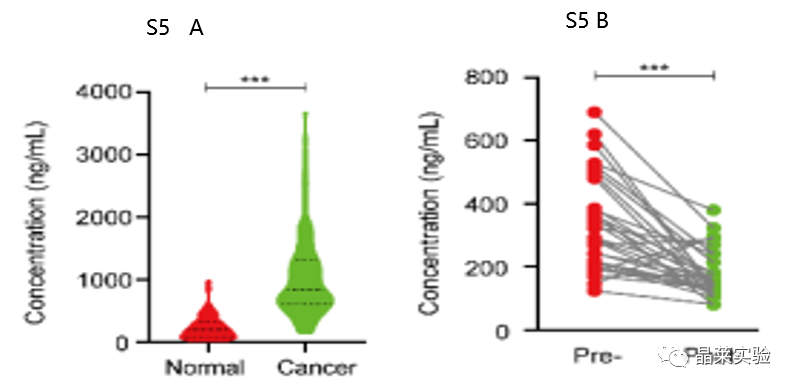
S5 A:采用ELISA法检测COAD患者和健康者血清DNAJB8水平。
S5 B:COAD患者肿瘤切除前后血清中DNAJB8的ELISA分析。
表明血清DNAJB8主要由COAD细胞产生。
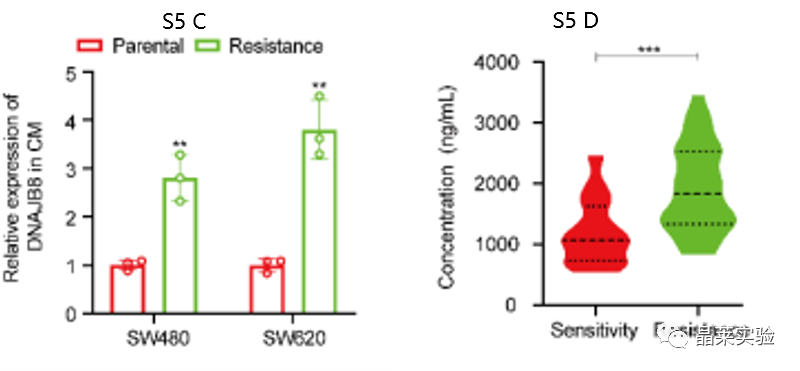
S5 C:l-ohp耐药和亲本COAD细胞CM中DNAJB8的ELISA分析。
图S5 D:治疗前血清中DNAJB8的平均水平在无反应者中高于应答者。
探索了血液循环DNAJB8是否可以预测COAD患者对L-OHP的反应。
7.小细胞外囊泡的DNAJB8在COAD中转移
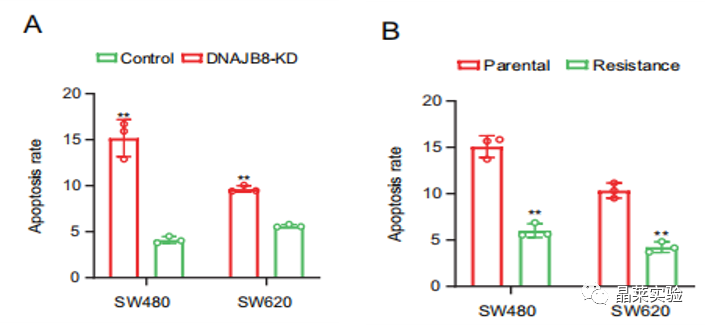
图A:L-OHP抗性细胞和DNAJB8-敲低抗性细胞和亲本细胞共培养中检测到细胞凋亡率。
亲本细胞L-OHP抗性没有增加。
图B:亲本细胞和L-OHP抗性细胞共育的亲本细胞中检测到凋亡率
AB结果表明,细胞外DNAJB8被转移到亲本细胞,促进COAD细胞的L-OHP抗性。
研究细胞外DNAJB8在L-OHP抗性细胞中的表达模式
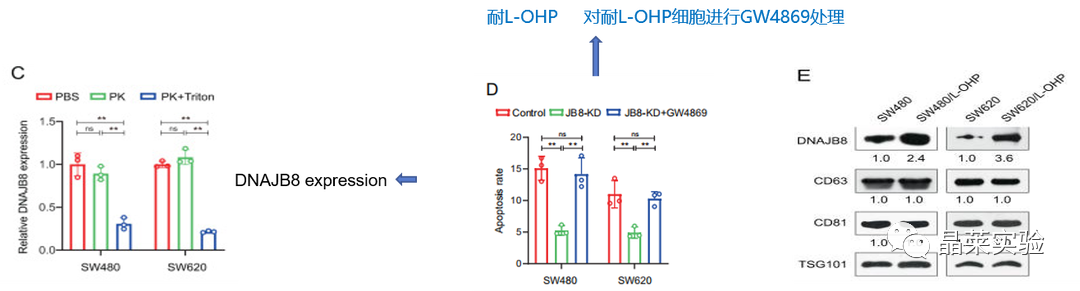
图C通过ELISA测定法:蛋白酶K处理后,CM中DNAJB8的水平没有变化,但同时使用蛋白酶K和Triton X-100时DNAJB8表达显着降低。
蛋白酶K:强力蛋白溶解酶
Triton X-100:一种比较温和的去垢剂(表面活性剂或称界面活性剂),常作为添加剂使蛋白保持稳定,尤其是膜蛋白
sEV(即 small extracellular vesicle,小细胞外囊泡):包括起源于内吞途径外泌体,直接从质膜释放微粒/微囊泡,由细胞凋亡产生的凋亡小体;肿瘤小泡(由肿瘤细胞释放产生)
图D:使用ELISA测定法分析 DNAJB8在GW4869(sEV抑制剂)处理的L-OHP细胞的CM中的表达,结果表明L-OHP抗性细胞和亲本细胞之间的L-OHP抗性没有差异。
图E:从COAD细胞中提取了sEV。使用蛋白质印迹测定,检测sEV蛋白标记CD63,CD81和TSG101。
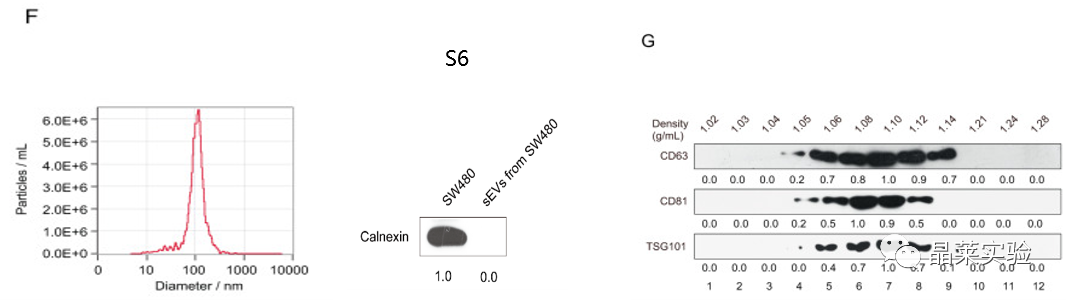
F图:使用NTA方法验证了结肠癌细胞的sEV的大小,发现sEV的尺寸在40到150nm之间,与之前报告的 sEV 大小一致。
纳米颗粒跟踪分析(NTA):NTA技术已被外泌体研究领域认可为外泌体表征手段之一。
图S6:通过western blot检测SW480细胞和SW480细胞的sEV中的Calnexin(内质网内Ⅰ型膜蛋白)。
Calnexin:一种胞外蛋白,不存在于外泌体中,而是存在于其他类型的囊泡中,这意味着产量仅由外泌体组成。
图G:使用OptiPrep™密度梯度纯化sEV。收集密度增加的部分,并用WB检测 CD63,CD81和TSG101的表达。
OptiPrep:一款密度梯度离心液,推荐用于分离和纯化DNA或RNA病毒,细胞器如细胞核、线粒体、内小体或外泌体、大分子和一些细胞类型。
如图所示sEV在6-8级分中富集,相当于1.08-1.12 g / mL的密度。该密度与先前报道的对不同细胞类型的研究一致。

图H:采用透射电镜对从第7级分(密度1.10 g/mL)获得的sEV进行验证,显示囊泡在大小和形态上与sEV一致。
图I:,WB检测显示来自L-OHP抗性COAD细胞的sEV中的DNAJB8水平显着高于来自亲本细胞的DNAJB8水平。
8.sEV对DNAJB8的细胞间转移增加L-OHP耐药性
图A:通过WB检测在亲本细胞中与来自耐药细胞的sEV一起孵育的DNAJB8表达。结果表明DNAJB8的细胞内水平在与来自L-OHP抗性细胞的sEV孵育时增加,但在与来自DNAJB8敲低L-OHP抗性细胞的sEV孵育时没有增加。
受体细胞中DNAJB8水平的增加不受RNA聚合酶II抑制剂放线菌素D的影响,不包括内源性诱导的参与
图B:通过蛋白质印迹测定在亲本细胞中与来自放线菌素D(ActD)处理的耐药细胞的sEV孵育中检测DNAJB8表达。
放线菌素D是由放线菌产生的多肽抗生素。放线菌素D主要作用于RNA,抑制RNA的合成,高浓度时则同时影响RNA与DNA 合成
图C:用PKH67分离并标记了sEV。在与标记的sEV孵育后,在受体细胞中观察到PKH67和COAD细胞的共定位,进一步研究了sEV转移的DNAJB8是否可以将耐药表型赋予受体COAD细胞。
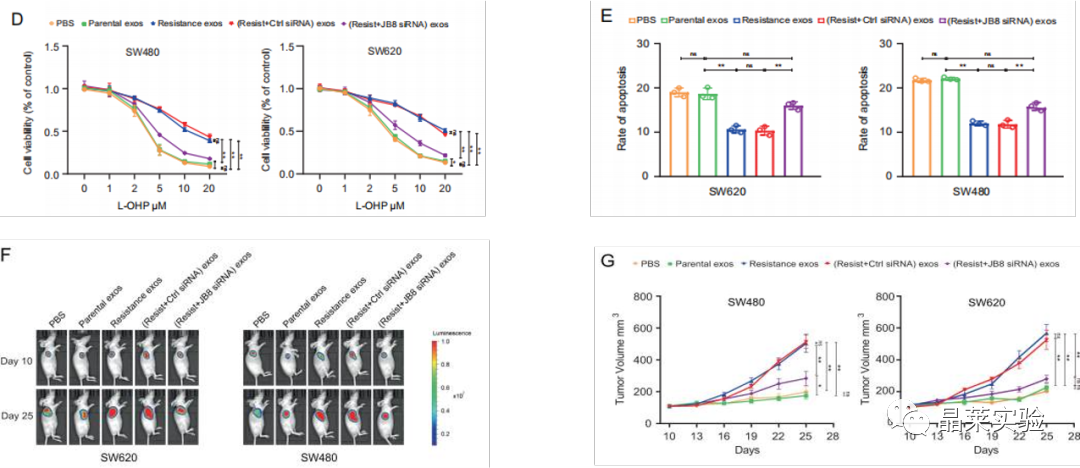
图F G:在L-OHP治疗下,在肿瘤内注射将来自L-OHP抗性细胞和亲本细胞的sEV的外泌体,对裸鼠的SW480和SW620细胞进行皮下异种移植测定。
图D E:L-OHP抗性细胞的与亲本细胞sEV共孵育评估细胞凋亡和增殖。
共培养的肿瘤形成、细胞凋亡和增殖测定中,亲本细胞直接与来自L-OHP抗性细胞的sEV一起孵育,显示出对L-OHP的敏感性降低。
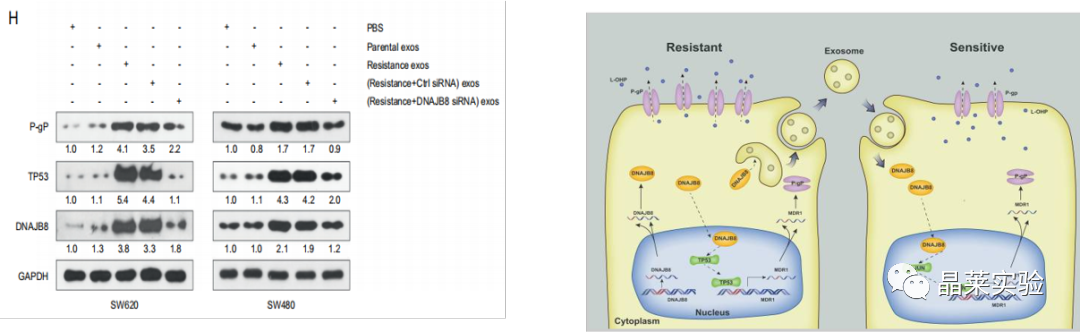
H图:在L-OHP抗性细胞的sEV孵育的亲本COAD细胞中检测到TP53和P-gP表达。
H图表明,DNAJB8可能通过体内的P53 / MDR1信号通路调节L-OHP抗性。
基于sEV DNAJB8通路在CRC L-OHP电阻中的示意图。
在亲本细胞中,来自L-OHP抗性COAD细胞的sEV介导的DNAJB8转移通过结合和抑制TP53的泛素化来促进L-OHP抗性,导致P-gP表达增加和L-OHP外排上调。
文献结论
血清sEV中的DNAJB8水平可作为COAD的生物标志物。来自sEVs的DNAJB8可能是L-OHP耐药的有希望的治疗靶点和临床反应的预后预测因子。
文献系统地探讨了DNAJB8敲低对细胞和基于细胞系的异种移植物中L-OHP敏感性的影响,表明这种治疗方法可用于L-OHP抗性COAD。
文献总结
优点:
1.逻辑证明严谨,运用较多的实验方法去丰富自己的实验结果。
2.运用了较多常用的生物学分析方法如COX回归模型、OS校准曲线、ROC 曲线、风险评分模型、单因素生存分析 、诺莫图。
不足:
1.DNAJB8如何影响到TP53泛素化增加,需进一步阐明。
2. 对于TP53和MDR1两者之间的之间作用关系尚不明确。
3.外泌体对DNAJB8如何成功转运需要进行进一步验证。
文献涉及实验技术

关于晶莱
晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前非GLP的CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),组建了数十名来自全球知名高校的硕博研究生研发团队。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型,为生物医药公司、高校、医药搭建了多管线研发服务平台。
与国500+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。

晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。