Targeting UHRF1-SAP30-MXD4 axis for leukemia initiating cell eradication in myeloid leukemia
在骨髓性白血病中,靶向UHRF1-SAP30-MXD4可消除白血病起始细胞

影响因子:46.2
期刊:Cell Research
研究背景
急性髓系白血病(AML)是一种异常造血干细胞/祖细胞的克隆性恶性肿瘤,其特征是骨髓中未成熟髓系细胞的增加。AML是成人中最常见的急性白血病,发病率为每10万人中有2.7人,AML患者的5年总生存率仍为25%-40%。对于不适合强化化疗的老年患者和复发或难治性AML患者,预后更差。
不同AML亚型根据白血病母细胞中正常分化受阻的阶段分类(M0-M7),频繁发生的染色体易位也是AML改进分类的基础。
在这些易位中,产生白血病融合基因AML1-ETO的(属于M2亚型)是AML中最常见的易位。具有易位导致MLL基因重排的AML,如MLL-AF9(属于M5亚型),具有高侵袭性和化疗耐药性。
白血病起始细胞的一个重要特征是自我更新的不断增强,目前的化疗是许多存在染色体易位的AML患者的主要治疗方法,一些针对AML的靶向治疗药物,如FLT3抑制剂米多妥林和吉立替尼,专门靶向FLT3激酶,以及异柠檬酸脱氢酶IDH1/IDH2抑制剂I伏西迪尼和依那西迪尼分别靶向IDH1R132H和2-羟基戊二酸,已在临床测试。
在白血病发生中发挥重要作用的表观遗传调控因子经常被异常表达。MLL-AF9融合蛋白已被证明通过异常影响表观遗传调控因子(如Dot1L)和转录调控因子(如Meis1、HoxA9、Runx1和Id1)来诱导白血病发生。AML1- ETO融合转录因子也具有异常的转录激活和抑制特性,主要是在一个含有AML1-ETO的复合物(AETFC)中发挥作用。
UHRF1是一种表观遗传调控因子,它通过SRA结构域直接与DNMT1相互作用,是维持DNA甲基化所必需的。研究表明,UHRF1可控制成体神经干细胞的自我更新,对于维持表皮祖细胞的增殖和抑制表皮的过早分化至关重要。还可以通过调节细胞分裂模式来控制造血干细胞(HSCs)的自我更新和分化。另一方面,UHRF1也可以调节癌症的发展。UHRF1的过表达会导致p53介导的衰老和DNA低甲基化,并驱动肝细胞癌。UHRF1的半甲基化DNA和组蛋白结合功能支持结肠癌致癌特性和DNA甲基化的维持。UHRF1的启动子已被证明在白血病患者中被低甲基化,UHRF1在体外调节急性淋巴细胞白血病细胞系的活力。
前期研究显示,与正常受试者相比,UHRF1在AML患者中高表达。
UHRF1的缺失通过SAP30介导的MXD4激活靶向白血病起始细胞的自我更新,显著延长AML小鼠的生存时间。UHRF1特异性化学抑制剂对低毒性的AML患者来源的异种移植物(PDX)模型有效。
文献研究科学问题
研究UHRF1在AML发展和维持过程中的作用机制,筛选得到针对UHRF1的特异小分子抑制剂,为AML临床治疗提供理论基础。
文献研究思路
一、UHRF1在AML中的作用,发现靶基因MXD4
•利用UHRF1条件性敲除小鼠模型表明,UHRF1缺失显著延缓小鼠AML的发生、维持和发展,并显著抑制AML起始细胞的自我更新。
•通过在不同类型AML细胞RNA-seq数据分析发现,敲低UHRF1能显著富集MYC、E2F和G2/M等信号通路。
• 结合CUT&Tag和DNA甲基化分析发现,UHRF1通过调控靶基因MXD4的DNA甲基化从而影响其转录水平。
•同时敲低UHRF1和MXD4发现,MXD4能显著恢复UHRF1敲低所引起的小鼠白血病起始细胞降低和小鼠AML生存期延长。
二、UHRF1调控靶基因MXD4的表达
•通过质谱分析等实验发现,UHRF1-SRA结构域与SAP30存在直接相互作用。
•研究人员通过UHRF1截短体进行免疫沉淀实验表明,位于SRA结构域上的G572和F573位点能够与SAP30相互作用。
•当在UHRF1敲低的AML细胞中对这些位点进行突变后,会导致靶基因MXD4的DNA甲基化水平降低及其表达升高,同时显著延缓小鼠AML生存期。
•在AML细胞中SAP30通过与UHRF1相互作用共同调节靶基因MXD4的结合,从而影响其表达与AML细胞的增殖。
三、UHRF1在AML中的靶向治疗效果
•利用分子模拟结合深度学习的方法从约21万个化合物库中筛选获得了可特异性抑制UHRF1-SRA结构域与半甲基化DNA结合的小分子抑制剂UF146。
•发现UF146能显著抑制小鼠AML起始细胞和AML患者原代细胞增殖及自我更新能力。
•UF146能通过抑制靶基因MXD4的DNA甲基化从而促进其表达水平。
•CDX实验表明,经过UF146处理过的小鼠AML生存期显著延缓。
•PDX实验表明,UF146对AML患者来源的异种移植模型中具有显著治疗效果。
研究结果及分析
一、UHRF1在AML中的作用,发现靶基因MXD4
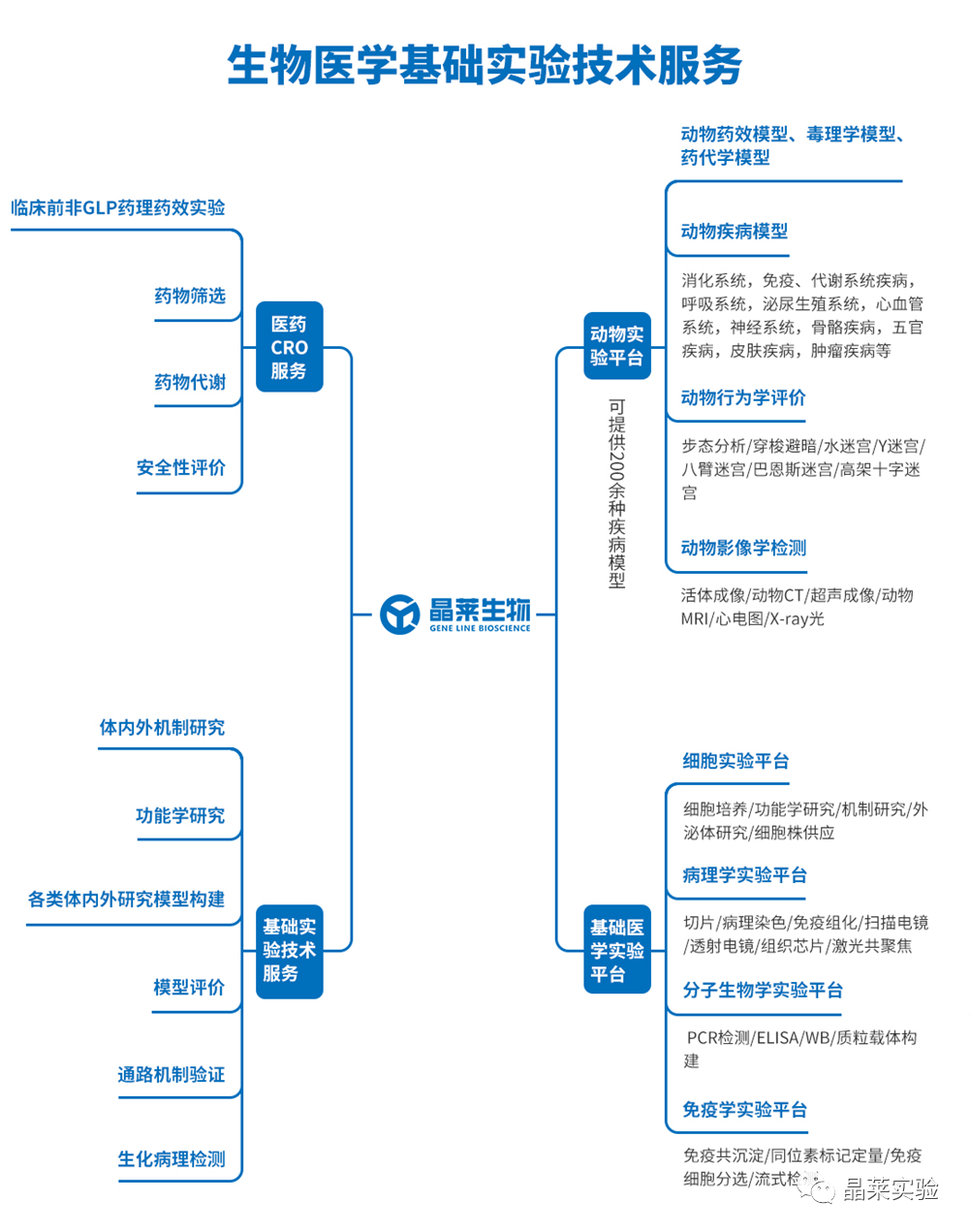
1、UHRF1在AML患者细胞中显著性高表达,UHRF1的高表达与AML患者预后差具有显著相关性
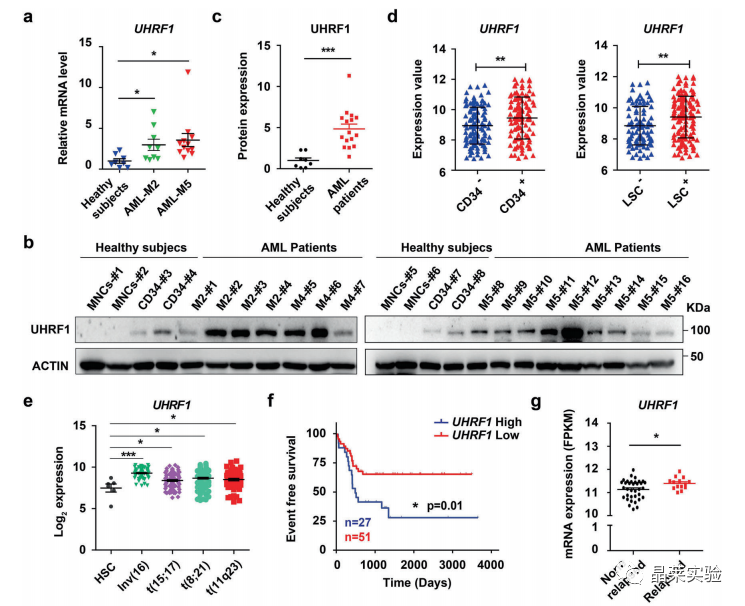
a. 与健康对照组相比,AML患者样本中的UHRF1 mRNA和蛋白质水平更高。
f. 结果显示,与低UHRF1表达的患者相比,UHRF1表达高的患者无事件生存期明显较差。
g. 复发的t(8;21)AML患者的UHRF1表达水平显著高于未复发患者。因此,这些结果表明UHRF1作为AML患者预后的预测因子的潜在作用。
这些结果表明UHRF1在AML中高度表达,UHRF1可能表明AML患者的潜在预后。
2、UHRF1条件性敲除小鼠模型,UHRF1缺失显著延缓小鼠AML的发生
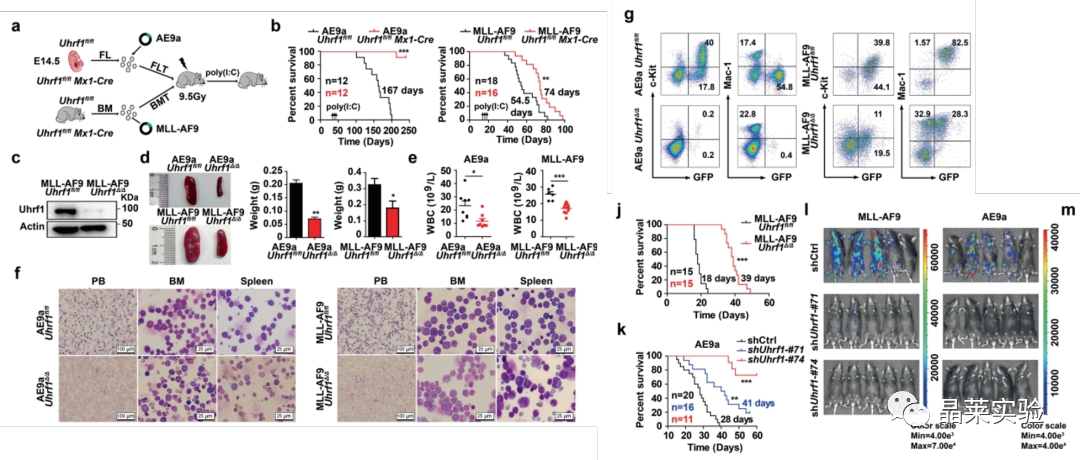
这些结果表明Uhrf1是AML维持和发展所必需的。
3、UHRF1缺失显著抑制AML起始细胞的自我更新
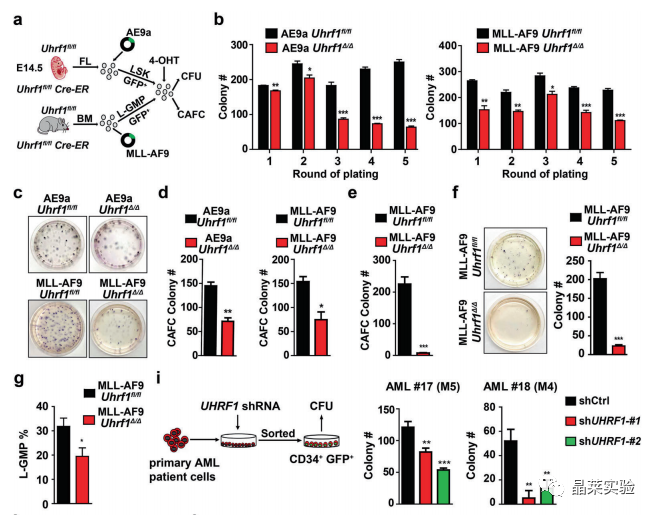
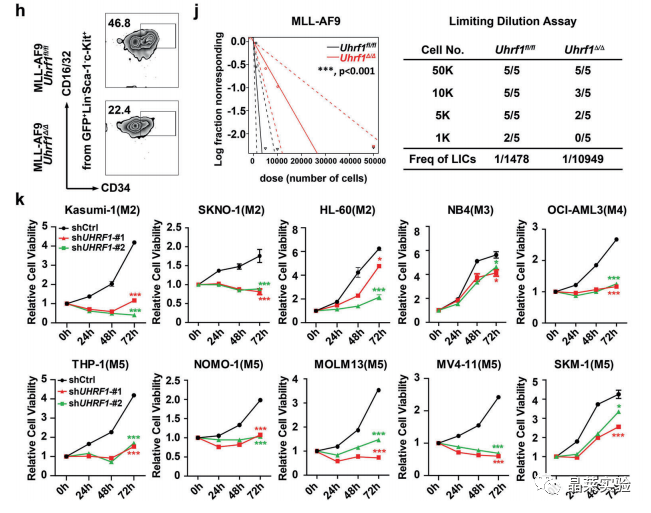
a-i. 结果表明,Uhrf1缺乏会损害LICs的自我更新。
Uhrf1的缺失会损害LIC的自我更新并降低LIC的频率。
h-k. 这些结果强烈表明UHRF1对于AML细胞的增殖和存活至关重要。
敲低UHRF1显著抑制AML细胞的增殖、促进细胞凋亡并导致细胞周期阻滞。
4、在不同类型AML细胞RNA-seq数据分析发现,敲低UHRF1能显著富集MYC、E2F和G2/M等信号通路
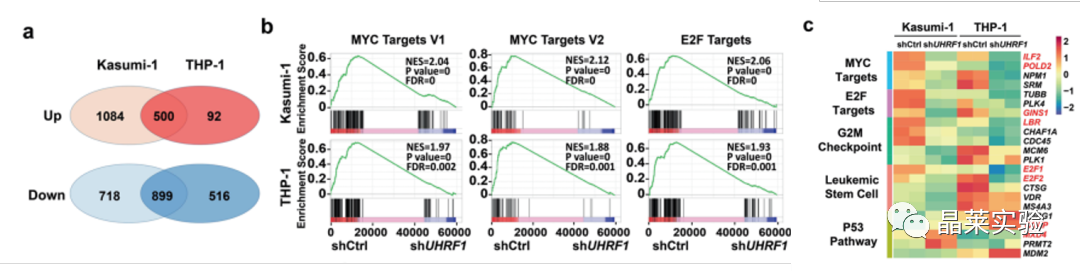
结合CUT&Tag和DNA甲基化分析发现,UHRF1通过调控靶基因MXD4的DNA甲基化从而影响其转录水平。
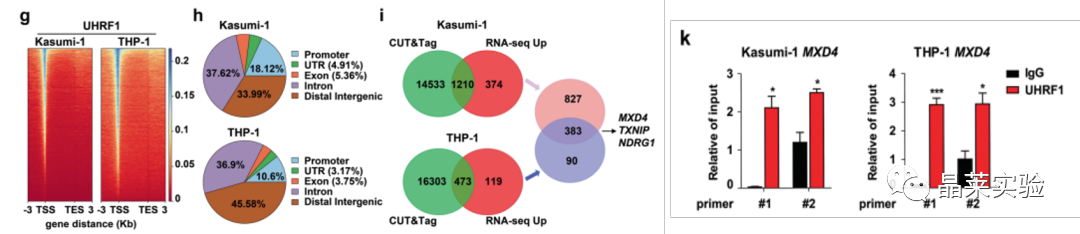
这些结果表明,UHRF1缺乏导致MYC信号通路相关基因的转录减少和AML细胞中MXD4的表达增加。
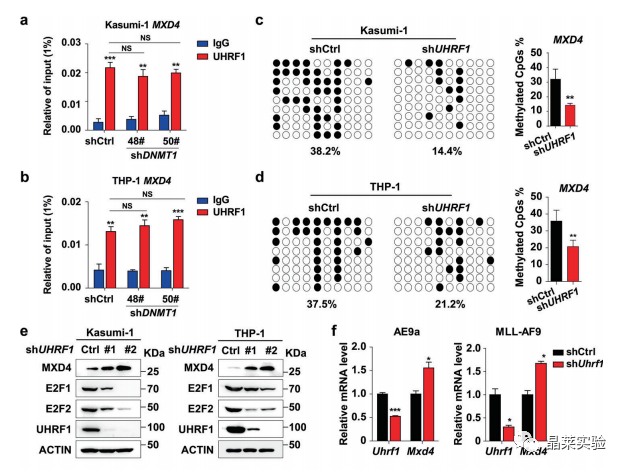
UHRF1敲低的AML细胞中,MXD4的DNA甲基化水平降低从而促进MXD4的表达,MXD4的高表达能显著抑制MYC下游信号通路。

同时敲低UHRF1和MXD4后,MXD4能显著恢复UHRF1敲低所引起的小鼠白血病起始细胞降低和小鼠AML生存期延长。
二、UHRF1调控靶基因MXD4的表达
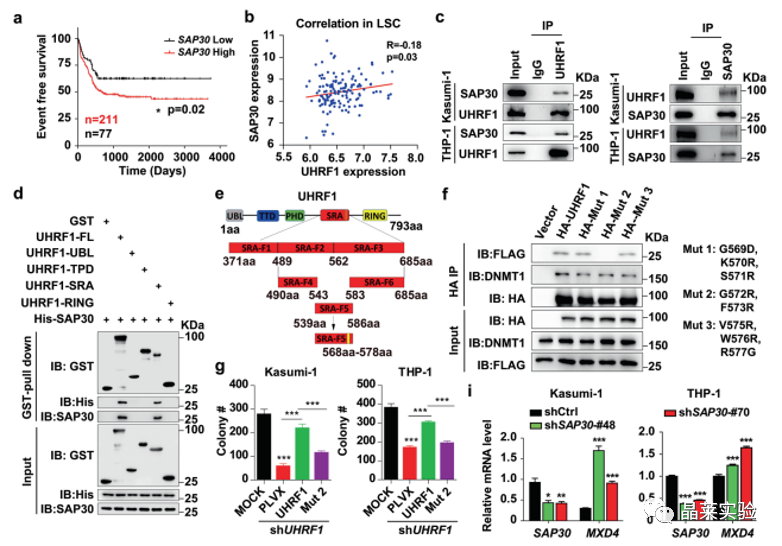
通过质谱分析等实验发现UHRF1-SRA结构域(G572和F573位点)能够与SAP30相互作用。
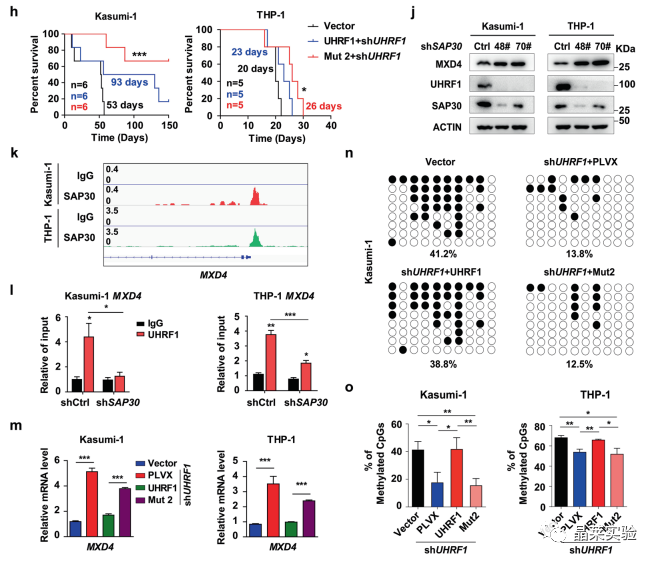
UHRF1敲低的AML细胞中对这些位点进行突变后,会导致靶基因MXD4的DNA甲基化水平降低及其表达升高,同时显著延缓小鼠AML生存期。
三、UHRF1在AML中的靶向治疗效果
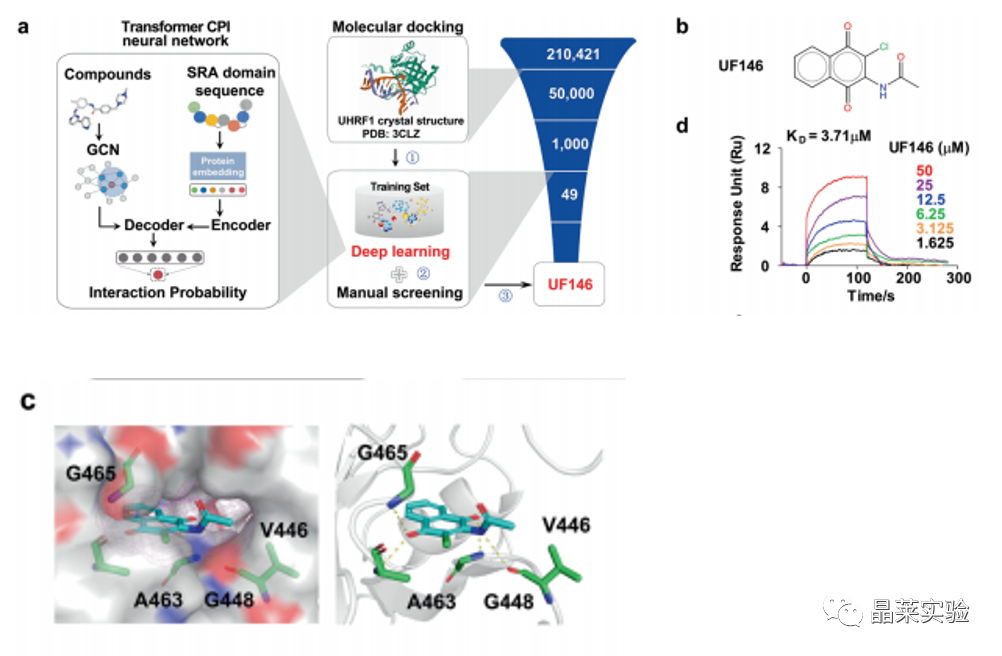
利用分子模拟结合深度学习的方法从约21万个化合物库中筛选获得了可特异性抑制UHRF1-SRA结构域与半甲基化DNA结合的小分子抑制剂UF146。
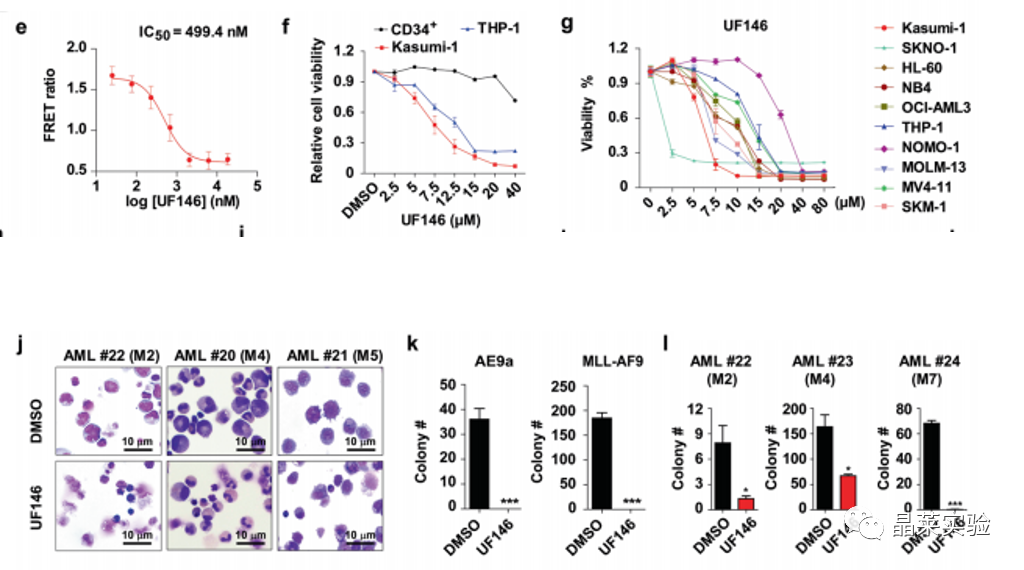
UF146能显著抑制小鼠AML起始细胞和AML患者原代细胞增殖及自我更新能力。
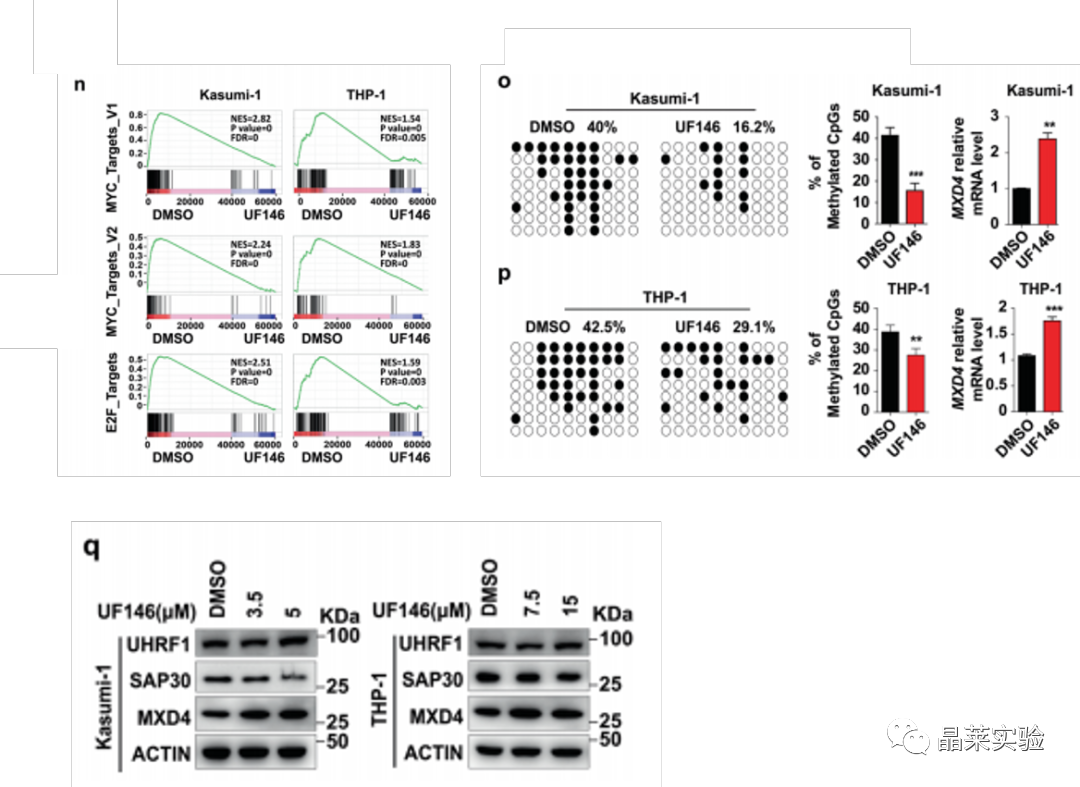
UF146能通过抑制靶基因MXD4的DNA甲基化从而促进其表达水平。
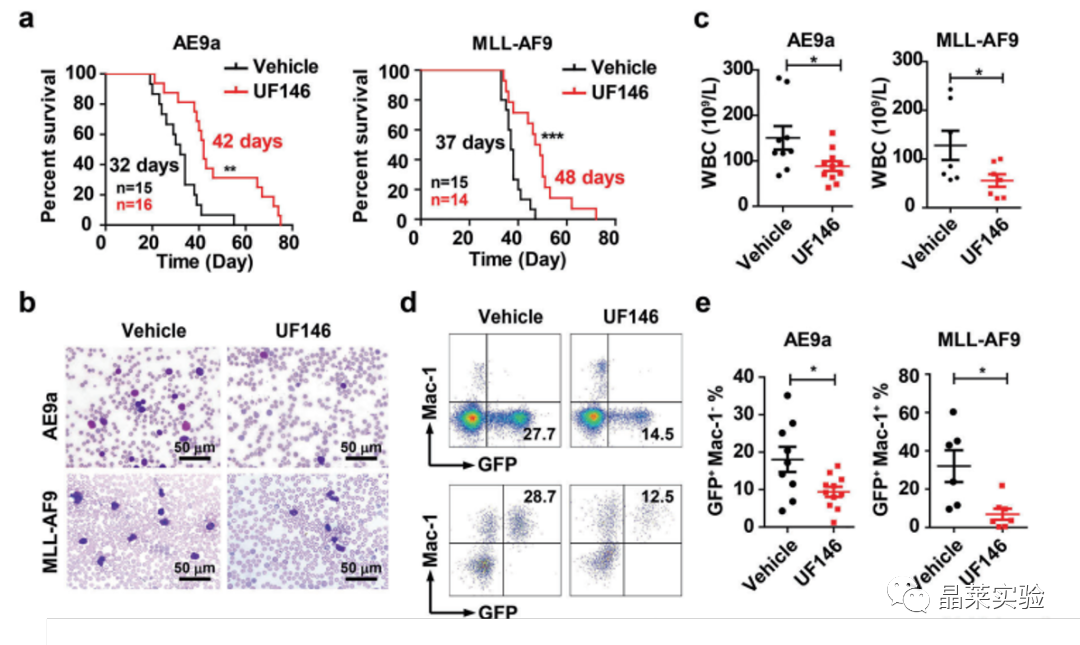
经过UF146处理过的小鼠AML生存期显著延缓。
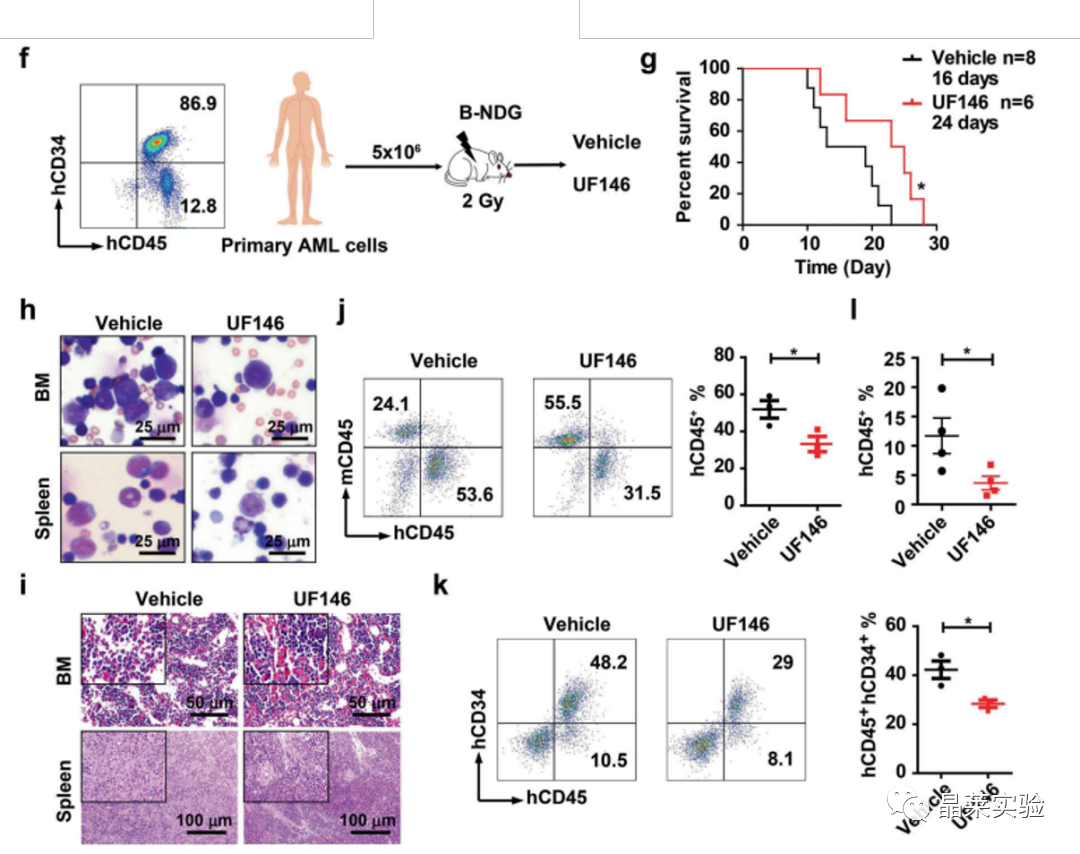
PDX实验表明UF146对AML患者来源的异种移植模型中具有显著治疗效果。
文献结论
UF146靶向抑制由UHRF1/SAP30介导的MXD4启动子甲基化,促进MXD4激活后,通过下调MYC相关靶基因,延缓AML的发生发展。
文献总结
创新点:
1.揭示UHRF1通过AML起始细胞调控AML的发生和发展。
2.表明UHRF1的小分子抑制剂UF146,为临床治疗AML提供新方案。
可延伸点:
1.本文有表明UF146对AML和造血干细胞的LIC的影响是不同的,但只阐述了UF146在AML治疗中的作用,可深入研究UF146对于造血干细胞的影响。
2.有报道4-BPC也是UHRF1的抑制剂,而本研究的UF146对于AML细胞抑制的化学浓度要比4-BPC低,可深入研究两个抑制剂对于AML的区别作用。
文献涉及实验技术

关于晶莱
晶莱生物(Geneline Bioscience)是一家专注于生物医药研发与基础医学研究服务的高新技术企业。可开展生物医药临床前CRO服务,基础医学研究技术服务,医学成果转化服务,类器官、细胞、动物模型等产品研发业务。目前已在北京、上海、长沙开设公司并建立多个综合实验室,共建设有3000余平实验平台(含SPF动物实验平台、生化病理检测实验平台、细胞/类器官实验平台),组建了数十名来自全球知名高校的硕博研究生研发团队。可开展小鼠、大鼠、豚鼠、地鼠,兔,犬、猪、猴、相关的动物实验,可构建200余种动物疾病模型,为生物医药公司、高校、医药搭建了多管线研发服务平台。
与国500+生物医药公司、高校及医院建立合作,成功开展10000+研究/研发项目,服务超8000+客户。

晶莱生物业务覆盖:为生物医药公司提供CRO服务:临床前非GLP药理药效实验、药物筛选、药物代谢、安全性评价。为高校及医院提供体内外机制研究、功能学研究、各类体内外研究模型构建、模型评价、通路机制验证、生化病理检测等生命科学实验与基础医学实验。为高校及医药公司提供生物医学科技成果转化服务,链接上游下生物医药企业、投资机构等进行科研成果转化服务。研发标准化及工程化细胞、动物、类器官模型产品,助力生物医学发展及精准医学发展。