
GSDMB is increased in IBD and regulatesepithelial restitution/repairindependent of pyroptosis
GSDMB不依赖于焦亡来调节上皮的修复

1
研究背景
•GSDMB由于缺乏小鼠同源物,导致体内实验有限。目前关于GSDMB功能的推测都是基于对其他家庭成员的研究。比如其在颗粒酶A的作用下,N末端被剪出,在膜上聚集形成穿孔,引起焦亡。但与其他成员相比,GSDMB的结构是最独特的,引起了对替代功能的推测。
•GSDMB蛋白编码和转录调控区域内的单核苷酸多态性(SNPs),与获得免疫介导疾病的易感性增加有关。在胃肠道相关器官中,GSDMB的表达较高,且主要集中在上皮细胞。
•IBD(炎症性肠病),包括克罗恩病(CD)和溃疡性结肠炎(UC),其特征是胃肠道的慢性、复发性炎症,导致免疫介导的组织破坏和肠道屏障功能的损害。
•解决炎症的一个关键过程在于:促进恢复正常器官功能、维持肠道内稳态。在这一过程中,由于解剖位置、潜在的黏膜免疫系统以及局部肠道微环境之间复杂的相互作用,导致IECs(肠上皮细胞)成为关键因素。
•IBD的发展与黏膜愈合的功能障碍有关,其中IECs无法对损伤的粘膜进行修复,最终会导致屏障完整性受损。
•目前,IBD现有的治疗方式旨在控制症状和实现长期缓解,还没有专门增强或改善肠道屏障功能的治疗方式,IECs是IBD的一个很有前途的治疗靶点。
2
文献科学问题
3
文献思路
1. 确定GSDMB在IBD中高表达,且将表达点定位于IEC中结肠细胞、隐窝顶部结肠细胞的细胞膜上
2. GSDMB与细胞增殖、迁移、黏附相关
3. GSDMB、IEC、IBD三者之间的联系
4
研究结果及分析
1. 在IBD中,GSDMB表达增加。
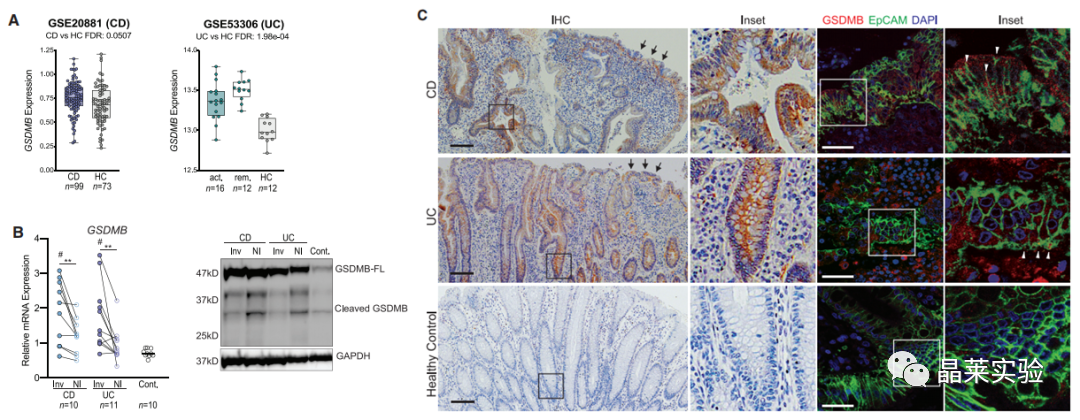
2. 炎症反应后,GSDMB表达明显增强,且增强的位置是在肠上皮细胞里。
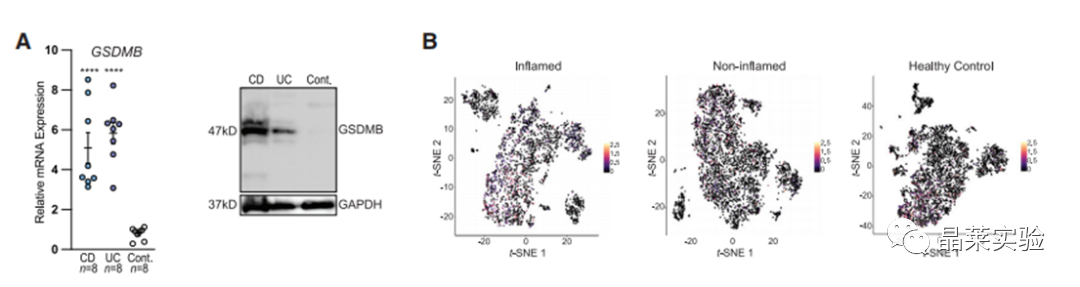
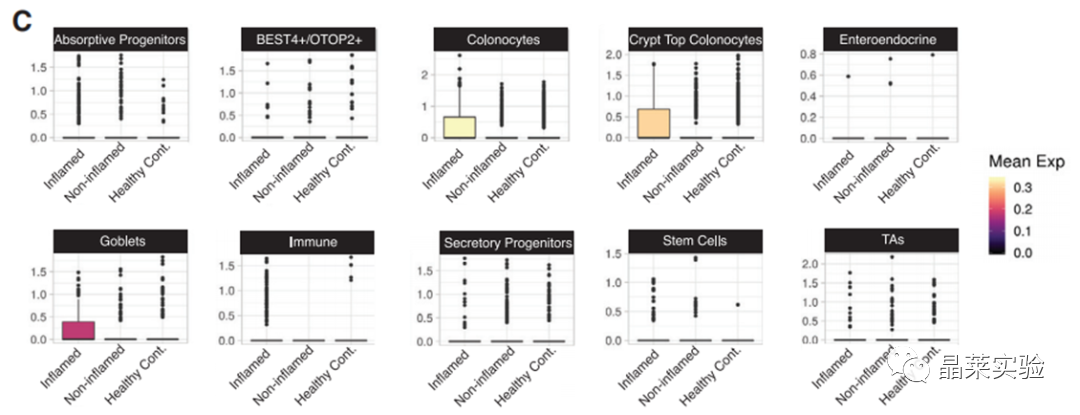
3. 通过对表达部位分析,发现GSDMB在结肠细胞、隐窝顶部结肠细胞中有表达。
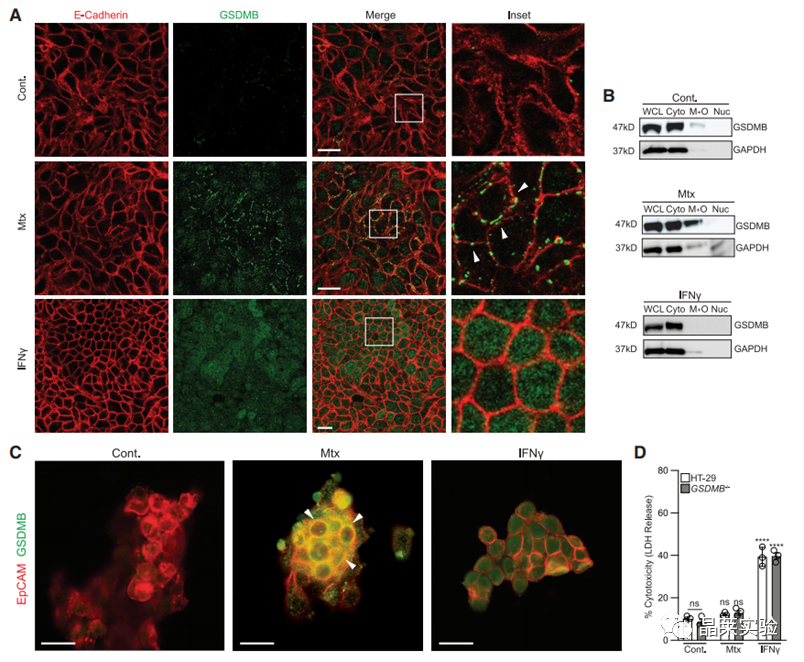
4. 在具体定位中发现,GSDMB在细胞膜上。
用目前已有的数据来说,文章会通过以下思路研究:
1. 过表达或者敲减GSDMB
2. 检测一些与细胞焦亡相关的指标
3. 使用生长因子,抑制剂等进行干预
4. 检测炎性相关因子表达
5. 形成GSDMB-炎症-焦亡的一个闭环
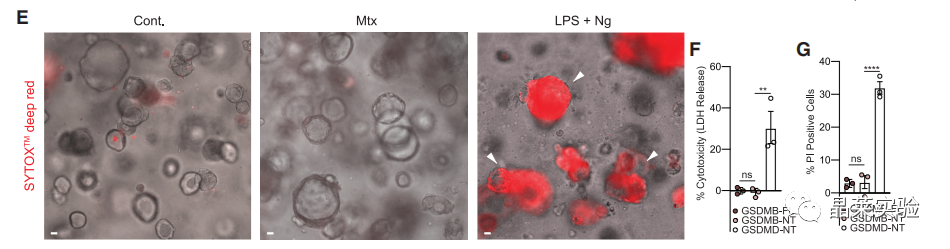
5. PI染色确认细胞膜的破损情况。
结果显示:在GSDMB中,不管是全长还是N末端都不会造成膜破损。
但是GSDMD上膜后,膜破损明显。
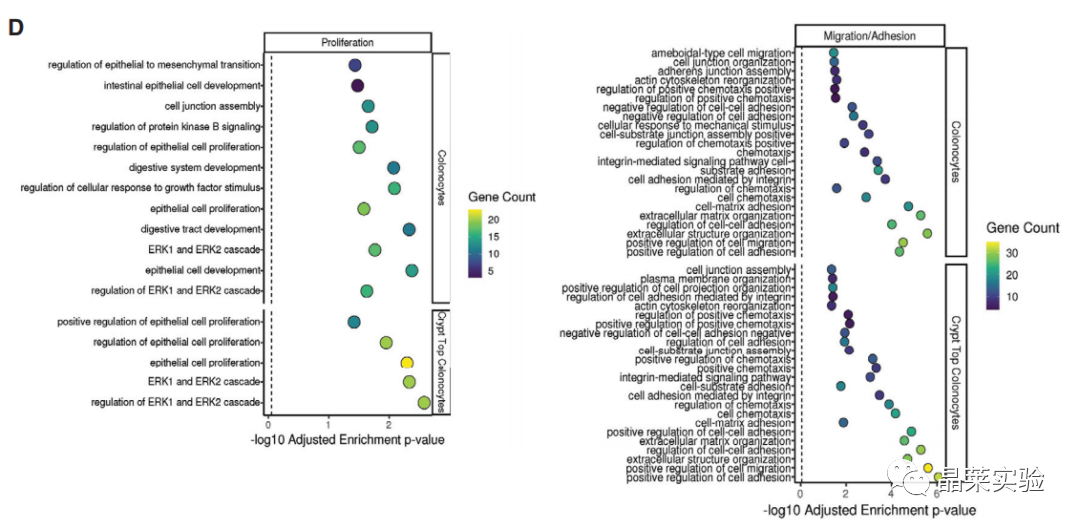
6. 二代测序发现,在结肠细胞与隐窝顶端结肠细胞中,与迁移、增殖、黏附相关的基因出现高表达。
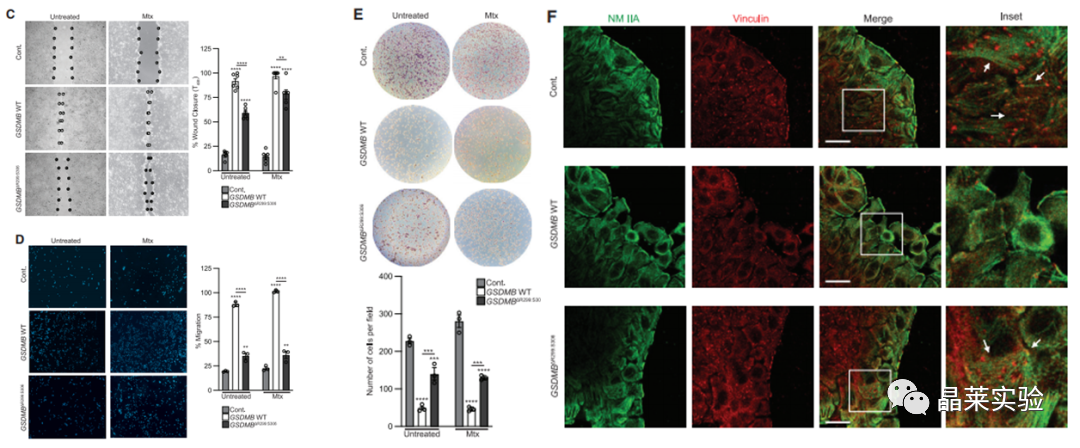
7. GSDMB缺失会降低HT-29细胞的伤口闭合能力。
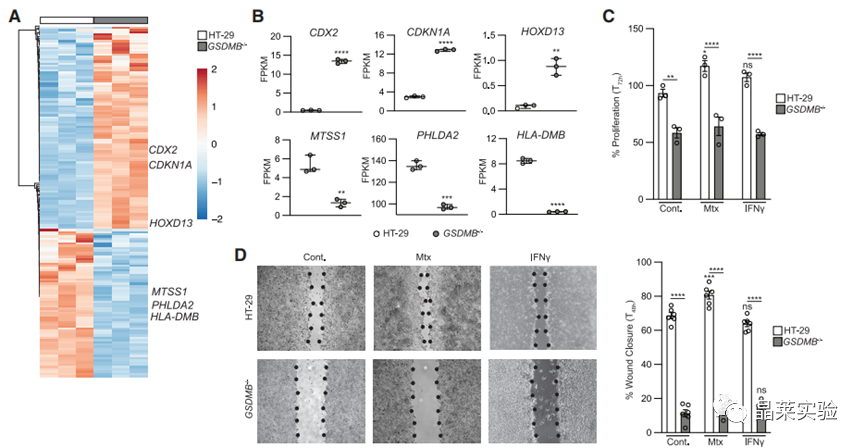
8. GSDMB缺失会降低HT-29细胞的迁移能力。
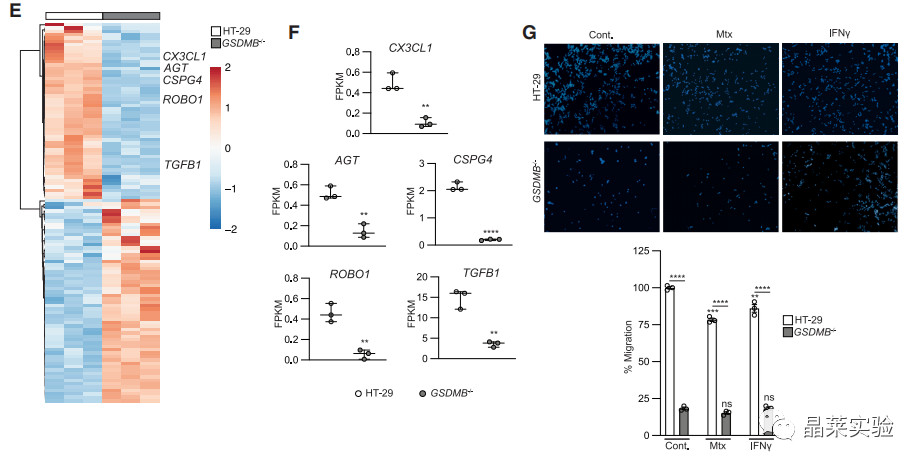
9. GSDMB缺失会提高HT-29细胞的粘附能力。


10. IF结果表明:GSDMB缺少,导致超黏附的IEC表型出现。
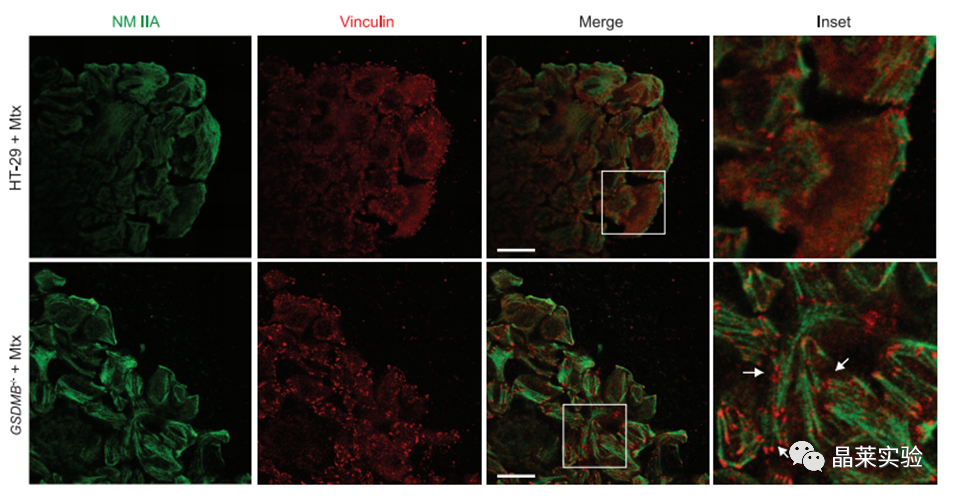
Vinculin与NMⅡA属于上皮细胞和胞外基质连接的部分。
前期的研究结果表明:
与WT GSDMBG299:P306相比,携带突变体GSDMB△R299:S306在IBD患者的肠道黏膜活检中,GSDMB表达进一步增加。
因此,采用GSDMB的SNP位点突变体,进行后续的回复实验。
11. 突变体回复实验:
GSDMB缺失后,过表达GSDMB可回复IEC表型,过表达GSDMB突变体不能回复IEC表型

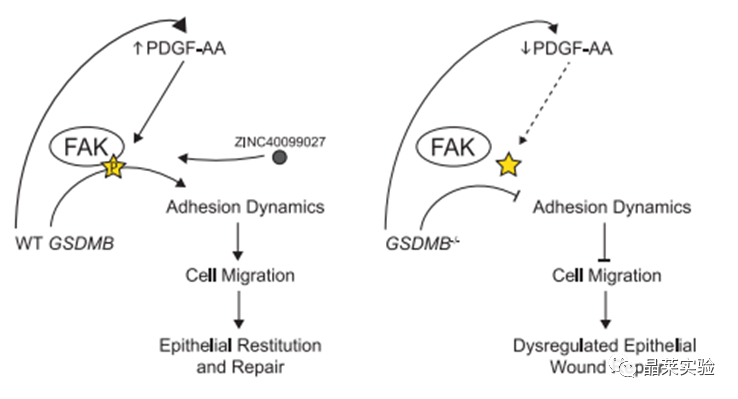
GSDMB敲除细胞中,FAK磷酸化水平出现特异性降低。
过表达GSDMB可提高FAK磷酸化水平,过表达GSDMB突变体则无明显提高。
激活FAK磷酸化后,GSDMB的缺失造成伤口闭合无明显修复效果。
过表达GSDMB与过表达GSDMB突变体均可提高伤口闭合能力,但后者较小。
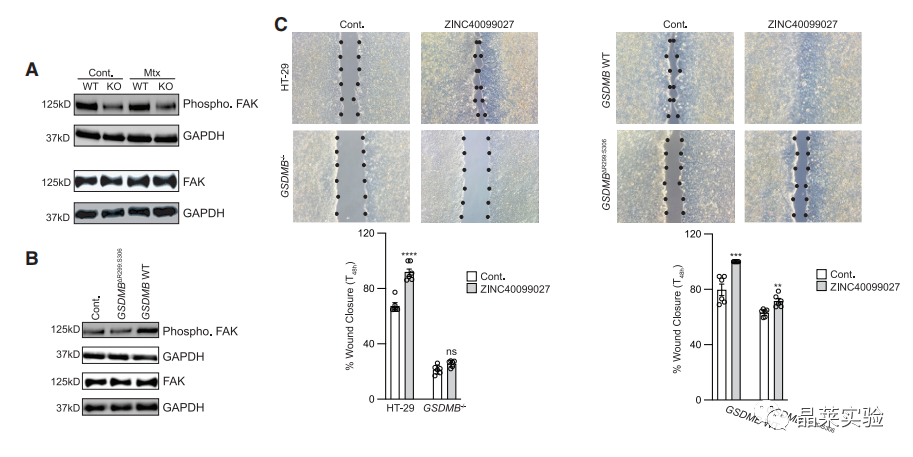
FAK:黏附动力学调节因子
ZINC40099027:激活FAK磷酸化
12. PDGFA过表达后,可促进FAK磷酸化,提高GSDMB敲除细胞的伤口闭合能力。
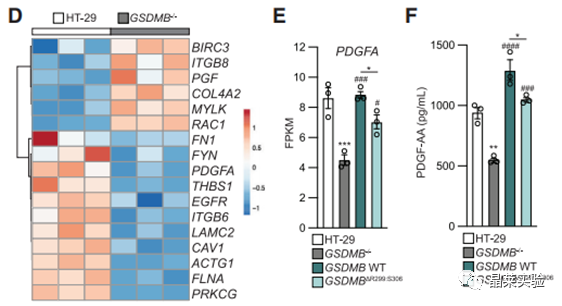
13. 通过PDGF-A调节FAK磷酸化的变化,从而全面影响细胞运动和上皮恢复/修复的整体过程。
5
文章结论
IBD中,GSDMB的高表达可修复IBD造成的肠上皮细胞损伤。此修复过程可能是通过GSDMB下游基因PDGF-A调节FAK磷酸化,提升伤口闭合能力,进一步恢复肠上皮细胞表型而实现。
6
文章总结
创新点:
1.GSDMs家族成员中,有独特结构的GSDMB在细胞迁移、增殖、黏附方面具有相关性。
2.GSDMB在修复IEC损伤方面具有关键作用,为IBD的治疗提供新的治疗策略。
不足:
1.在研究GSDMB的机制中,单从 “GSDMB缺失后影响FAK磷酸化” 这一数据中,很难说明GSDMB就是FAK磷酸化的上游,毕竟在伤口闭合实验中没有出现明显的改变。
2.根据 “PDGFA过表达后可恢复GSDMB缺失的细胞表型” 这一结论,再结合FAK磷酸化的结果,两者并不能直接说明是在一条通路上作用的结果。
7
文章涉及的实验技术
8
“细胞焦亡”热点延展
细胞焦亡是一种强烈的炎症反应,常常表现为细胞的膨胀、破裂,进而释放 大量炎症因子,最终导致不可逆的炎性坏死。
细胞焦亡与 IBD
① 免疫相关的 GTP 酶 M (immunity-related GTPase M, IRGM/Irgm1) 被证明能够作为 NLRP3 经典炎症小体激活的负调控因 ,阻止其与 ASC 蛋白的寡聚化,进而抑制细胞焦亡,缓解克罗恩病小鼠的肠道炎症。
② 在同种异体造血干细胞移植(allo-HSCT)中,敲除 caspase-11 进而抑制 caspase-11 和 LPS 相互作用,能够明显抑制 GSDMD 和 IL-1β 的表达水 平以减少 allo-HSCT 中的肠道炎症、组织损伤以及供体 T 细胞的扩增和死亡率, 为急性移植物抗宿主病(GVHD)提供了新的治疗策略。
③ caspase-4/11 在小鼠结肠炎中增高,而谷胱甘肽过氧化物酶 8 (GPx8)作为一种重 要的过氧化物酶分解酶,可以通过负调节 caspase-4/11 活性来预防结肠炎。
关注公众号,了解更多!
