
根据骨缺损的原因,骨缺损可分为3类:机械性骨缺损、炎症性骨缺损和肿瘤性骨缺损。
接下来小编带大家一起了解常用的动物骨缺损模型和它们可应用的研究方向。
目前常用于制作骨缺损模型的动物有小鼠,大鼠,兔,犬,猪,羊等。
骨缺损动物模型理论上是选择越大型的动物越好,比如犬,猪,羊等。
一则越大型的动物骨折愈合机制与人类越相似;再则越大型的动物制作过程中越易于操作。大型动物也有实验成本过高,样本数量难以保证的现实缺点。
小鼠模型价格低廉,来源广泛,小鼠自身具有较强的抗感染及耐受手术的能力,且围手术期易于管理,因此小鼠模型具有一定优势。
小鼠局限性:
①小鼠自身修复速度比人类快,因此小鼠骨缺损修复模型仅可作为骨缺损修复的分子机制和骨材料短期修复及生物相容性的初步研究;
②作为骨替代植入材料在体内的短期评估较有优势,但不能做长期评估。
③小鼠骨结构中不含有哈佛系统,不能完全模拟人类的骨骼重建过程,因此不宜用在研究哈佛系统的形态、功能和组织性质方面的实验。
④小鼠过于瘦小,操作不便,模型手术要求术者具备一定的显微外科手术基础。大鼠形态比小鼠大,手术操作较为方便,比小鼠更有优势。兔是目前做骨缺损模型最常用的动物。
目前最常用的品种是新西兰大白兔,其来源广泛,生物信息已经充分了解,也比较容易饲养,耐受手术和抗感染能力也较强。兔相比于鼠类最大的优势就是兔体型大,操作比鼠类方便,而且经济方面也在能接受的范围内,因此较为常用。
一般小鼠选择2到3个月的小鼠作为模型,雌兔选择6到10个月的兔作为模型。
骨缺损的部位可以划分为负重部位骨缺损与不负重部位骨缺损两类。
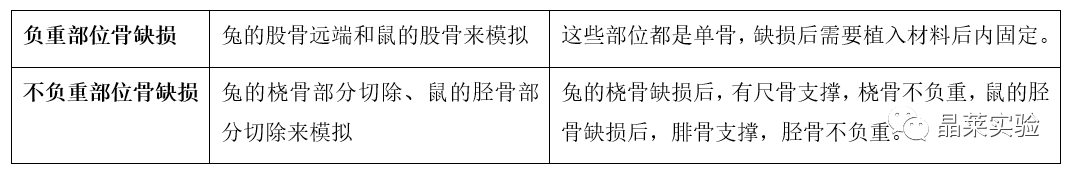
缺损长度的选择
实验动物骨缺损模型是进行骨缺损内植物研究的基础。
在进行骨组织工程研究时,应采用桡骨缺损模型1.4cm及以上长度、6月龄左右健康新西兰大白兔作为骨缺损模型更有说服力。
如果要进行骨缺损的内置物或内固定的研究,动物模型兔的骨缺损在1.4cm以上,小鼠的骨缺损模型在2mm以上具有说明性,也可以设计对照实验来排除动物自身愈合对结果的干扰。如果研究某种植入物或药物对骨缺损修复的机制,可以相应的减少缺损长度。
机械性骨缺损可用于模拟创伤或手术导致部分骨受损或缺失的情况。
依据骨缺损的部位,机械性骨缺损主要有4种类型:颅骨缺损、长骨节段性缺损、部分皮质缺损和松质骨缺损模型。
1. 颅骨缺损模型
颅骨是研究原位骨愈合最常用的手术部位之一,动物首选小型啮齿类动物,如小鼠、大鼠。
造模举例:
通常选取成年雄性大鼠,盐酸氯胺酮(40mg/kg)与盐酸甲苯噻嗪(8mg/kg)联合麻醉,也有采用10%水合氯醛(4ml/kg)腹腔注射麻醉。大鼠头颅备皮、消毒铺巾后,从鼻骨开始,沿颅骨矢状线取纵行手术切口,长约1.5~3cm,逐层分离软组织,充分显露矢状缝、双侧顶骨及部分额骨和枕骨。
根据圆形缺损直径大小的不同,在不同部位进行钻孔建模,直径≤6mm一般在双侧顶骨处钻孔;直径>6mm一般以矢状缝为中心进行钻孔。钻孔前需将骨膜充分剥离,将不同直径的空心钻头连接电钻后,低速(≤1500rpm)钻取,钻取过程中助手用生理盐水滴注(1滴/2s)降温。钻取时动作需轻柔(单纯凭借电钻的自然重力,尽量不附加外力),避免将骨组织完全钻穿,接近钻穿时用剥离器沿着圆形缺损周边进行钝性分离,从而避免硬脑膜及其下方的血管、脑组织的损伤。生理盐水冲洗术野,探查无活动性出血后,用0号线逐层关闭皮下组织、皮肤切口。术后大鼠侧卧于30℃恒温台进行麻醉复苏,完全清醒后送回饲养笼继续喂养,于术后8~12h,20~24h,32~36h分别予以丁丙诺啡(0.05mg/kg)腹腔注射镇痛。
大鼠的种系一般选择SpragueDawley(SD)大鼠和Wistar大鼠,这两个品种的大鼠生长较快、繁殖能力强,容易饲养,对传染病的抵抗力较强。
通常采用成年的雄性大鼠进行动物实验,SD大鼠一般>12周(体重300~350g)。
大鼠颅骨中最常用的临界骨缺损直径为5~8mm。一般认为,这种5mm骨缺损的优点是每只动物能诱发两个缺陷,避免跨越矢状缝。
颅骨缺损模型在研究中应用广泛,是可用组织学和放射学分析的标准化骨缺损,可用于评估骨组织工程生物材料之间的差异,缺点是无法评估生物材料在生理力学载荷下的性能。
2. 长骨节段性骨缺损
长骨节段性骨缺损包括骨折和截骨两种模型。
可用于长骨节段性缺损动物模型的动物有大鼠、猪、犬、绵羊等大动物,其中最常用的动物是绵羊,成年绵羊具有与成人相似的体重和骨重塑率以及适合的尺寸,因而易将研究结果转化应用于临床
一般认为长骨的临界骨缺损值应为长骨干直径的2~2.5倍。除骨缺损大小外,长骨节段性缺损还要考虑其他因素,如动物的年龄和种类、骨缺损部位、骨结构、动物的全身状况等,并且需要遵循3R原则,即替代(replacement)、减少(reduction)和优化(refinement)。
根据实验成本及研究目的等综合考虑,选择合适的动物种类和骨缺损的部位,选择生理发育均较稳定的年龄段动物,并且保持动物良好的全身状况,在不影响实验要求和实验结果的基础上科学利用和合理保护动物。
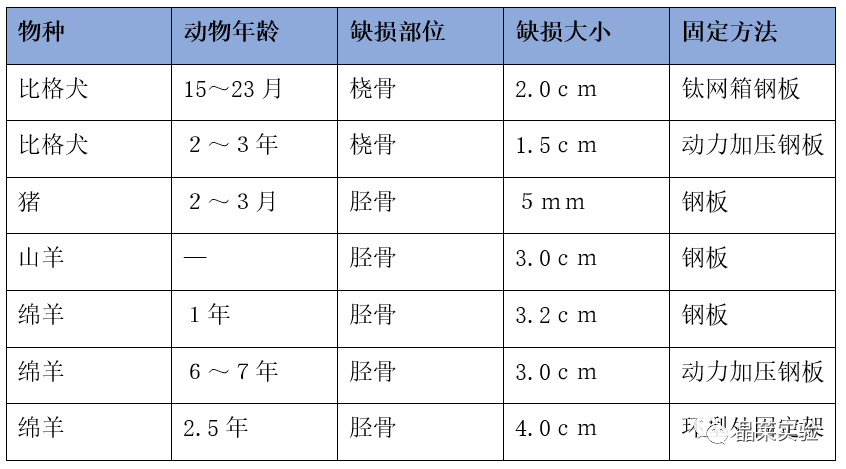
近5年各种大动物节段性骨缺损模型研究
3. 部分骨缺损
部分骨缺损在节段性骨缺损模型中,一般是较大且完全穿透的骨缺损。而在部分缺损模型中,通常用器械钻入骨的侧面以形成受伤区域。钻孔穿透皮质骨,可以延伸到下面的松质骨或骨髓腔。在这个模型中,通常只有一侧骨头受伤。
部分皮质骨缺损操作简单,并能模拟稳定型骨折愈合的步骤,与其他闭合性和开放性骨折相比有许多优点,如降低动物的发病率,并更利于组织形态计量学分析。常见部位为长骨骨干中部或干骺端,根据所用动物和部位的不同,缺损直径从0.8~5mm不等。
造模举例:
兔分组,每组5只,术前1d拟手术部位清洁和备皮处理,术前禁食8h,禁水2h。耳缘静脉注射2%戊巴比妥钠1.5ml/kg麻醉兔子,75%乙醇消毒术部皮肤;A组用11号圆弧形刀片在后肢前外侧离胫骨结节20mm处沿胫骨嵴向远端纵行切开皮肤,长度约15mm左右,钝性分离皮下软组织和肌肉,破坏打孔处骨膜,用执笔式牙科磨钻制备一直径为8mm圆形单侧皮质骨缺损孔。
制备过程中,钻头垂直骨面钻取单皮质骨,钻取深度为0.5~0.8mm,钻取过程中,用生理盐水连续冲洗打孔处骨碎屑。游标卡尺测定孔径,生理盐水冲洗伤口,0号线缝合皮下软组织,用1号丝线缝合皮肤。术后无需注射抗生素预防感染,伤口换药1次/d,持续3~5d。
4. 口腔相关机械性骨缺损
在口腔和颌面外科领域测试创新的骨再生疗法,尤其是在将骨再生材料应用于牙周治疗的情况下,有必要克服牙周手术特有的解剖学障碍,因此通常应用动物的牙周和下颌骨缺损模型,包括骨上皮缺损、牙周开窗缺损、人为分叉缺损、引导性骨再生缺损,以及下颌骨的节段性缺损。
颌骨缺损模型既要满足临界尺寸缺陷的主要特征,也要便于制造缺损与观测指标。对于颌骨建模的部位与方式,基于研究目的和建模动物种类的不同常有不同的选择,缺损形状及大小也存在差异。此外,在口腔中,牙齿的缺失导致颌骨丧失咬合力的刺激,导致牙槽突的吸收。因此也有实验联合拔牙与机械性骨缺损来制造牙周骨缺损模型。
造模举例:大鼠牙槽骨缺损动物模型
采用2%盐酸氯胺酮腹腔麻醉,麻醉后,采用四肢加头部固定方法将动物仰卧固定于手术台上,常规消毒,于上颌一侧第一磨牙区加2%利多卡因局部麻醉。于该侧第一磨牙近中区先行牙龈翻瓣,再用台式慢速牙科电钻低速钻孔,将此部位牙槽骨部分去除,去除的牙槽骨长×宽×深约为3mm×2mm×2mm,同时去除该区骨膜;去除骨质时,用针管向术区喷洒生理盐水,用无菌纱布按压5min,充分止血,然后立即将倍骼生充填入去除牙槽骨的部位,尽量使材料与孔径密合,缝合切开的黏膜。
术毕立即给予大鼠庆大霉素0.4万U/kg,肌内注射,每天1次,连续3d,同时给予大鼠灯光保暖,并密切观察其各项生命指征至完全清醒,待大鼠各项生命指征平稳后放入笼内。术后2周,随机处死4只大鼠,制作牙槽骨缺损修复侧的组织学切片,进行光学显微镜观察。
炎症性骨缺损是指骨缺损的同时伴有炎症,炎症常导致骨坏死、骨折延迟愈合、骨不连以及内置物植入的失败,其治疗是临床研究热点。炎症性骨缺损动物模型的建立为其提供了有效的研究方法,可为解决相应临床问题提供宝贵的理论基础。目前大多数实验采用在慢性骨髓炎模型的基础上清创制造骨缺损的方法构建炎症性骨缺损模型。
1. 感染性骨缺损动物模型
最常采用金黄色葡萄球菌(S.au-reus)。常用菌株为美国典型培养物保藏中心(ATCC)菌株,或根据实验需要选择不同抗生素敏感型S.au-reus。文献报道中常见的接种途径为骨髓腔内局部接种,
一种方法是在骨钻孔后直接注入细菌悬液,所使用的细菌悬液浓度一般为10⁸集落形成单位(CFU)/mL,10⁵~10⁸CFU/mL均见报道。另一种方法
是将含菌混凝块,或异物、金属丝等浸泡菌悬液后植入骨内。实验前根据实验动物及建模部位确定细菌的接种浓度尤为必要,否则可能导致感染率过低或动物病死率过高。一般均只接种1次,接种后视炎症的的急性程度,可在6h(急性感染)或1~4周(慢性感染)内对创面进行手术清创并进行相应的处理或骨缺损的评估。
造模举例:小鼠股骨骨缺损诱导膜模型的构建
取12只2~3月龄的C57BL/6品系小鼠,术前禁食4~6h,3%戊巴比妥钠(1.5mL/kg)腹腔注射麻醉,右侧股骨常规备皮并固定于手术台,常规消毒铺巾,采用侧卧位将小鼠固定于操作台上,于大腿外侧作一长约1.5cm皮肤切口,沿股骨外侧白线钝性分离周围肌肉及软组织,显露股骨。应用0.22mm线锯在股骨中段处制造3mm骨缺损;截取合适长短的0.5mm医用不锈钢钢丝作为髓内针;将PMMA骨水泥制作成直径2mm,长度3mm圆柱形占位器,将髓内针穿入骨水泥占位器;将髓内针从骨缺损处插入股骨远端后,再将其插入股骨近端;检查股骨固定满意后,逐层缝合手术切口,无菌敷料包扎。
术后连续3d碘伏消毒切口,腹腔注射青霉素20万U/kg,1次/d。小鼠苏醒后单独置于笼中饲养,室温维持在(25±2)℃,可进行自由活动以及进食和饮水。
2. 局部炎症常见的是脂多糖(LPS)诱导的颅骨局部炎症性骨缺损
将LPS注射到颅骨周围组织袋内,靠近颅骨中线的耳眼之间,5~7d后即可产生明显骨缺损,LPS常用浓度为25~50mg/kg。此外也有使用白细胞介素-1(IL-1)诱导骨缺损。此方式相较细菌感染操作更为简便。
3. 口腔相关炎症性骨缺损
在口腔相关研究中,修复牙周炎和慢性根尖周炎造成的骨缺损是较为热门的研究方向。
由于牙周炎的病因和牙周微环境的复杂性和特殊性,建立动物实验性牙周炎骨缺损模型的主要方式为通过龈下注射LPS或结扎丝结扎牙颈部等诱导炎症的发生,辅以高糖饮食等,1~4周可造成牙槽骨骨量下降,也有实验在此基础上通过机械清除颊骨和牙槽嵴制造临界缺损。
术后可通过放射学和组织形态学检查评估骨缺损。
为模拟慢性根尖周炎发生的病因,常见建模方式是暴露动物的牙髓以诱发根尖周病,使用球钻去除磨牙的髓顶后,不封闭牙齿,使牙髓暴露于口腔环境中。一般4周后可形成根尖周骨吸收。此外,有实验使用细菌建模以研究特定菌群造成的根尖周病。
肿瘤和癌症骨转移对人类健康构成严重威胁,开发一种兼具抗肿瘤和骨再生功能的植入物势在必行。许多材料抑制肿瘤和骨再生的能力是分别测试的,因此迫切需要合适的动物模型来同时评估这两种功能。
肿瘤性骨缺损一般为局部移植肿瘤组织或注射肿瘤细胞悬液造成的骨侵袭模型,也有研究在此基础上辅以机械性骨缺损。
1. 骨侵袭模型异种移植的小鼠骨肿瘤模型
主要包括直接接种到骨中或在心内注射后自发的骨扩散,前者在目前研究中更为多见。根据所研究的肿瘤不同,选用不同的细胞系建模,接种的部位也有所不同,常用接种方式为胫骨平台或骨髓腔内接种,形成骨缺损的时间从1周到4周不等。
2. 骨肿瘤伴机械性骨缺损模型
在兔股骨中段用电锯造成15mm长的节段性缺损,用兔恶性肿瘤VX2细胞混悬液注射支架,并通过螺钉钢板固定到所产生的骨缺损中,以便更好地研究在肿瘤环境中设计和应用植入物修复节段性骨缺损。
3. 口腔相关肿瘤性骨缺损
鳞状细胞癌是口腔中最常见的恶性肿瘤,也是口腔常见的肿瘤性骨缺损模型。常见的鳞癌局部骨侵袭模型具体操作为将SCC细胞(5×10⁶/100μL)皮下注射于裸鼠颅骨覆盖区,术后4周即有明显骨破坏。
也有文献报道将鳞状细胞癌细胞接种于胫骨干骺端,建立口腔鳞状细胞癌骨侵袭模型。
与机械性骨缺损相似,为了更好地模拟口腔颌面部肿瘤,颌骨也是口腔中肿瘤性骨缺损常见的建模部位。
骨缺损动物模型的制作要从多方面考虑。
① 根据研究经费及实验目的等综合情况选择合适的动物种类和骨缺损的缺损部位;
② 根据动物种类的不同,截取不同长度的骨块,以成功制作骨缺损模型,一般模型兔的骨缺损在1.4cm以上,鼠的骨缺损在2mm以上。
③ 动物年龄的选择一定要合理,要选择生理发育均较稳定的年龄段动物,综合近年来骨缺损模型制作情况来看,选择2到3个月的小鼠或6到10个月的兔作为模型,比较合理。
关注公众号,了解更多!
