
动脉粥样硬化(Atherosclerosis,AS)是指动脉内膜中发生脂质物沉积和炎症反应,形成斑块并进展至动脉壁的一种慢性进行性疾病。
临床上主要表现为冠心病、脑血管病、下肢动脉疾病等。
截止如今,国内外研究人员发展了多种Atherosclerosis动物模型,包括小鼠、大鼠、猪和猴等。本文将对这些动物模型的制备方法、特点、应用和研究成果进行综述。
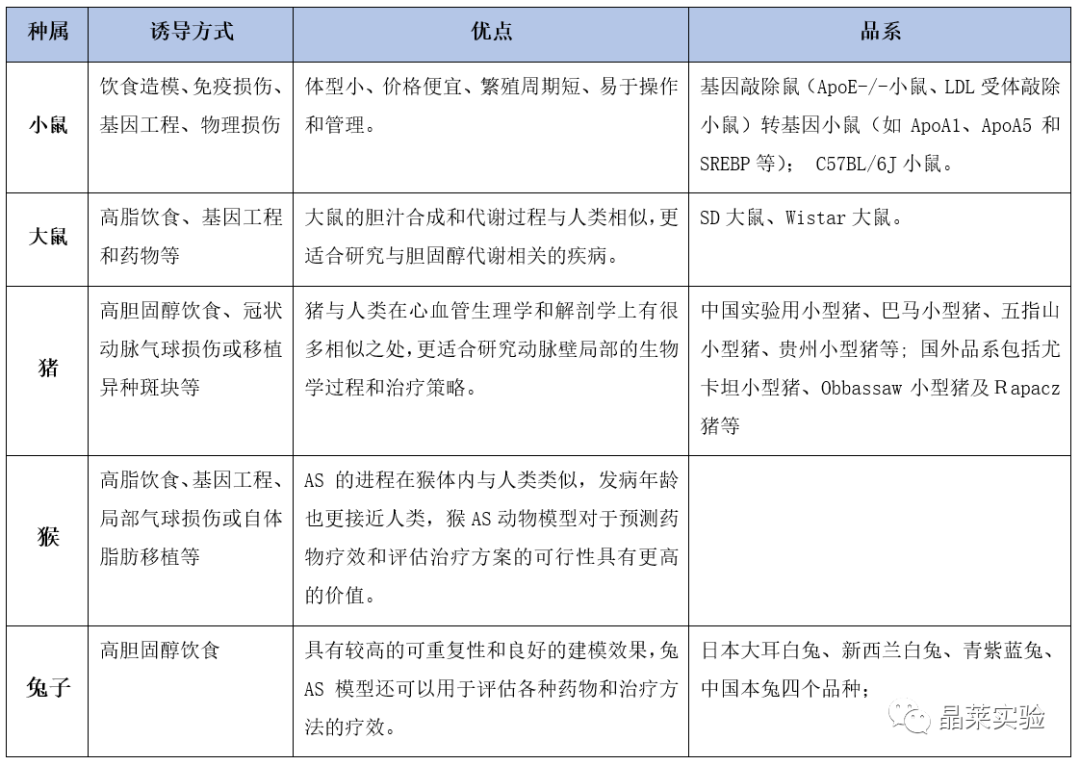
表1. AS模型不同动物对比
1. 饮食造模
造模时的高脂饲料配方多由1%~3%胆固醇、8%~10%猪油、0.2%丙基硫氧嘧啶、0.5%胆酸钠、5%白糖、81.3%~85.3%普通饲料组成。
使用高胆固醇饲料喂养纯系C57BL/6小鼠16周后,在主动脉、冠状动脉等部位发现了明显的AS斑块。
在高脂饮食喂养载脂蛋白E(ApoE)基因敲除小鼠(ApoE-/-)12周后,发现小鼠动脉内膜增厚较为显著,存在大量的泡沫细胞和胆固醇结晶,并成功观察到高脂喂养组小鼠的主动脉弓形成了广泛的AS斑块。
2. 基因工程
ApoE-/-和低密度脂蛋白受体(LDLR)敲除小鼠(LDLR-/-)是AS实验研究最常用的两种模型动物。
ApoE是血液中最重要的载脂蛋白,介导了血浆脂蛋白的运输与清除,当小鼠缺失ApoE时,其血液中总胆固醇(TC)、低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)含量都会增加,增加了小鼠AS的发生风险。
给予ApoE-/-小鼠普通饲料饮食,第2个月后观察到泡沫细胞和脂质条纹,第4个月左右观察到纤维帽、纤维斑块形成,5个月后可以在小鼠主动脉根部观察到成熟纤维斑块。而高脂肪、高胆固醇饮食则可以明显加快AS的形成速度,12周左右即可于小鼠主动脉弓部发现广泛的AS斑块。
LDLR是一种广泛存在于血浆中的TC运输蛋白,参与介导LDL和VLDL的清除,小鼠缺失LDLR会导致其体内中间密度脂蛋白(IDL)、LDL和乳糜微粒(CM)浓度提升,同时患上AS的风险也显著升高。
使用普通饲料喂养LDLR-/-小鼠4个月后进行病理检测,发现纤维帽和纤维斑块形成。高脂饮食时,LDLR-/-小鼠会表现出更大且更晚期的AS斑块,高脂伴胆酸饮食的LDLR-/-小鼠大约6周后可于主动脉弓等处发现广泛AS斑块。
3. 免疫损伤
模型原理:
动物脂蛋白的异常改变超出了免疫耐受的限度,脂蛋白便会被机体当作抗原,进而引起免疫反应,产生相应的抗体与抗原(脂蛋白)结合形成免疫复合物引起免疫损害,其中一些复合物可以沉积于血管壁,激活补体系统和杀伤细胞,损伤血管内皮细胞(VEC),最终形成AS。
常用的免疫刺激剂有肺炎支原体、幽门螺杆菌、EB病毒、巨细胞病毒、脂多糖等,它们可以诱导免疫反应的发生、发展。
评估免疫接种对AS效果的实验研究主要集中于2个主要作用靶点,抗oxLDL抗原决定簇和HSP60免疫应答的这种靶点主要通过接种疫苗提高保护性免疫应答效应强度,从而遏制AS;促进AS的内源性CETP和肿瘤坏死因子是第2种靶点,其通过接种疫苗促使自身机体产生抗体,抑制靶点的抗原效应遏制AS病变。
4. 机械损伤法建立AS模型
虽然以上3种方法在操作性和可行性上都能成功的复制AS模型,但不足的是实验周期过长,为了弥补这一缺点,研究学者们在高脂饲料喂养下联合手术的直接损伤作用于大鼠可加速AS的病变进程。主要的手术应用有以下几种:
4.1球囊损伤术
球囊损伤术是制备血管损伤后再狭窄模型的常见方法,此方法的主要操作是将一定直径大小的球囊放入动脉血管后充盈球囊,通过反复拖拉充盈后的球囊造成动脉血管内皮细胞损伤,造成内皮细胞的即刻脱落,弹力板及中膜严重损伤,引起局部血管狭窄。
进行球囊损伤手术时需要注意选择内径大小适宜的球囊,牵拉过程中速度、力度的把握以及对球囊扩张压力的控制。
球囊扩张太过、来回牵拉太快或操作人员用力过大都会容易造成动脉的破裂,过度损伤;反之扩张不够、牵拉过于缓慢又不能造成有效的内膜损伤,所以建立成功的AS模型,球囊损伤术对操作人员技术要求比较高。
在球囊损伤手术之后的3~5d需密切观察动物状态,还需腹腔注射青霉素钠防止术后感染,造成不必要的死亡与损伤。
4.2电击损伤术
此方法原理为通过一定的电击刺激可引起血管内膜损伤,激活血小板,血小板聚集后会释放出一些活性物质,这些物质则会促进内皮细胞损伤,使其损伤加重,随着时间的延长,可形成明显的AS斑块。
此手术方法对于电流强度与电击时间要求比较严格,电流强度过大时容易造成动脉血管壁出现比较明显的焦灼痕且容易导致动脉穿孔,电击造成的损伤严重破坏动脉血管壁结构,导致大鼠死亡率增高,这也是大多数研究者不常采用此方法的原因之一。
4.3动脉钳夹术
手术动脉钳夹法的原理是机械压迫阻断动脉正常供血,导致局部血管缺血缺氧,颈动脉内膜损伤,引发炎性反应,进而促进AS的发生。
使用血管钳夹住大鼠一侧颈动脉20min,手术后以高脂饮食喂养,6周时大鼠动脉内膜便有明显增厚,大量泡沫细胞聚集的现象,10周时形成典型纤维帽,成功建立大鼠AS模型。
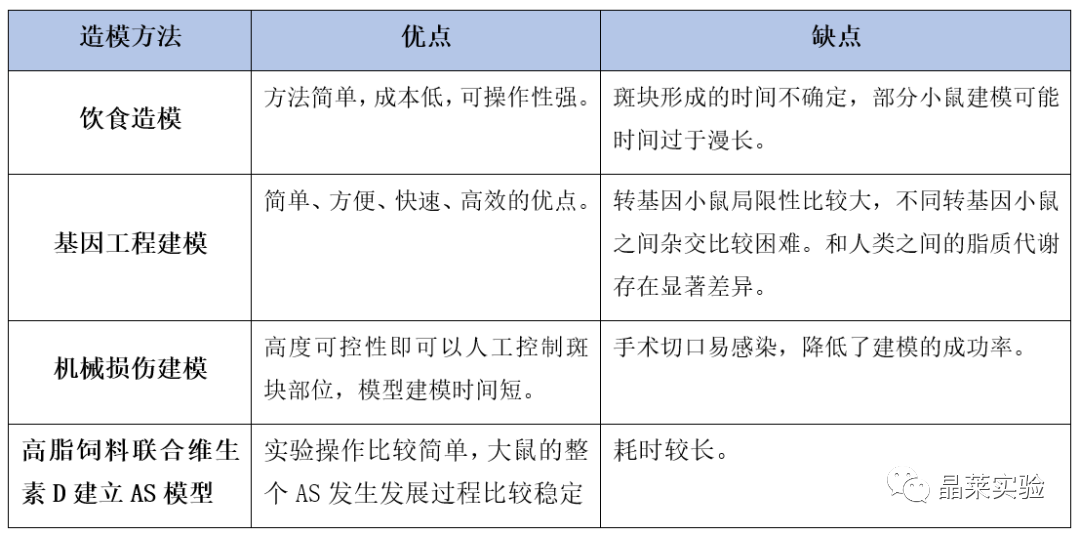
表2. 鼠-AS模型不同造模方法对比
单一造模方式周期较长,为此,建议使用多种方法相结合的AS建模方法,可迅速提高建模的速度:
饮食造模+基因工程可使建模时间缩短到12周。
基因工程+物理损伤可使建模时间缩短到16周。
饮食造模+物理损伤可缩短造模时间有望控制在10周左右。
综上,若追求建模速度,可以采用饮食造模+基因工程+物理损伤3种方法联合,可在最短时间内完成AS建模,形成明显AS斑块。
若研究目的包含基因或避免基因敲除干扰,可以采用饮食造模+机械损伤。
1. 喂养法建立兔AS模型
兔在脂肪代谢方面与人类有相似之处,且血浆中富含的CETP在AS发生和发展中起重要作用。
兔可以在肝中只合成对外源性胆固醇加快转运的载脂蛋白B,这就是兔可以短时间内仅通过单纯喂养高脂饲料就形成高胆固醇血症的最大优点,从而有利于兔AS模型的制备。
1.1 单纯高脂饲料喂养法兔
选择高脂兔饲料(含1%胆固醇,7.5%蛋黄粉,8%猪油,0.5%胆酸钠,0.1%丙硫氧嘧啶和81%普通兔饲料)喂养4周后发现兔高脂喂养组TC、LDL-C、HDL-C、VLDL分别为对照组的17.7、29.2、4.2、25.8倍,病理显示83%的兔模型存在早期AS,证明造模成功。
1.2 静脉注射脂多糖联合高脂饲料法
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性细菌细胞壁外壁的组成成分,也是内毒素的一种,是可以引起严重全身炎症反应的外源性物质之一,内皮细胞的损伤和LPS有着密切关系。而AS形成过程中的始动环节就是内皮细胞的损伤和功能的改变。
采用静脉注射脂多糖联合高脂饲料的方法,在相同实验条件下,通过兔耳缘静脉注射不同剂量(100、200、1000、2000ng/kg)的高纯级脂多糖引起发热性炎症反应,同时联合高脂饲料喂养建立兔AS模型。在造模的第5周时,血脂检测已达到高血脂水平,病理形态学显示有粥样坏死斑块形成,说明静脉注射LPS配合高脂饲料成功建立兔AS模型。
1.3 皮下注射L-蛋氨酸法
由于高同型半胱氨酸血症(HHcy)是AS形成的一个独立危险因素,因此高同型半胱氨酸所致的AS越来越受到重视。
采用L-蛋氨酸皮下注射法建立HHcy兔AS模型,结果发现L-蛋氨酸皮下注射80mg/(kg·d)4周可建立HHcy模型,12周时动脉粥样硬化表现明显。
皮下注射L-蛋氨酸能建立特殊的兔Hhcy-AS模型,对进一步探索HHcy与AS之间的联系,以及今后诊疗AS患者伴HHcy都能起到十分关键的作用。
1.4 静脉注射小牛血清白蛋白法
在喂养高脂饲料的基础上,喂养第1周初兔耳缘静脉一次性注射250mg/kg的牛血清白蛋白,10周后进行血脂水平的测定和标本的采集。结果发现模型兔TC、TG、LDL和HDL水平均明显升高,病理检查发现内膜增厚,纤维帽薄在斑块表面形成,斑块坏死,视野内平滑肌细胞稀少,呈现典型的动脉粥样硬化斑块,证明兔AS模型建立成功。
2. 机械损伤建立兔AS模型
2.1 动脉球囊拉伤联合高脂喂养法
球囊拉伤加高脂饲料喂养建立颈、腹主、髂AS模型广泛应用于AS的研究,模型建立方法也日趋成熟。
实验兔术前12h禁食,不禁水。以3%戊巴比妥钠30mg/kg静脉麻醉,从耳缘静脉给予肝素200U/kg,仰面固定。颈动脉球囊拉伤在正中切开皮肤5.0cm左右,暴露右侧颈总动脉后,远心端结扎,近心端用线提起,距颈内外动脉分叉点0.5cm约45度角V形剪开颈外动脉,逆行插入球囊(直径为2.5mm×1.0mm)约5cm,再连接压力泵,注入肝素生理盐水,加压2个大气压,自近心端缓慢回拉,反复3次后撤出导管即可。
股动脉拉伤是经右侧股动脉远端置入2.5mm×20.0mm球囊至股动脉近端,加压8~10个大气压,然后拉动球囊由近端向远端剥脱血管内皮,最后抽出球囊即可。
2.2 动脉球囊拉伤联合免疫注射法
兔的AS病变可以通过单独喂食高胆固醇饮食或结合动脉球囊损伤而容易诱发。与其他动物相比,兔对高胆固醇饮食敏感,可迅速发展为高胆固醇血症。
研究发现通过超声结合病理,来评价斑块数量、大小、回声情况,以及制备病理切片,在HE染色及油红O染色下观察其组织形态学变化及脂肪浸润情况。
发现高脂喂养加腹主动脉球囊拉伤术加注射小牛血清白蛋白比传统的高脂喂养加腹主动脉球囊拉伤所建立的AS模型,更稳定、更高效。
2.3 机械损伤联合维生素D法
维生素D可通过损伤动脉壁来诱发AS形成,如平滑肌细胞增殖形成增生性纤维斑块。
运用球囊拉丝损伤腹主动脉内膜后,除每日的基础饲料外,再给实验兔每日每只加1.5g胆固醇,到术后的第11、12周给实验兔皮下注射维生素D50万IU/kg,术后13周取材。结果显示,皮下注射维生素D的实验兔AS病变脂质条纹面积和纤维斑块面积的百分比分别为9.64%和1.56%,证明可成功建立AS斑块模型。
2.4 温控气体损伤与液氮冷冻损伤法
动脉粥样硬化易损斑块研究对急性心肌梗死、急性脑梗死等急性心脑血管疾病的治疗与预防都具有重要临床意义,但现今缺乏供研究的优质动物模型,但现在研究易损斑块的实验中,通常选用温控气体损伤法和液氮冷冻损伤两种办法。
于兔颈总动脉内膜施行液氮冻伤术,每次约0.5ml,快速反复注入3次,大约在2min内造成内皮冻伤,后用高脂饲料(配方:1%胆固醇、3%大油、15%蛋黄、81%普通饲料)喂养8周。此方法同基因局部转染加药物触发一样,也可用于动脉粥样硬化模型建立后易损斑块模型的构建,在实验的第8周末又一次予液氮冻伤术激发粥样斑块破裂,可成功制备动脉粥样硬化破裂斑块及血栓模型。
改良了液氮冻伤法,选择在进行高脂饲料(配方:1%胆固醇、3%大油、15%蛋黄、81%普通饲料)喂养1d后再实行液氮冻伤术,后继续喂养10周。结果显示,与传统方法比较,在第6周时就可形成典型的成熟动脉粥样硬化模型,缩短了造模时间。
3. 其它方法建立兔AS模型
空气干燥法
采用颈总动脉内膜空气干燥法建立AS模型,暴露右侧颈总动脉后,动脉夹夹闭血管近心端及远心端后,用4号头皮针沿血管长轴刺穿,生理盐水冲管后通气(120mL/min)5min,随后再次往管腔内注入生理盐水,松开动脉夹,按压止血。待出血停止后,缝合皮肤。4周后实验病理结果显示颈动脉可见内膜不规则增厚,证明建模成功。

表3. 兔-AS模型不同造模方法对比
关注公众号,了解更多!
