载体通常分为克隆载体(Cloning Vector)与表达载体(Expression Vectors)两种。
克隆载体大多是高拷贝载体,能够将外源基因与克隆载体的质粒连接,导入原核细菌内,进行大量复制克隆。主要用途是保存目的基因片段。
1. 在选择克隆载体时应注意:
③含有多种限制酶的单一识别序列,以供外源基因插入;④载体应尽可能小(<15kb),便于导入细胞和进行繁殖;⑤使用安全。克隆载体应只存在于有限范围的宿主内,在宿主体内不进行重组,不发生转移,不产生有害性状,并且不能离开工程宿主自由扩散。表达载体是为了使插入的外源DNA序列转录、翻译成多肽链而进行特殊设计的克隆载体。它含有特定的表达系统元件,即启动子--核糖体结合位点--克隆位点--转录终止信号。
2. 根据表达的类型,表达载体可分四类:
① 非融合型表达载体,如PKK223-3;
② 分泌型表达载体,如PINⅢ-ompA1;
③ 融合蛋白型表达载体,如PGEX;
④ 包涵体型表达载体,如pBV220。
在构建质粒时,设计引物时应该考虑引物长度、引物的GC含量、引物的Tm值等因素,并避免引物间出现配对突变或二次结构等情况。
前向引物:5’ 端 -- 上游克隆载体末端同源序列 + 基因正向扩增引物 --3’ 端
反向引物:3’ 端 -- 基因反向扩增引物 + 下游克隆载体末端同源序列 --5’ 端
运用PCR扩增目的基因的过程中,引物设计注意事项:
① 引物长度最好在18-30bp左右,常用的长度是 20-22bp;②引物 Tm 值最好在 60℃ 左右,两条引物间 Tm 值要保持接近,相差最好不要超过 5°C;③GC 的含量标准通常为 40%-60% 或45-55%;④引物自身不应含有连续超过4个的互补的碱基,避免形成发卡结构或形成引物二聚体;⑤引物的3' 端要避免出现连续重复的碱基,如 GGG 或 CCC ,这会导致错配的发生,最后一个碱基最好是 G 或 C;⑥在引物的 5′ 端添加酶切位点时(在不影响扩增的特异性的前提下),根据酶切位点序列,需要添加不同种类和数量的保护碱基,通常多加3个碱基即可满足保护酶切位点的需求;⑦上下游引物最好加入不同的酶切位点,相同的酶切位点可能导致目的基因片段出现倒置连接现象,影响基因序列的正常表达。
① 如结果出现引物二聚体、非特异性条带(大小不对)的现象,可以通过降低模板和引物的浓度、降低镁离子浓度、适当减少酶量,提高退火温度,来提高扩增特异性。② 若出现凝胶条带弥散状态,多为模板不纯、反应体系中各成分比例不合适、退火温度设置偏低、循环次数过多等原因。③ 长片段基因的扩增容易增加点突变和错配率,选用高扩增能力、高保真、可靠性强的聚合酶也很关键。
选择合适的剪切酶和连接酶对于质粒构建至关重要。剪切酶的选择应该考虑酶切位点的位置、酶的反应条件等因素。连接酶的选择应该根据所用的质粒载体和目的基因的大小来确定。
① 选择质粒上两个酶切位点的距离不应小于太小(>10bp),否则影响限制性内切酶对切点的识别,不利于空载体的双酶切。② 一般目的基因用于克隆表达的情况下,酶切位点的选择要考虑到:目的基因片段内部不含有所选的酶切位点(不然鉴定阳性重组子双酶切时会将目的基因切断)。③ 实验后继应用的所有载体(真核、原核、酵母、昆虫)都尽可能含有所选的酶切位点。并且要保证在载体上的插入方向正确(定向克隆)。(不然换载体表达时,还要重新设计引物,以引进新的酶切位点)。④ 尽可能选比较常用的酶切位点(常用切点酶的价格比较便宜)。⑥ 两个酶切点最好不要是同尾酶(切下来的残基不要互补),否则效果相当于单酶切。⑨ 在操作酶切连接的步骤时也要定性定量,保证酶活性充足。
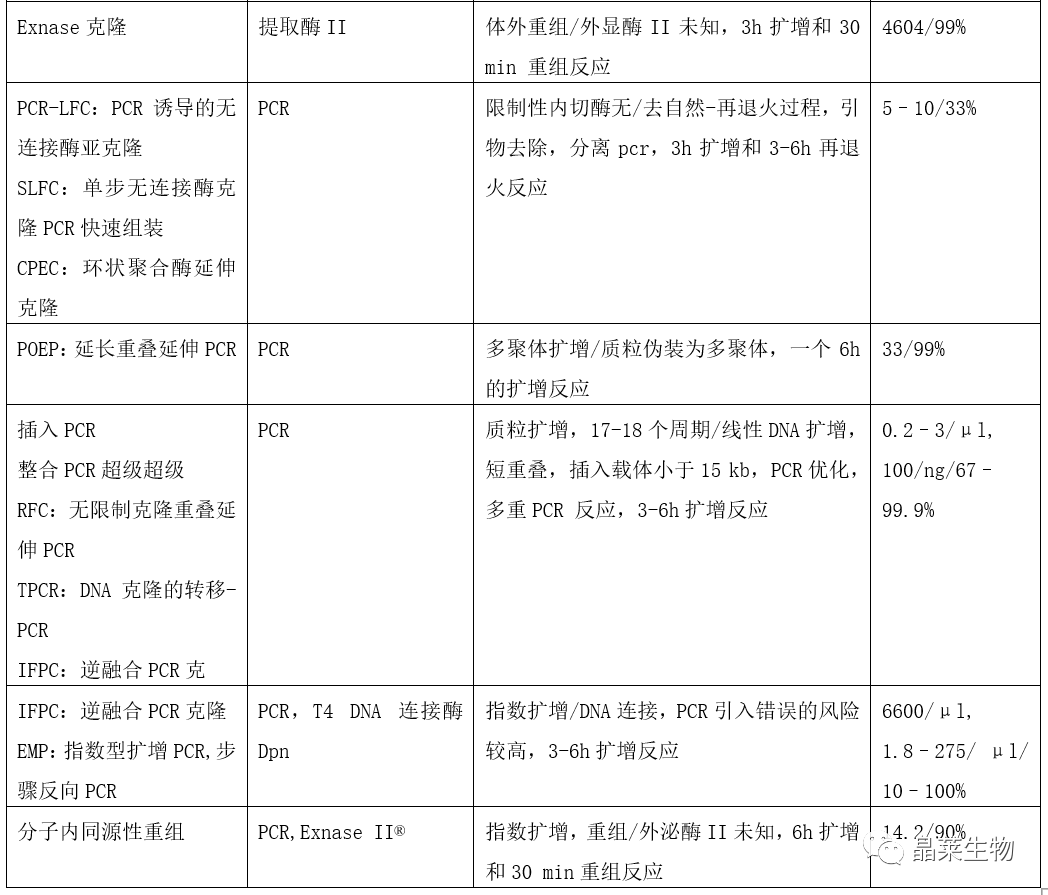
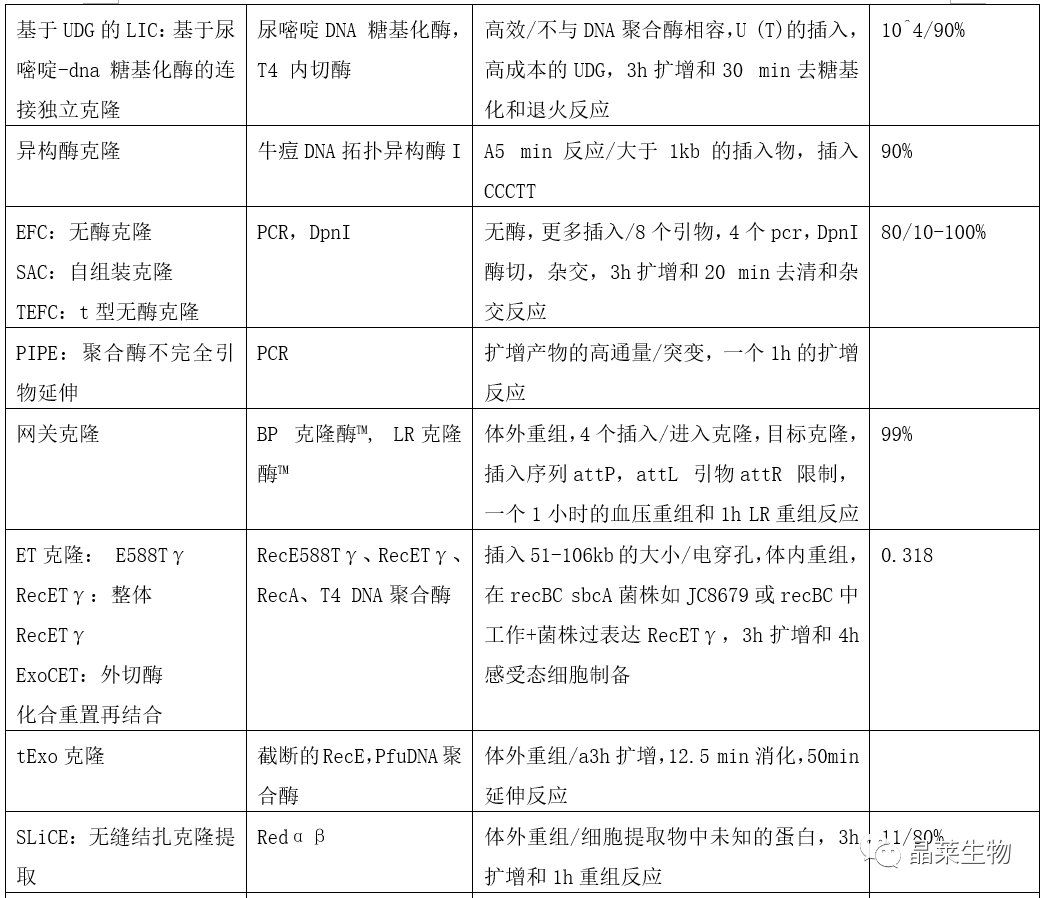
根据质粒构建的三种基本原理,总结了多种构建方法。