
Bcl11b is essential for licensing Th2 differentiation during helminth infection and allergic asthma

期刊:nature
发表时间:2018
影响因子:17.694
研究背景
Th2 分化中的信号通路。IL-4 与 IL-4 受体的结合导致信号转导和转录激活因子 6 (STAT6) 的磷酸化和二聚化。STAT6 二聚体易位到细胞核中,促进 Th2 主调节因子 GATA 结合蛋白 3 (GATA3) 的表达。GATA3 结合并修饰 IL5–IL13–IL4 基因座,从而导致 Th2 相关细胞因子的表达增强。
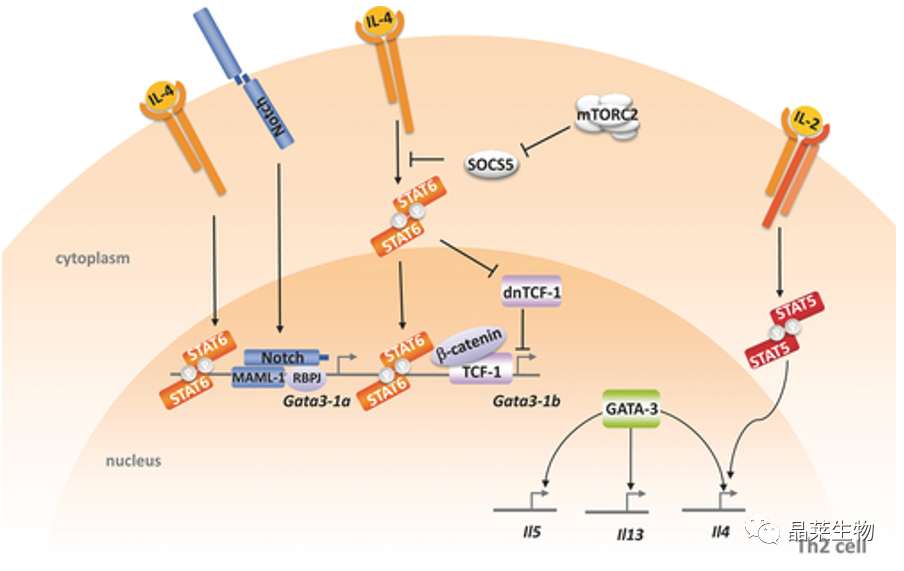
LCR(locus-control regions): Th2细胞因子的基因座区域,包含Il4、Il5和Il13基因,位于Rad50基因的3′端。

Bcl11b:既是转录抑制因子,又是转录激动因子。在蠕虫感染和过敏性哮喘体外实验中,CD4+T,在IL4-STAT6-GATA3通路作用下分化为Th2细胞这条通路得到验证,但是在体内实验却发现有很多矛盾的地方。
所以这篇文章探索在体内实验Th2细胞分化过程中Bcl11b起到的重要作用。
研究结果及分析
1. 在T细胞中敲除Bcl11b后,减弱过敏性哮喘。
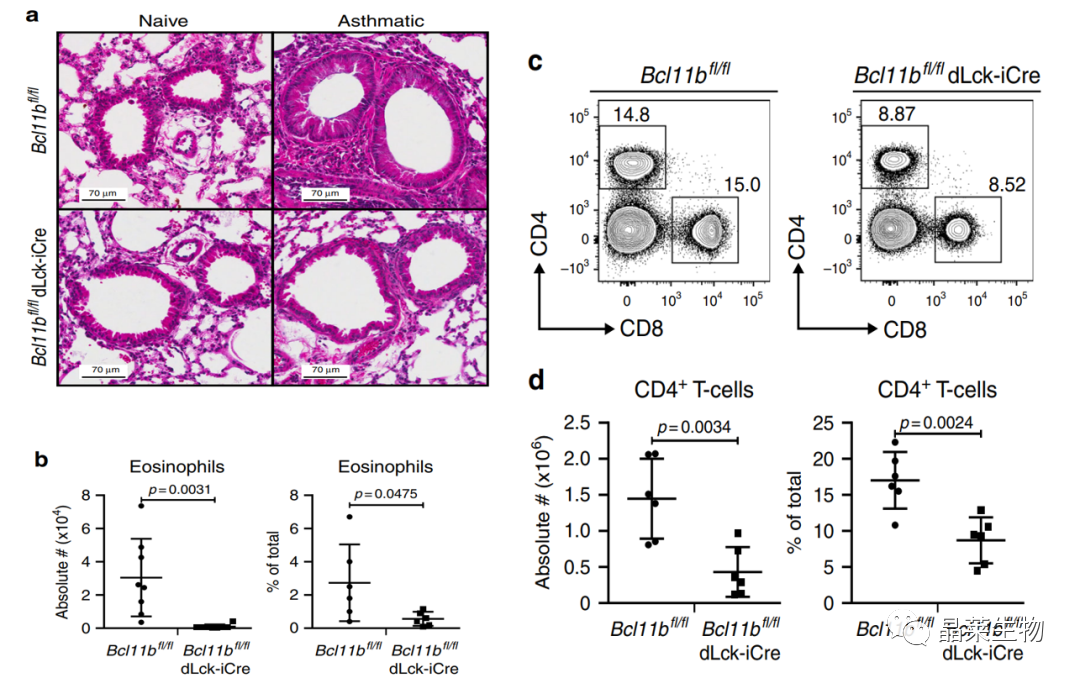
A:尘螨HDM致敏29天后,基因敲除鼠无论是未激发阶段还是激发阶段,通过肺实质切片的HE染色可见数量减少的嗜酸性粒细胞。
B图为嗜酸性粒细胞计数。
C为HDM诱导哮喘后基因敲除鼠比非基因敲除鼠的CD4+T和CD8+T数量均降低。
从过敏性哮喘动物模型体内实验,发现Bcl11b基因敲除鼠引起嗜酸性粒细胞和CD4+T,CD8+T的显著性降低,从而过敏性哮喘相关的病理情况减弱。
2. T细胞中敲除Bcl11b后,减弱蠕虫引起的免疫反应。
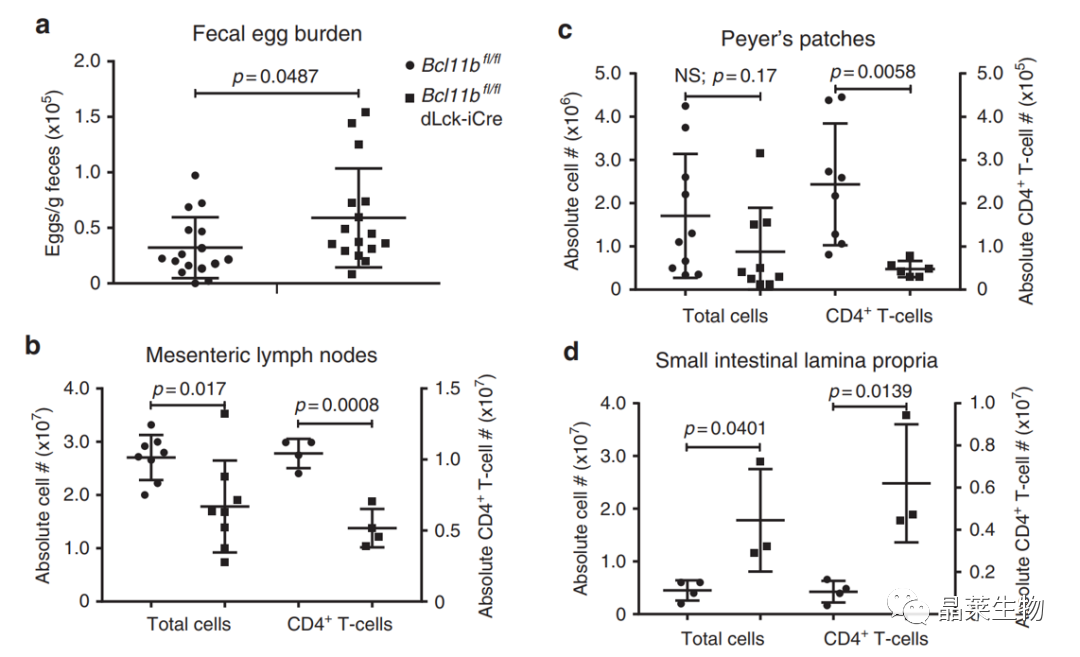
感染Fecal egg burden后,基因敲除鼠的卵负荷率显著性增高;
B来自肠系膜淋巴结的总白细胞和CD4+T细胞的数量,基因敲除鼠是降低的;
D来自小肠的总白细胞数和CD+T细胞数,基因敲除鼠数量增加。
蠕虫感染模型,体内实验发现Bcl11b基因敲除鼠对虫卵的抗炎作用减弱。基因敲除鼠小肠淋巴结白细胞比例增高,上调CCR9,虫卵负荷量增高。
3. Bcl11b基因缺失的Th2细胞从mRNA水平下调Th2所分泌的细胞因子
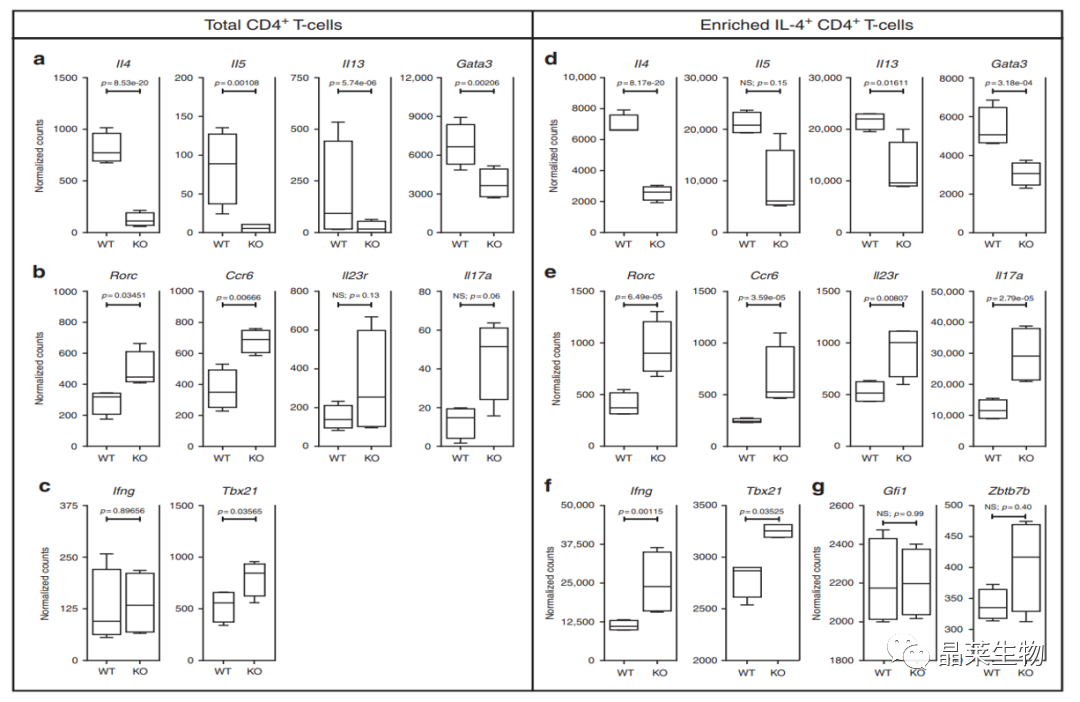
Th2分泌的细胞因子A,Th17分泌的细胞因子B,Th1分泌的细胞因子C,在感染polygyrus bakeri后取基因敲除鼠和非基因敲除鼠肠系膜淋巴结的细胞因子检测,可见基因敲除鼠Th2相关细胞因子上调,Th17和Th1相关细胞因子表达下调。
D-f为哮喘诱导的基因敲除鼠肺实质中IL4+-CD4+T细胞各细胞因子mRNA检测值。
G图为 Gfi1 and Zbtb7b mRNA检测。
过敏性哮喘肺组织和蠕虫感染动物模型的肠系膜淋巴结中出现CD4+T细胞亚群的相同变化趋势。Bcl11b增强Th2细胞因子和Gata3细胞因子。
4. 发生过敏性哮喘和蠕虫感染后,Bcl11bfl/fl dLck-iCre小鼠表达Gata3和Th2细胞因子的CD4+T比率降低
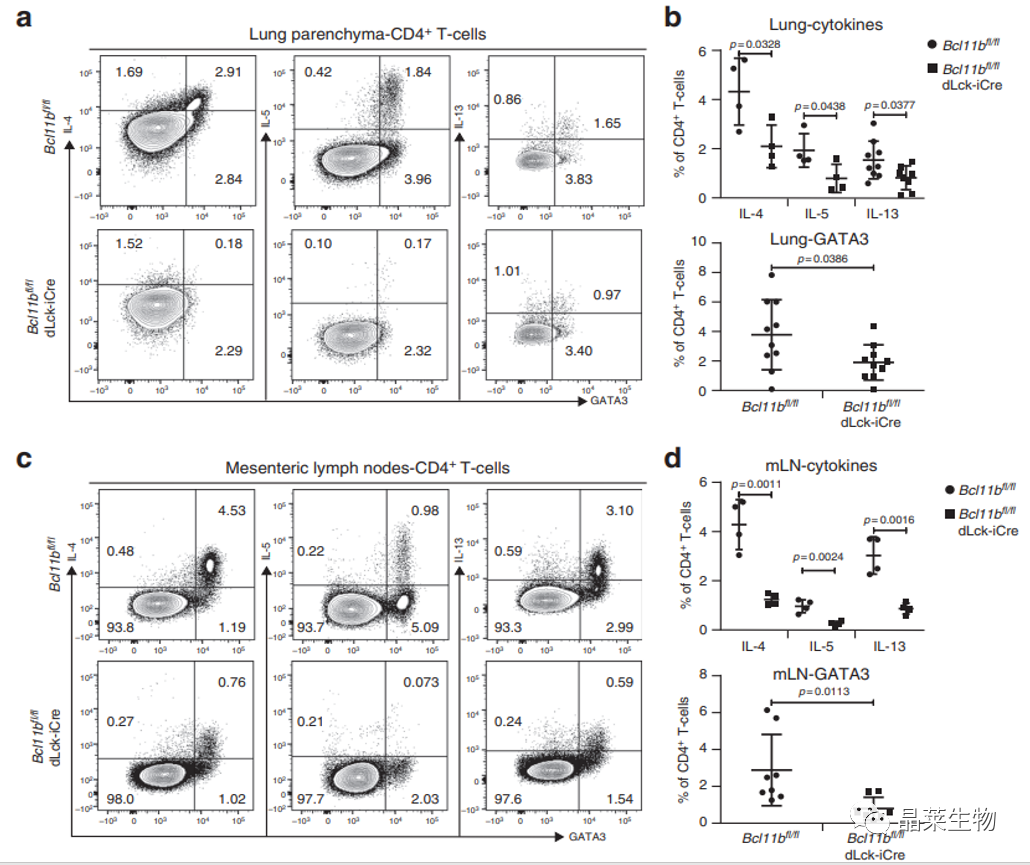
A图:HDM诱发哮喘小鼠肺部CD4+T中IL4,IL5,IL13阳性的细胞比率,基因敲除鼠低于非敲除鼠;
B图:为细胞数;
C图:为感染H.polygyrus后小鼠肠系膜淋巴结的CD4+T细胞,IL4,IL5,IL13和Gata3阳性的细胞比率,基因敲除鼠低于非基因敲除鼠。
D为细胞计数。
取过敏性哮喘模型小鼠的肺脏,蠕虫感染动物模型小鼠肠系膜淋巴结,检测IL4,IL5,IL13阳性,以及Gata3阳性的差别,基因敲除鼠显著性减低。
Th2分泌相关细胞因子是不是基因层面的问题?
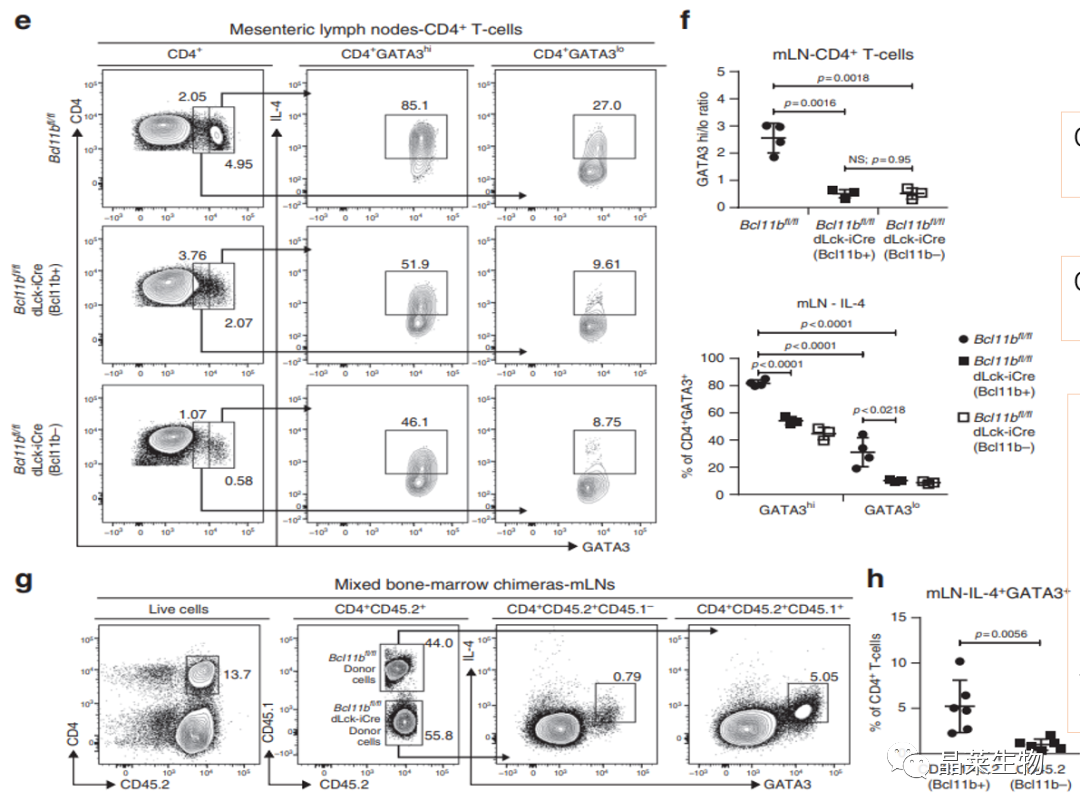
H.Polygyrus bakeri感染小鼠的mLN的CD4+T和IL4中GATA3的流式细胞术分析。
G. IL4的流式细胞术分析和感染H.polygyrus bakeri的混合骨髓嵌合小鼠mLN中的CD4+T细胞中的GATA3。来自WT供体的细胞是CD45.1/CD45.2,而来自基因敲除鼠供体的细胞是CD45.2.h. 感染了H.polygyrus bakeri后混合骨髓嵌合小鼠mLNs中IL4+GATA3+细胞的频率。

Bcl11b- CD4+T不能进行Th2的线性分化;
即使Gata3水平高,也不能产生IL4;
骨髓混合移植:证明Gata3和IL4的遗传水平与细胞内遗传有关;野生鼠CD45.1/2:敲除鼠45.2放入CD45.1鼠中,结果IL4和Gata3仍然很低。
5. 野生小鼠体内,Bcl11b与Th2的基因座区、Gata3相结合
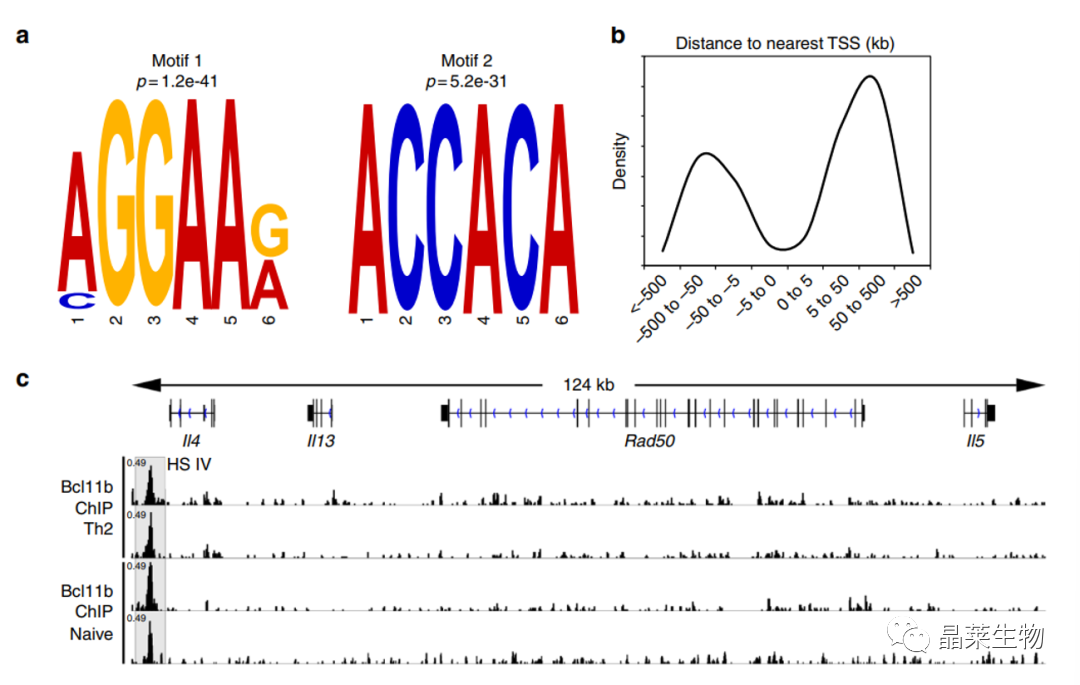
A:使用MEME-ChIP图案分析软件从感染WT小鼠的CD4+T细胞的B:cl11bChIP-seq中发现的前两个Bcl11b结合图案。
B相对于最近的转录起始位点(TSS),Bcl11b结合的密度分布。数据来自基因组c-e综合基因组学查看器对Th2细胞因子位点的Bcl11bChIP-Seq轨迹进行可视化。
C:IL4 IV沉默器被突出显示。
从感染的WT小鼠的CD4+T的Bcl11bChIP-seq中发现两个Bcl11b结合图案,以及结合的密度分布。IL4 HSIV沉默区突出明显。
5.野生型小鼠Bcl11b在Gata3基因座及下游区域结合,在IL4 HS IV 沉默区结合
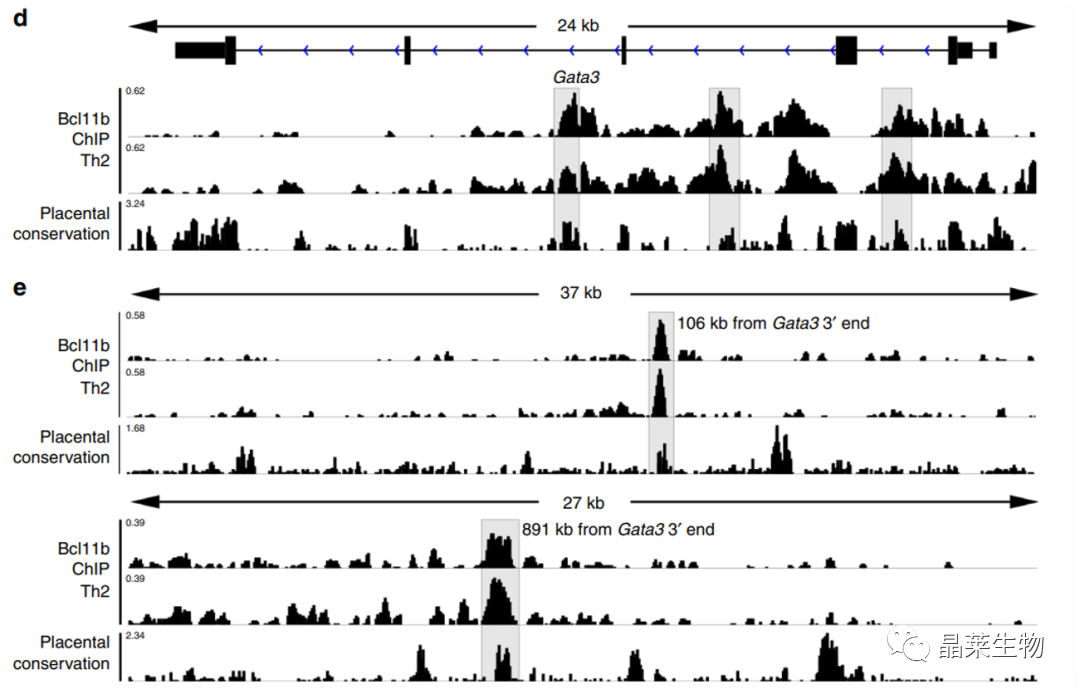
D图,Gata3的内含子区域被突出显示。
E图,Gata3下游保守的非编码结合位点被突出显示。
Bcl11b在Gata3内含子区域突出明显;在Gata3下游非编码区突出明显。
6.敲除Bcl11b导致染色质在Th2 基因座区域可结合性降低,在IL4 HS IV沉默区可结合性增强
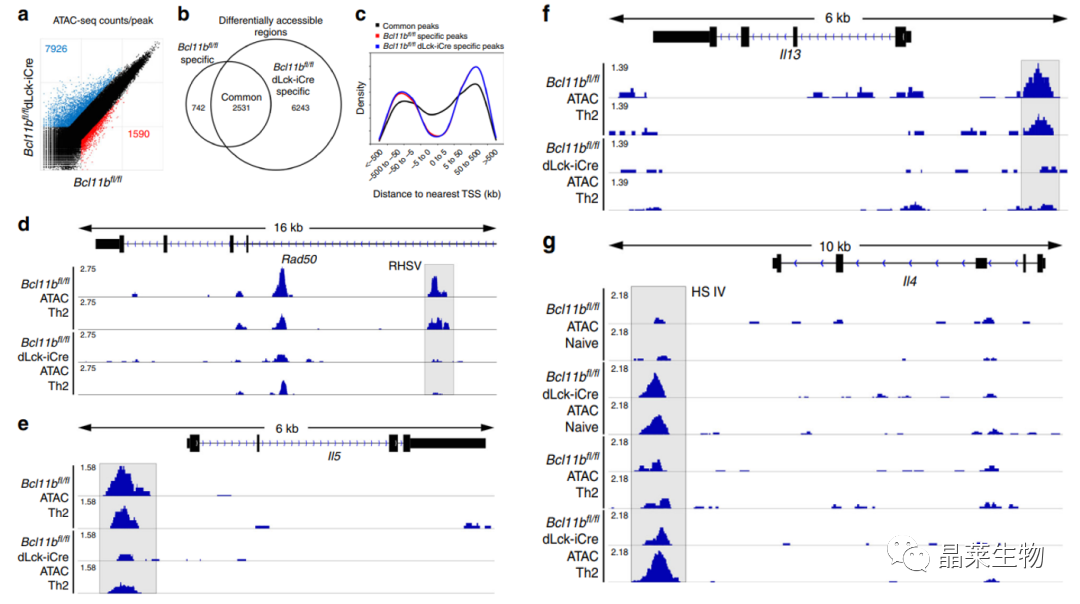
A.:ATAC-seq每个峰的归一化覆盖率的散点图;
B:基因敲除鼠和非基因敲除鼠显著性差异物质的韦恩图。
C:相对于最近的转录起始位点(TSS)的可及区域的密度分布。
D-G:为综合基因组学查看器对ATAC-Seq轨迹的可视化.D.在Rad50 Th2 LCR(RHS V突出显示)。
E:IL5启动子突出显示;
F:IL13启动子突出显示。
G:IL4 HS IV沉默器突出显示。
结果5和6的对比说明Bcl11b使染色质在Th2基因座区域可结合性增强,在IL4 HS IV沉默区可结合性减弱,Bcl11b可以促进IL4的分泌,可以促进Th2分化,细胞因子的分泌 。
7.Bcl11b与Runx3基因座上游的增强子结合以抑制CD4+T细胞中的Runx3表达
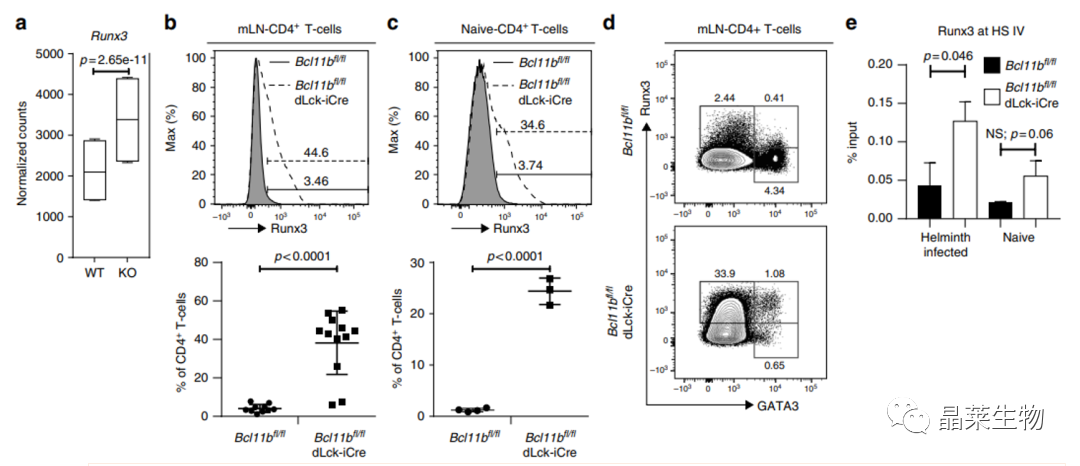
基因敲除鼠和非基因敲除鼠在感染螺旋体后,对小鼠的肠系膜淋巴结和幼稚的CD4+T进行分析。
A:可见敲除鼠CD4+T细胞的RUNX3较高;
B:肠系膜淋巴结CD4+T,和幼稚CD4+T在基因敲除鼠中RUNX3阳性的表达增多。
D:流式细胞分析仪分析Runx3与Gata3在感染螺旋体小鼠肠系膜淋巴结中的总CD4+T细胞中的作用。
E:通过Runx3 ChIP-qPCR确定Runx3在HS IV沉默器上的富集程度,这些细胞分离自受螺旋体感染小鼠的肠系膜淋巴结或幼稚小鼠的脾脏和外周淋巴结的CD4+T细胞。ChIP-PCR富集度以输入的百分比表示。
Bcl11b可以抑制CD4+T细胞中的Runx3的表达。
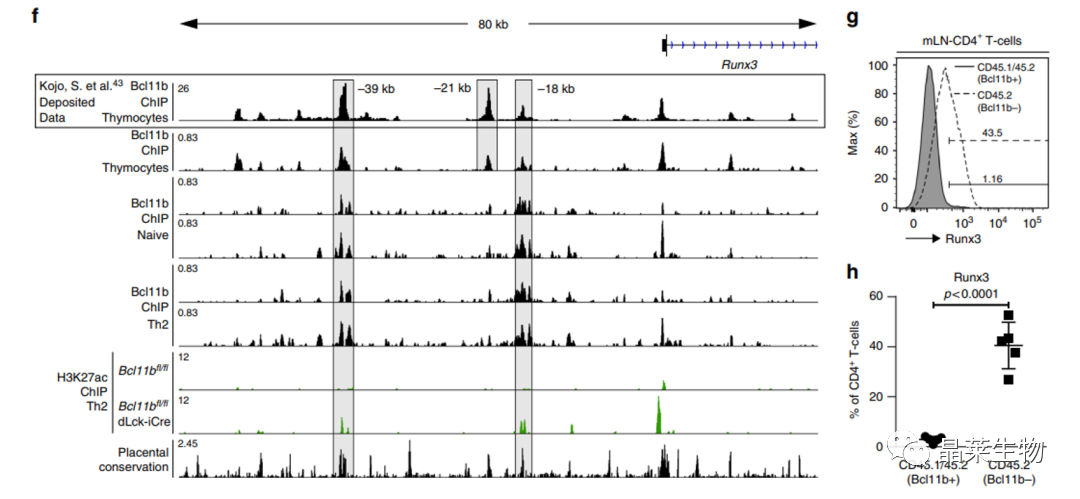
f-g:Runx3在混合骨髓嵌合小鼠MLNs中的直方图;
h:混合骨髓嵌合小鼠(n = 5)感染H. polygyrus bakeri的MLNs的CD4+T细胞中Runx3+细胞的频率。
通过ChIP实验发现敲除鼠的,Runx3在HSIV区域显著增多,Bcl11b对Runx3起到负调控作用。
文献结论
在体内幼稚和Th11反应期间Bcl2b的缺失导致Runx3的抑制,以及Runx3进入Il4 HS IV消音器的途径。这些事件与降低的GATA3一起导致Th2 LCR和Th2基因启动子处的染色质可及性降低,进一步导致Th2分化降低。
这些结果共同表明,Bcl11b以允许Th4分化的方式引发幼稚的CD2 T细胞,并且Bcl11b的缺失导致Th2谱系的有效许可失败。
结果确立了Bcl11b在体内许可Th2程序的调控环中的新作用。
文献涉及实验技术
关注公众号,了解更多!
