
转染是做生物学实验的大家经常会考虑的一项实验技术,大致原理也都是明白的。但是在实验时经常会遇到转染效率太低,以至于无法进行后续的实验。
到底转染是什么呢?
转染实验有哪些注意事项呢?
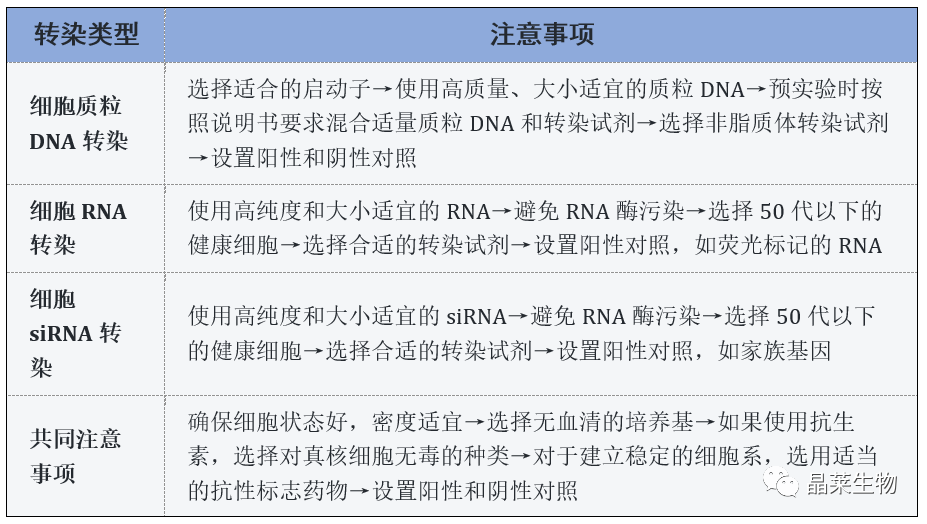
如为贴壁生长细胞,一般要求在转染前一日,必须应用胰酶处理成单细胞悬液,重新接种于培养皿或瓶,转染当日的细胞密度以70-90%(贴壁细胞)或 2×106-4×106细胞/ml(悬浮细胞)为宜,最好在转染前4h换一次新鲜培养液。
用于转染的质粒DNA必须无蛋白质,无RNA和其他化学物质的污染,OD260/280比值应在1.8以上。
1. 培养基中的血清
在开始准备DNA和阳离子脂质体试剂稀释液时要使用无血清的培养基,因为血清会影响复合物的形成。其实,只要在DNA-阳离子脂质体复合物形成时不含血清,在转染过程中是可以使用血清的。
2. 培养基中的抗生素
抗生素是影响转染的培养基添加物。这些抗生素一般对于真核细胞无毒,但阳离子脂质体试剂增加了细胞的通透性,使抗生素可以进入细胞。这降低了细胞的活性,导致转染效率降低。这时候可以选择英格恩生物的Entranster转染试剂,非脂质体试剂,培养基可加抗生素,避免了细胞染菌。
3. 设置阳性对照和阴性对照。
一般在转染24-48h,靶基因即在细胞内表达。根据不同的实验目的,24-48h后即可进行靶基因表达的检测实验。
如若建立稳定的细胞系,则可对靶细胞进行筛选,根据不同基因载体中所含有的抗性标志选用相应的药物,常用的真核表达基因载体的标志物有潮霉素和新霉素等。
1. 启动子的选择
启动子的选择对于转染基因的有效表达是非常重要的。对于转染过程本身虽然无甚影响,但是对转染结果却有着微妙的影响。
2. 质粒的大小和质量
线性化还是超螺旋会影响转染结果:超螺旋质粒的转染效率比线性DNA高得多,特别是瞬时转染。而线性化DNA转染的整合几率高。质粒太大了转染会困难一些。毕竟,相对致密、较小的外源异物被细胞内吞的几率要大一些。如果你的质粒正好比较大,又没有经验,选择特别注明可以转大质粒的转染试剂成功几率会高一些。有的转染试剂还会提供一些促进DNA凝聚的成分,使得DNA形成转染复合物时更致密一些,更容易转染一些。纯化质粒的质量也会影响转染效率,一定要选择高质量的质粒。
3. 质粒DNA的浓度和量
既然质粒纯化已经不成问题,初学者通常都不会在乎甚至愿意多加点DNA,但是要注意的是,DNA量过少固然转染效率不高,DNA量过多同样会降低转染效率。所以预实验需要按照说明书的要求,按一定比例混合适量的质粒DNA和转染试剂。有的转染试剂要求DNA的量多些,有的转染试剂效率高只要很少DNA。
4. 转染试剂的选择
在确定了质粒的质量之后,就要考虑转染试剂的选择了。目前大多数用的是脂质体类的转染试剂,但这类试剂的毒性较大,转染效率低,最好选择非脂质体的转染试剂,如Entranster试剂。
1. 优化条件
质粒不同,所转染的细胞不同及定量的准确性等因素会导致在一些情况下所做的转染不在该优化条件内。这种情况下需要对质粒转染试剂的配比进行优化。另外,可选用更合适的转染试剂,如Entranster试剂。
2. 抑制剂
不要在用于制备DNA-转染试剂复合物的培养基中使用抗生素,EDTA,柠檬酸盐,磷酸盐,RPMI,硫酸软骨素,透明质酸,硫酸葡聚糖或其他硫酸蛋白多糖。
3. 细胞状态及融合度
长势旺盛的细胞转染效果更佳,细胞密度应该在转染时融合度至少70%以上。
4. DNA纯度及数量
确保质粒OD值A260/A280在1.8~2.0之间。DNA量不能太高,单独DNA也会对细胞生长有一个基础的影响。
1. 纯化RNA
在转染前要确认RNA的大小和纯度。为得到高纯度的RNA,推荐用玻璃纤维结合,洗脱或通过15-20%丙烯酰胺胶除去反应中多余的核苷酸,小的寡核苷酸,蛋白和盐离子。注意:化学合成的RNA通常需要跑胶电泳纯化(即PAGE胶纯化)。
2. 避免RNA酶污染
微量的RNA酶将导致RNA实验失败。由于实验环境中RNA酶普遍存在,如皮肤,头发,所有徒手接触过的物品或暴露在空气中的物品等,此保证实验每个步骤不受RNA酶污染非常重要。
3. 健康的细胞培养物和严格的操作确保转染的重复性
通常,健康的细胞转染效率较高。此外,较低的传代数能确保每次实验所用细胞的稳定性。为了优化实验,推荐用50代以下的转染细胞,否则细胞转染效率会随时间明显下降。
4. 选择合适的转染试剂
针对RNA制备方法以及靶细胞类型的不同,选择好的转染试剂和优化的操作对RNA实验的成功至关重要,如Entranster试剂。
1. 纯化siRNA
siRNA的浓度和纯度对转染实验非常重要。为得到高纯度的siRNA,推荐用玻璃纤维结合,洗脱或通过15-20%丙烯酰胺胶除去反应中多余的核苷酸,小的寡核苷酸,蛋白和盐离子。注意:化学合成的RNA通常需要跑胶电泳纯化(即PAGE胶纯化)。
2. 避免RNA酶污染
微量的RNA酶将导致siRNA转染实验失败。由于实验环境中RNA酶普遍存在,如皮肤,头发,所有徒手接触过的物品或暴露在空气中的物品等,因此保证实验中的每个环节不受RNA酶污染非常重要。
3. 健康的细胞培养物和严格的操作确保转染的重复性
通常,健康的细胞转染效率较高。此外,较低的传代数能确保每次实验所用细胞的稳定性。为了优化实验,推荐用50代以下的转染细胞,否则细胞转染效率会随时间明显下降。
选择合适的转染试剂
针对siRNA制备方法以及靶细胞类型的不同,选择好的转染试剂和优化的操作对siRNA实验的成功至关重要。如Entranster试剂。
4. 通过合适的阳性对照优化转染和检测条件
对大多数细胞,看家基因是较好的阳性对照。将不同浓度的阳性对照的siRNA转入靶细胞(同样适合实验靶siRNA),转染48小时后统计对照蛋白或mRNA相对于未转染细胞的降低水平。过多的siRNA将导致细胞毒性以至死亡。
5. 通过标记siRNA来优化实验
荧光标记的siRNA能用来分析siRNA稳定性和转染效率。标记的siRNA还可用作siRNA胞内定位及双标记实验(配合标记抗体)来追踪转染过程中导入了siRNA的细胞,将转染与靶蛋白表达的下调结合起来。
1. 选择合适的转染试剂
原代细胞对不同的转染试剂有不同的敏感性和稳定性。因此,在选择转染试剂时,需要根据细胞类型和实验需求进行筛选。
2. 优化细胞密度
不同的原代细胞对细胞密度的要求不同,过低或过高的细胞密度可能会影响转染效率。因此,在转染前需要通过培养时间和培养条件等因素来优化细胞密度。
3. 使用合适的载体
选择合适的载体可以提高转染效率和稳定性。常用的载体包括质粒、病毒和RNA。
4. 优化转染条件
优化转染条件可以提高转染效率和降低细胞毒性。常用的优化参数包括转染时间、转染试剂浓度、细胞密度和培养基配方等。
5. 合理控制细胞状态
在转染前,需要确保细胞状态良好,避免细胞过早或过度增殖,以免影响转染效率。
6. 进行对照实验
进行对照实验可以帮助确定转染效率和细胞毒性。对照实验可以包括转染绿色荧光蛋白或无相关蛋白的质粒,以检验转染效率和蛋白表达情况。
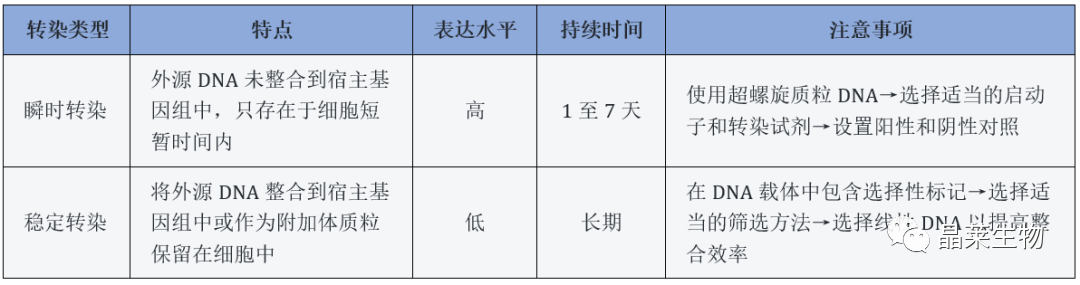
以上均为细胞转染实验瞬时转染的实验注意事项内容,接下来小编带大家一起了解细胞转染实验稳定转染的实验注意事项。
1. 细胞状态:确保细胞的状态好,并且在转染前处于指数生长阶段;
2. 转染试剂选择:选择适当的转染试剂,不同类型的细胞和外源DNA可能需要使用不同的试剂进行转染;
3. DNA质量:使用高质量、大小适宜的DNA(如使用端粘性或带缺失的DNA片段会影响转染效率);
4. 转染时间:根据所用的转染试剂和细胞类型,确定适当的转染时间;
5. 筛选方法:选择合适的筛选方法以筛选出稳定转染的细胞系;
6. 抗生素浓度:添加足够的抗生素使得非转染的细胞死亡,而转染的细胞能够存活并形成稳定的细胞系。
7. 对照组设置:设置阳性和阴性对照以评估转染效果和筛选是否成功。
此外,为了获得比较可靠的结果,还需限制一些可能干扰实验的因素,例如避免RNA酶污染、选择50代以下的健康细胞、使用无血清培养基等。
8. DNA浓度:在进行细胞转染实验时,要注意DNA浓度的控制。过高或过低的DNA浓度都会影响转染效率,最好做一次预实验确定最佳的DNA浓度;
9. 质粒选择:不同类型的质粒对细胞的毒性和稳定转染效率的影响不同,因此应根据实验需要选择适当的质粒载体;
10. 细胞密度:细胞密度不宜过高或过低,否则会影响转染效果。通常建议将细胞密度控制在指数期的70-80%;
11. 转染温度:转染时所处环境的温度会对转染效果产生影响,通常情况下需要在37℃恒温培养箱中进行转染;
12. 筛选时间:在进行稳定转染实验时,需要进行足够长的筛选时间以检测出稳定转染的细胞系。
13. 合适的启动子:选择合适的启动子能够显著影响转染效率和表达水平。应根据实验需要选择适当的启动子,例如CMV启动子、SV40启动子等;
14. 转染前处理:在进行细胞转染实验之前,有些实验可能需要进行预处理,例如酶消化、药物处理等,以提高转染效率或引入特定变异。预处理方法应根据实验需要选择;
15. 避免细胞过度分裂:过度分裂会导致DNA拆分,降低转染效率和稳定转染的概率。因此,在进行细胞转染实验时需要注意避免细胞过度分裂;
16. 质粒净化:在进行细胞转染实验时,应使用高质量的DNA质粒,这需要进行质粒净化。质粒净化方法的选择与所用的载体相关,可以采用商业化的质粒提取试剂盒或自制的离子交换或凝胶过滤层析柱。
总之,进行细胞转染实验需要认真筛选条件和方法,注意细节操作,并严格按照实验计划进行,以确保实验结果的准确性和可靠性。
关注公众号,了解更多!
