
食管癌是消化道常见及高发的恶性肿瘤之一,目前因动物模型研究和开发的滞后,临床上对食管癌的发生、发展及肿瘤免疫学机制尚缺乏深入系统的认识,严重影响疾病的精准治疗与预后判断。
食管癌的组织学类型主要包括鳞癌与腺癌。在我国,鳞癌所占比例高达90%。

多项研究表明,食管癌的发生是环境因素与遗传因素共同作用的结果。其中环境因素主要包括营养缺乏和不良生活习惯等方面;遗传方面的病因机制研究结果显示,人体细胞内遗传物质发生改变后,许多抑癌基因失活,促癌基因被激活过表达,从而导致食管癌的发生。
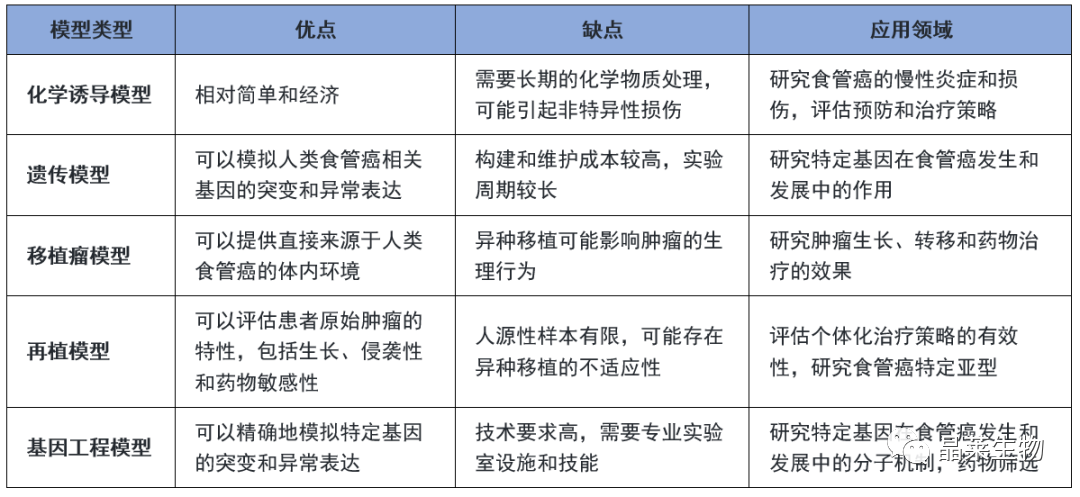
构建食管癌模型可以使用不同的方法,下面列举几种常见的方法:
1. 化学诱导模型
使用化学物质(如硝基胍、二甲亚硝胺等)在动物体内诱导食管癌。这种方法通常会引起慢性炎症和损伤,促进食管癌的发生。
2. 遗传模型
利用转基因技术或基因敲除技术,在实验动物的基因组中引入相关的癌症相关基因或突变基因,以模拟人类食管癌的发生和发展过程。
3. 移植瘤模型
将人类食管癌细胞或组织移植到实验动物的食管内,形成异种移植瘤模型。这种模型可以用于研究肿瘤生长、转移以及药物治疗的效果评估。
4.再植模型
将患者的癌组织移植到裸鼠或其他实验动物体内,形成再植模型。这种模型可用于评估患者原始肿瘤的特性,包括生长、侵袭性和药物敏感性等。
5. 基因工程模型
使用CRISPR-Cas9或其他基因编辑技术,针对特定的癌症相关基因进行突变或敲除,以构建食管癌基因工程模型。
造模方法对比
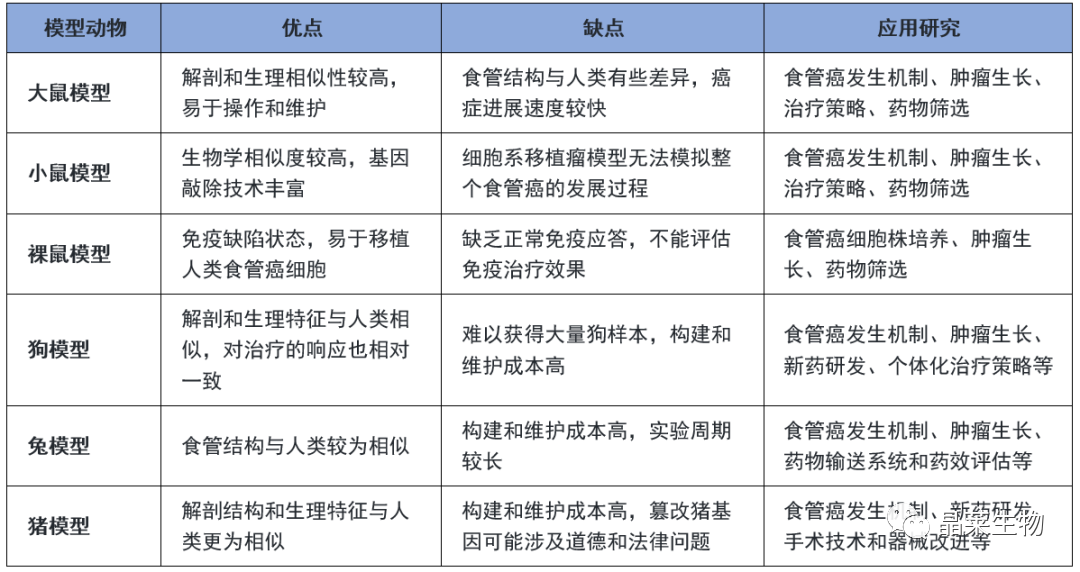
模型动物选择
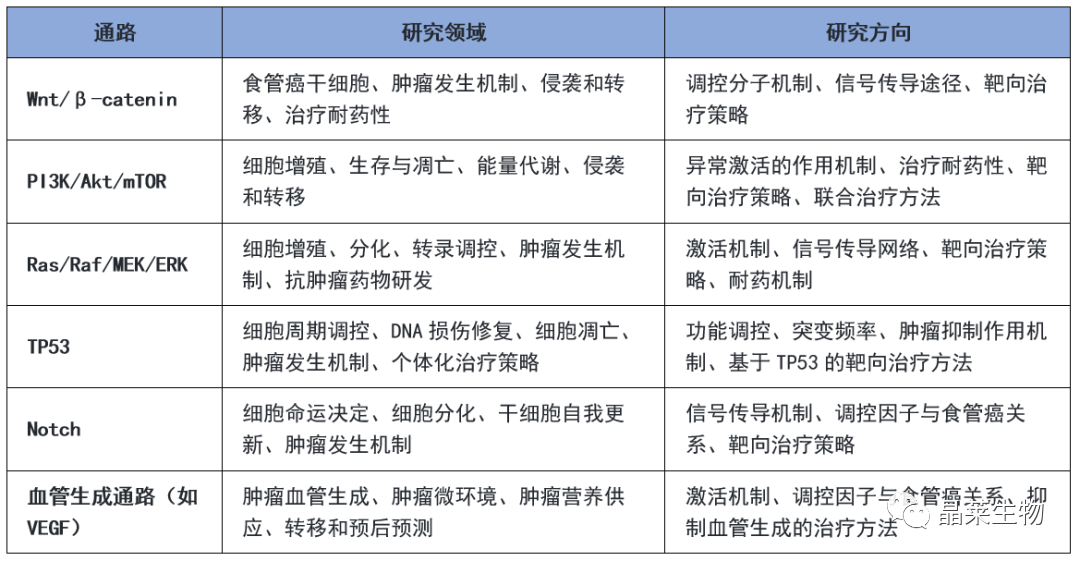
食管癌其发生和发展涉及多个机制通路。以下是一些常见的食管癌相关机制通路及其对应的研究领域和方向:
食管癌的相关课题研究思路可以从以下几个方面展开:
1. 分子机制研究
探索食管癌发展和进展的分子机制,包括上述提到的常见通路以及其他可能涉及的信号传导途径。通过基因组学、转录组学、蛋白质组学等高通量技术,鉴定关键的基因突变、表达异常以及信号通路激活与抑制的调控因子。
2. 肿瘤干细胞研究
食管癌干细胞在肿瘤的起始、耐药性和复发中起着重要作用。探索食管癌干细胞的来源、特征、分化状态、自我更新能力以及与肿瘤发展和治疗耐药性之间的关系,为靶向干细胞治疗提供理论依据。
3. 肿瘤微环境研究
食管癌的发展不仅受到肿瘤细胞的内在变化影响,还与周围的细胞、基质和血管等构成的肿瘤微环境密切相关。研究肿瘤微环境对食管癌生长、侵袭、转移和耐药性的影响,包括肿瘤相关的免疫抑制、血管生成、细胞外基质重塑等,为靶向肿瘤微环境的治疗策略提供理论支持。
4. 早期诊断和预测标志物研究
发展食管癌的早期诊断方法,寻找敏感和特异的分子标志物,如血液中的循环肿瘤DNA、蛋白质标记物或非编码RNA。此外,也可以探索预测食管癌患者治疗效果和预后的生物学标志物。
5. 新型治疗策略研究
基于上述分子机制研究和肿瘤微环境了解,开发新型的靶向治疗策略,例如针对特定信号通路的靶向药物、免疫治疗、细胞基因治疗等。此外,还可以探索联合治疗策略,将不同通路的靶向药物或其他治疗手段进行组合应用,以增强治疗效果。
6. 个体化治疗策略研究
了解食管癌患者个体间的分子特征差异,通过基因检测和分子标志物的筛选,制定个性化的治疗方案,提高治疗效果和患者生存率。
1. 化学诱导食管癌模型
1.1实验动物
SLC39A5基因敲除小鼠此基因敲除小鼠采用基因打靶法制备,并对基因敲除鼠进行形态观察及分子生物学鉴定,确认基因敲除小鼠缺失SLC39A5活性。
随机选取新生SLC39A5+/+(C57BL/6野生型,wild-typemice,WT)小鼠150只和SLC39A5-/-(C57BL/6基因敲除型,knockoutmice,KO)雄性小鼠80只,动物实验环境为SPF级,饲养环境温度为20℃~22℃,相对湿度为45%~55%,小鼠饮水为保留钙、镁离子的无菌水。
1.2诱癌剂配制
4-NQO试剂(棕黄色固体),丙二醇(无色液体)。取0.5g4-NQO溶剂溶于100m11,2-丙二醇中,配制成初浓度为5mg/ml的液体,放于4℃避光保存备用。使用时用无菌水稀释成终浓度为100μg/ml的溶液。丙二醇配制与上述诱癌剂配制方法相同,工作浓度为100μg/ml。
1.3实验动物分组及诱癌
将出生后5周的WT小鼠和KO小鼠剪取尾巴根部0.5~1.0cm组织,利用RT-RCR进行基因型验证。实验小鼠喂养至6周龄,将150只WT小鼠随机分为两组,10只小鼠为阴性对照组,饮用丙二醇空白溶液;140只WT小鼠和80只KO小鼠为两组实验组,均饮用诱癌剂。小鼠饮用的诱癌剂置于避光瓶内,每周更换。每天观察小鼠存活情况与精神状态。实验结束后计算小鼠的存活率和诱癌成功率,存活率=每组存活的小鼠数/各组小鼠总数×100%,诱癌成功率=诱癌成功小鼠数/各组小鼠数×100%。
1.4实验材料的收集与处理
实验结束后摘取小鼠眼球采集静脉血于抗凝管中,存于-20℃备用。采取脱臼法处死实验小鼠后进行解剖,打开胸腔,迅速取出小鼠食管,观察食管有无癌变,将食管剪开后卷起用一次性采血针头固定,放入4%甲醛溶液中固定,再用酒精脱水二甲苯透明石蜡包埋、切片后进行HE染色,进行病理分析,统计实验结果。
2. 人源化食管癌移植瘤模型
2.1 实验动物
C57BL/6小鼠40只,雄性,8周龄,体重24~25g,动物实验环境为SPF级,饲养环境温度为20℃~22℃.
2.2食管癌标本采集
选取医院4例食管癌患者的手术标本,术前胃镜活检病理及术后标本病理检测均为鳞状细胞癌。
2.3微载体
microcarrier6由美国ELYONBioTechnologiesLLC公司提供。该新型微载体呈多层孔状结构,由带正电化的有机复合多聚物组成,不含杂质,不易污染,具备低免疫原性、生物兼容性良好、可代谢性等优点,能为细胞生长提供稳定的微环境。
2.4人原代食管癌细胞分离与提取,并在此基础上建立三维细胞培养模型。
2.5动物模型制备及观察指标
因食管癌标本大小有限,分4次实验进行,每次用10只小鼠,按是否接种微载体与食管癌细胞复合物分为实验组和对照组,每组各5只小鼠。实验组将微载体与食管癌细胞复合物接种到正常免疫小鼠右侧腋下,每只100μl;对照组仅接种微载体,皮下种植到正常免疫小鼠右侧腋下,每只100μl。接种后观察小鼠精神状态、活动度、饮食情况,观察记录小鼠局部肿瘤的成瘤时间、肿瘤大小。肿瘤长出后每天测量肿瘤的长径和短径,根据肿瘤体积公式V=1/2×a×b2计算出肿瘤体积。
18天后脱颈处死移植瘤小鼠,完整取出肿瘤组织,记录肿瘤的体积、质地以及坏死程度。肿瘤组织用10%中性福尔马林固定,进行苏木素-伊红(hematoxylin-eosin,HE)染色和免疫组化染色,其中,免疫组化使用Envision二步法检测反映人食管癌特征的p40、CK5/6。
关注公众号,了解更多!
