
乳腺癌是一个全球性的疾病,是在女性中发病率最高的恶性癌症,也是所有恶性肿瘤中的第2大杀手。据中国国家癌症中心(NCCR)的统计数据显示,乳腺癌是<45岁妇女癌症死亡的主要原因,且近年来其发病率呈显著的上升趋势。

应用于乳腺癌预防性研究的实验模型可以保证实验结果的真实性、客观性和有效性,从而能对乳腺癌进行有效预防,降低乳腺癌发病率。现阶段大多数研究都是通过建立动物模型或特定细胞株来研究乳腺癌在体内发生发展的规律及检测药物预防肿瘤发生的有效性。
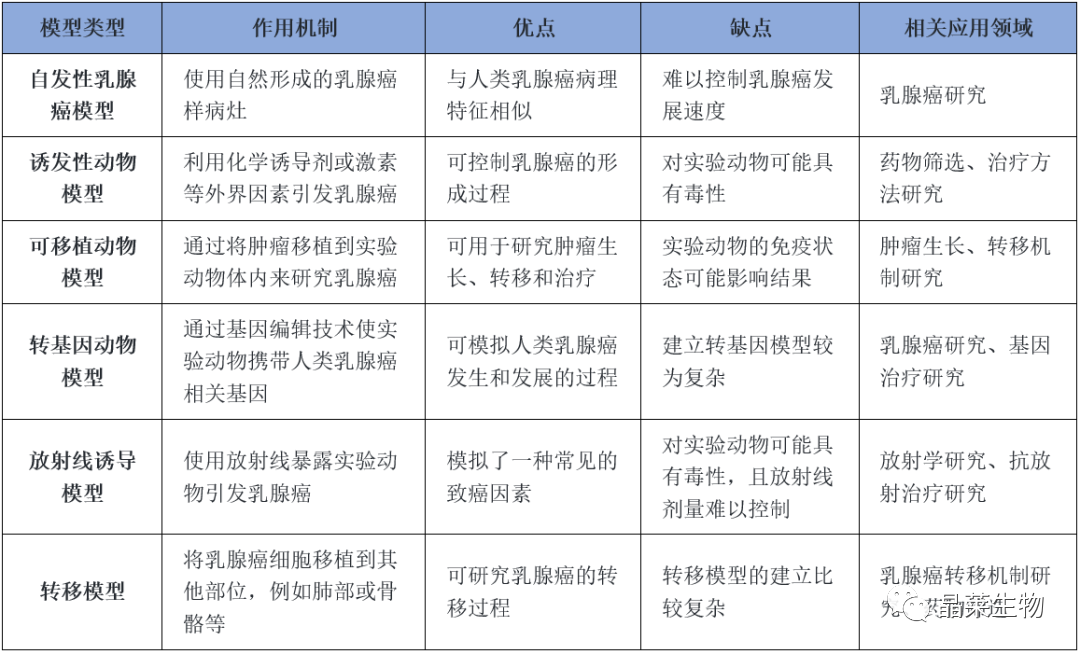
1. 自发性乳腺癌模型
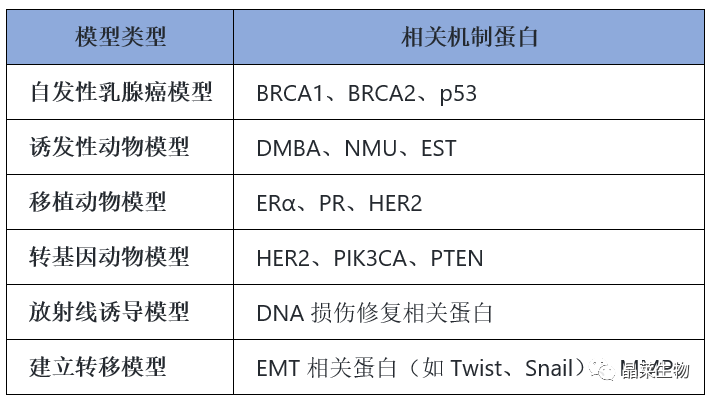
自发性乳腺癌模型是指未经人工手段干预,某些品系的实验鼠类到达一定年龄阶段可自然发生乳腺癌或者通过遗传育种技术培养出具有相同特点的一类动物模型。自发性乳腺癌动物模型多采用近交系小鼠,目前培育出的品系主要有C3H系、TA2系、SNH系和615近交系等,其中C3H小鼠、TA2小鼠和SNH小鼠为高癌系小鼠,615近交系小鼠为低癌系小鼠。
2. 诱发性动物模型
诱发性动物模型是指用不同剂量的物理、化学或生物因素在不同时长下处理动物,诱导其发生乳腺癌。目前最常用的方法为利用化学制剂诱导乳腺癌动物模型建立,二甲基苯甲酸烷(DMBA)和N-甲基-N-亚硝基脲(MNU)两种致癌剂对乳腺组织有较高的选择性和特异性,因而最为常用。
3. 可移植动物模型
可移植性动物模型是指将恶性转化细胞、癌前病变或肿瘤细胞、组织移植到实验动物体内,建立出的动物模型。根据移植物的来源,可移植动物模型又分为同种移植动物模型和异种移植动物模型。此模型一般用于疾病发生机制和药物筛选的研究。
4. 转基因动物模型
转基因动物是指将目的外源基因或特定DNA片段导入动物受精卵中,使外源基因与动物本身基因整合,并且稳定地遗传给后代的一类动物。
现已知有一些病毒和蛋白可作为启动因素来促进原癌基因在小鼠乳腺中表达,比如小鼠乳腺肿瘤病毒(MMTV-LTR)、乳清酸性蛋白(WAP)和小鼠金属硫蛋白(MT)1。它们可以促进和调控某些原癌基因在小鼠乳腺中表达,例如原癌基因包括瘤中间T抗原(PyMT)、Harvery鼠肉瘤病毒ras基因(Ha-ras)、Wnt-1、Her-2/ErbB2/Neu和c-Myc等。若启动子将原癌基因在动物体内激活使其表达,则“转基因”成功。
5. 放射线诱导模型
放射线诱导模型是通过暴露实验动物于放射线来引发乳腺癌。这种模型模拟了一种常见的致癌因素,在研究乳腺癌与放射线的关系以及防治方法方面具有重要意义。然而,放射线对实验动物可能具有毒性,并且难以控制放射线的剂量。
6. 建立转移模型
建立转移模型是将乳腺癌细胞移植到其他部位,如肺部或骨骼等,来研究乳腺癌的转移过程。这种模型可以用于研究乳腺癌细胞的侵袭能力、转移途径以及转移抑制方法。然而,建立转移模型相对复杂,需要考虑细胞特性、移植部位等因素。
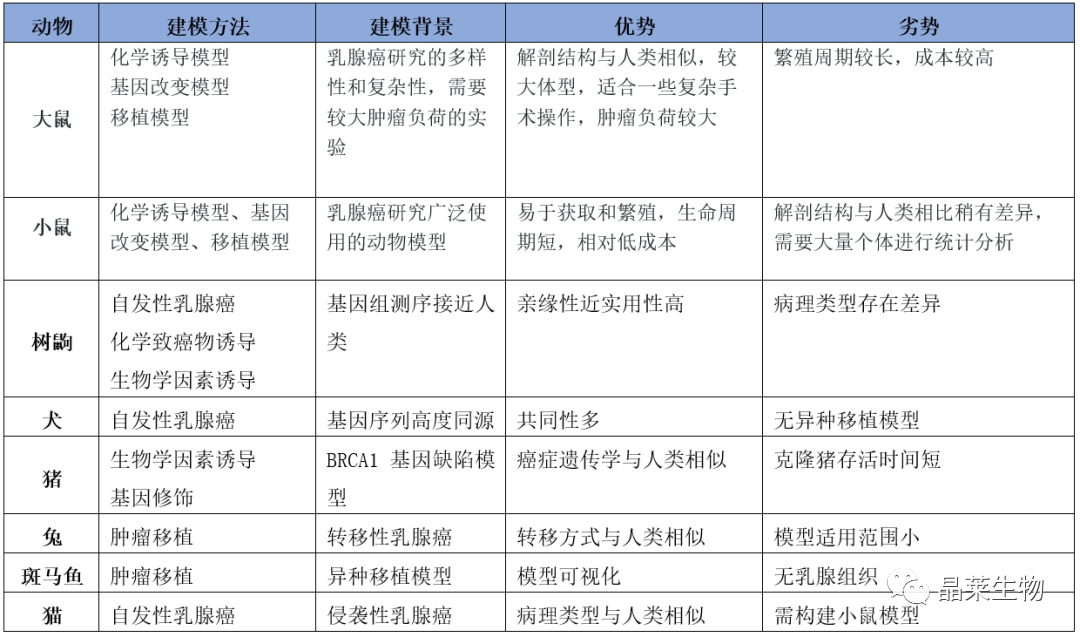
不同乳腺癌动物模型对比
在现有的乳腺癌动物模型中,啮齿类动物模型 凭借价格低廉、实验周期短、操作方便等特点,已经 成为乳腺癌研究中的主要动物模型。
乳腺癌生物标志物主要分为2大类,即传统乳腺癌生物标志物和新型乳腺癌生物标志物。
1. 传统乳腺癌生物标志物:
传统乳腺癌生物标志物是临床诊疗乳腺癌的重要参照,主要包含雌激素受体(estrogenreceptor,ER)、孕激素受体(progestogenreceptor,PR)、HER-2、癌胚抗原(carcinoembryonicantigen,CEA)、甲胎蛋白(α-fetoprotein,AFP)、糖类抗原15-3(carbohydrateantigen,CA15-3)和细胞角蛋白片段(cytokeratinfragments-21,CYFRA-21)等。
在临床诊疗过程中,通常采用多项联合检测以期获得更精确的诊断结果。
2. 新型乳腺癌生物标志物:
如微小RNA(microRNA,miRNA)、循环肿瘤细胞(circulatingtumorcells,CTCs)、循环游离DNA(circulatingfreeDNA,ctDNA)、尿激酶型纤溶酶原激活剂(urokinase typeplasminogenactivator,uPA)和外泌体(exosomes)等。
3.乳腺癌治疗靶点
在研究中,已发现 ER、PR、HER-2、p53、长链非编码 RNA(long non-coding RNA,LncRNA)、热休克蛋白 90(heat shock protein 90,HSP90)、血小板衍生生长因子、氧化酶 -2、雄激素受体和蛋白激酶 1δ(casein kinase 1δ,CK1δ) 均 是有效的治疗靶点。
另外,相关研究表明有一些新的治疗靶点,如 p53 基因,其中,在乳腺癌动物模型和临床前模型的实验中,以 p53 为治疗靶点的 PRIMA1(p53 reactivation and induction of massive apoptosis 1)和 APR246(a methylated derivative and structural analogue of PRIMA 1)等化合物,可通过将突变型 p53 基因转化为具有抑癌作用的野生型 p53 基因等方式,来抑制乳腺癌细胞的增殖,且研究中均未发现严重的不良反应。
由此可见,p53 有可能作为一个治疗靶点应用于乳腺癌的临床诊疗中。
1. 裸鼠荷人肿瘤耐药和敏感细胞移植瘤模型
1.1 细胞系与细胞培养
乳腺癌敏感细胞MCF-7和耐药细胞MCF-7/ADM;常规传代培养。
1.2 实验动物
alb/c裸鼠(nu/nu),雌性,5.7周龄,体重16~229。
1.3 实验操作
裸鼠移植瘤单侧模型的建立:采用人耐药细胞MCF-7/ADM和乳腺细胞系MCF-7接种于裸鼠上,建立耐药单侧和肿瘤敏感模型。接种位置在右侧前肢根部背侧,单只小鼠接种细胞数量为0.2ml,肿瘤以每6~9天100~300mm3的速度生长,随机分组,各组为6只小鼠。
体内抗耐药肿瘤活性试验:分组为3组:对照组A组、对照组B组、观察组。A组注射相应溶剂;B组注射阿霉素;观察组注射不同剂量的PND,高剂量∶中剂量∶低剂量=4∶2∶1。耐药移植肿瘤接种后第9天开始给药,移植肿瘤接种后第6天开始给药,每隔3天给药1次,腹腔注射。
1.4 评价标准
裸小鼠移植瘤模型使用游标卡尺测量肿瘤直径,观察抗肿瘤疗效,每3天测量一次肿瘤直径。
1.5 结果分析和评价
MCF-7/ADM裸鼠移植瘤的生长特性
裸鼠移植瘤对ADM的耐药特性
2. 原位乳腺癌模型
2.1 实验动物及细胞培养
32只健康雌性BALB/c裸鼠(SPF级,4~6周龄,体质量20~25g),饲养于标准实验动物房。裸鼠分笼饲养,自然昼夜节律变化,自由饮食。室温23℃±2℃,相对湿度40%~60%。
将MCF-10A细胞置于含有1.5nmol/L霍乱毒素的乳腺上皮细胞生长培养基(MEGM)中、MCF-7细胞置于含有10%FBS和0.01mg/mL人重组胰岛素的Eagle氏最低要素培养基(MEM)中,于37℃、5%CO2培养箱中培养,隔天换液,待其融合度达90%时以1∶2比例进行传代培养,取对数生长期的细胞用于实验研究。
2.2 动物模型的构建、分组及给药
使用原位乳腺癌模型评估KPL对DOX诱导的肿瘤消退的影响。取对数生长期的MCF-7细胞,经蛋白胰酶消化、离心后将其重悬于PBS中,以1×10^7细胞/mL细胞密度取100μL 注射到裸鼠颈部皮下。当肿瘤体积为5~6mm^3时,小鼠开始接受治疗。
根据肿瘤体积将乳腺癌小鼠分为4组,每组8只:溶媒组给予PBS,每天1次,每周5d,共3周;DOX组小鼠腹腔注射DOX,剂量为5mg/kg,每周1次,共计15mg/kg;KPL组以4mg/kg的剂量口服KPL每天1次,每周5d,共3周;DOX+KPL组联合DOX组和KPL组的给药方案进行治疗。每3d监测1次动物体质量,以调整药物剂量,确定治疗相关毒性和疾病进展。
每隔3d用卡尺测量肿瘤大小,记录肿瘤的2个垂直直径,即肿瘤的最短和最长直径。肿瘤体积计算为π/6(a)2×(b),其中a为最短直径和b为最长直径。在完成给药方案处理后的次日,小鼠眼球取血,置于肝素化的离心管中,以2300×g离心分离血浆。脱颈处死小鼠,切除心和肿瘤组织,并在-80℃下保存。在整个研究期间,所有小鼠都能自由饮食和饮水。
2.3 模型评价
免疫印迹检测蛋白的表达情况;
ELISA试剂盒检测炎性标志物肿瘤坏死因子α(TNF-α)和白介素6(IL-6)的乳腺肿瘤的组织病理学分析水平;
免疫组化检测各组小鼠心组织中caspase-3、聚腺苷二磷酸核糖聚合酶(PARP)的表达。
关注公众号,了解更多!
