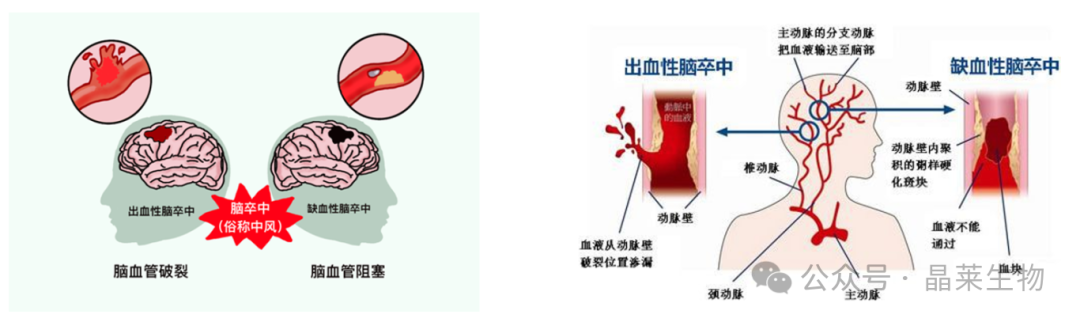
缺血性脑卒中是世界人口第二大死亡原因和第三大致残原因,发病率在全球范围内逐年增加。缺血性卒中占全部卒中的比例高达80%,是由于脑血液供应障碍引起缺血、缺氧、营养剥夺,导致缺血中心的坏死和缺血周边出现半暗带区。
目前针对缺血性脑卒中的治疗以血液再通为主,血液再通后会引起兴奋性毒性、氧化应激等级联反应,导致神经元损伤或死亡,称为缺血/再灌注损伤。缺血/再灌注损伤的机制目前仍不是十分明确,因此,构建具有其特性的临床前模型十分必要。
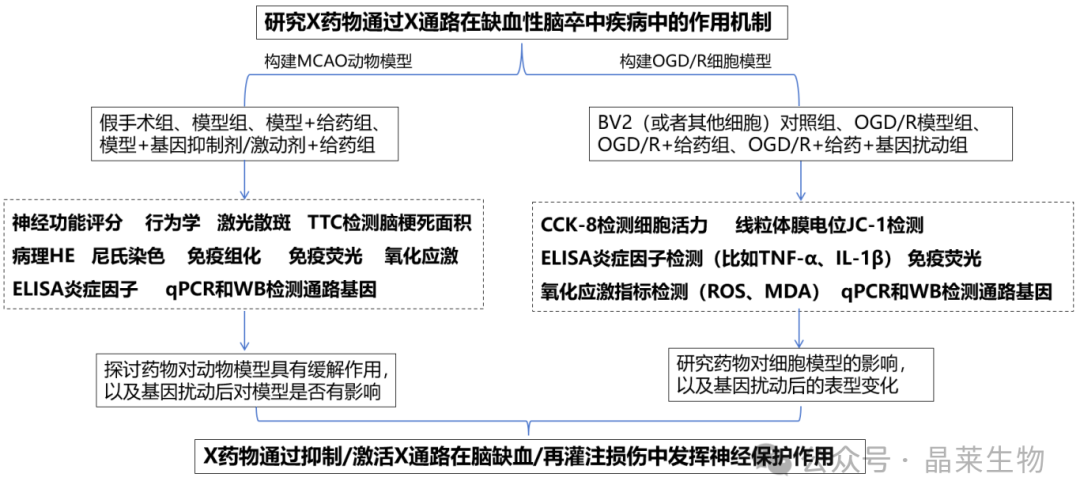
鉴于动物模型研究的复杂性和体外脑切片培养的局限性,体外细胞模型可以建立“临时”连接的细胞群,成为了更简化而有价值的工具。缺血性卒中体外模型的建立和应用对揭示其发病机制及探索治疗方案具有重要意义。
神经元一直被认为是中枢神经系统中最重要的细胞。神经元的损伤、功能失调甚至凋亡将直接导致神经功能的缺失,因此既往很多治疗脑血管病的神经保护药物都以保护神经元为目标。
①兴奋性氨基酸的毒性作用
脑缺血缺氧时大量兴奋性氨基酸,尤其是谷氨酸的暴发性释放,N-甲基-D-天门冬氨酸(NMDA)受体过度激活,形成所谓的“兴奋毒性”,造成突触后神经元过度兴奋、溃变、坏死。
②细胞内Ca2+超载
发生缺血性卒中时,电压依赖性Ca2+通道开放,引起损伤性Ca2+内流,与此同时,Na+流出细胞外,激活蛋白激酶C、磷脂酶C和磷脂酶D途径,导致花生四烯酸堆积,对神经元造成损伤。
③自由基生成增加
自由基是指最外层电子轨道上含有一个或多个未配对电子的物质。可分为两类:一类是由氧诱发的自由基称为氧自由基;另外一类是氧自由基与多聚不饱和脂肪酸作用后生成的中间代谢产物是脂自由基。研究显示,自由基损伤以缺血后再灌注时为最重,可能由于溪流和滴流的供血携带了微量氧进入组织,为维持脂质过氧化程序提供条件,加重自由基损伤。
④炎症反应
缺血损伤后产生组织炎症反应,表现在炎症因子上调,促黏附分子和黏附分子的表达增加。已知的致炎因子包括白细胞介素-1、白细胞介素-6、肿瘤坏死因子α等;黏附分子包括细胞间黏附分子1、内皮细胞选择素、血管细胞黏附分子等。小胶质细胞反应在大鼠全脑缺血标本也比较强烈,应激的小胶质细胞分泌IL-1β。动物实验显示,MCAO大鼠局灶缺血20 min内可见反应性小胶质细胞,缺血再灌注损伤后缺血中心区内充满小胶质细胞。抗炎治疗是神经保护措施的理论依据。
⑤细胞凋亡
缺血性损害的急性期,凋亡细胞与坏死细胞并存,提示神经细胞凋亡与坏死均参与脑缺血急性期细胞损害,但各自程度与缺血损害的轻重有关。轻度缺血时坏死表现轻微,细胞凋亡成为细胞损害的主要形式。在迟发性神经元损害期,无论是轻度缺血还是重度缺血,细胞凋亡均是细胞丢失的主要形式。

小胶质细胞(microglia)是神经胶质细胞的一种,相当于脑和脊髓中的巨噬细胞,在整个中枢神经细胞中占比约 10-15%,是中枢神经系统(CNS)中的第一道也是最主要的一道免疫防线。当小胶质细胞激活后,可吞噬凋亡的神经元和凋亡细胞,同时还可以介导突触可塑性,在维持中枢神经系统内的动态平衡中起了重要作用。在正常脑组织中,小胶质细胞呈分枝状,胞体较小。但是当发生应激或者损伤时,小胶质细胞胞体增大,导致炎症介质的释放增加,进而导致神经元损伤。

缺氧缺血损伤后神经炎症的激活和触发主要是由大脑固有免疫细胞介导的,其中小胶质细胞起关键作用。当缺氧缺血性损伤发生时,小胶质细胞被激活,活化的小胶质细胞迁移到损伤部位,血脑屏障被破坏,导致外周血白细胞进入脑实质内,同时与星形胶质细胞一起释放多种促炎因子。
在缺血/再灌注损伤的背景下,活化的小胶质细胞分泌多种促炎因子,如 IL-1β、IL-6、TNF-α,以及氧化应激产物,如 ROS,最终导致组织损伤。
脑细胞氧糖剥夺是最常用的缺血性脑卒中体外模型,广泛用于基础和临床前脑卒中的研究。
氧糖剥夺/复糖复氧,简称OGD/R:oxygen-glucose deprivation/reoxygenation(OGD/R),模拟脑缺血再灌注损伤。
细胞:小鼠 BV2 小胶质细胞。
培养基及试剂耗材:DMEM高糖培养基、DMEM无糖培养基、FBS、96孔板(24孔板、6孔板)、胰酶、双抗等。
仪器设备:离心机、超净工作台、倒置显微镜、CO2细胞培养箱、三气细胞培养箱、水浴锅等
细胞模型构建:
① 复苏扩增BV2细胞,待细胞密度长至80%传代铺板(比如:6孔板每孔接种1×106个细胞,24孔板每孔接种1.5×105个细胞,96 孔板每孔中接种 1×104个细胞);
② 将 BV2 细胞分为正常培养的对照组 ( Control 组)、氧糖剥夺组(OGD组 )、氧糖剥夺/复糖复氧组(OGD/R 组);
③ 对照组 ( Control 组)使用高糖DMEM在正常培养条件下培养细胞;
④ 氧糖剥夺组(OGD组 )使用无糖 DMEM 培养基在 37℃ 、0.3%O2、5% CO2 三气培养箱中培养 6h,不使用完全培养基进行复糖复氧;
⑤ 氧糖剥夺/复糖复氧组(OGD/R 组)加入无糖 DMEM 培养基在 37℃ 、0.3%O2、5% CO2 三气培养箱中培养 6h,然后更换含糖 DMEM培养基并置于 37℃ 、74%N2、21%O2、5% CO2 细胞培养箱中复糖复氧培养24h。
CCK-8检测细胞活力
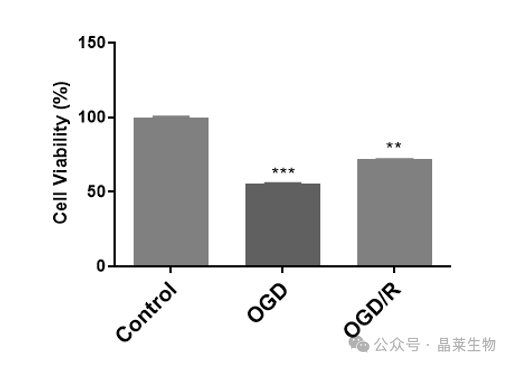
① 单纯缺氧缺糖处理后的细胞活力显著降低,细胞损伤严重,活力下降至50%左右;
② 复氧复糖处理后,细胞活力在70%左右,有所回升,但与正常对照相比细胞活力仍然显著降低
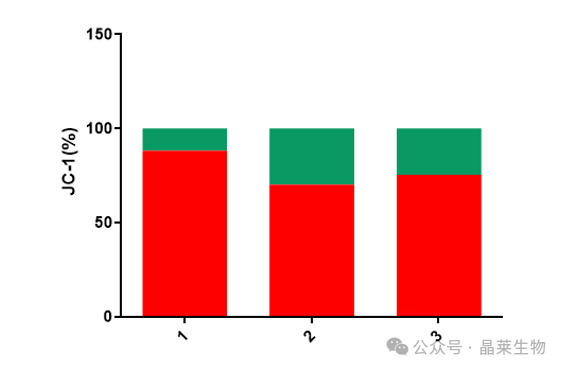
① OGD组较正常对照组膜电位显著降低,细胞凋亡明显
② OGD/R组膜电位有所回升,但仍然与对照相比膜电位下降