

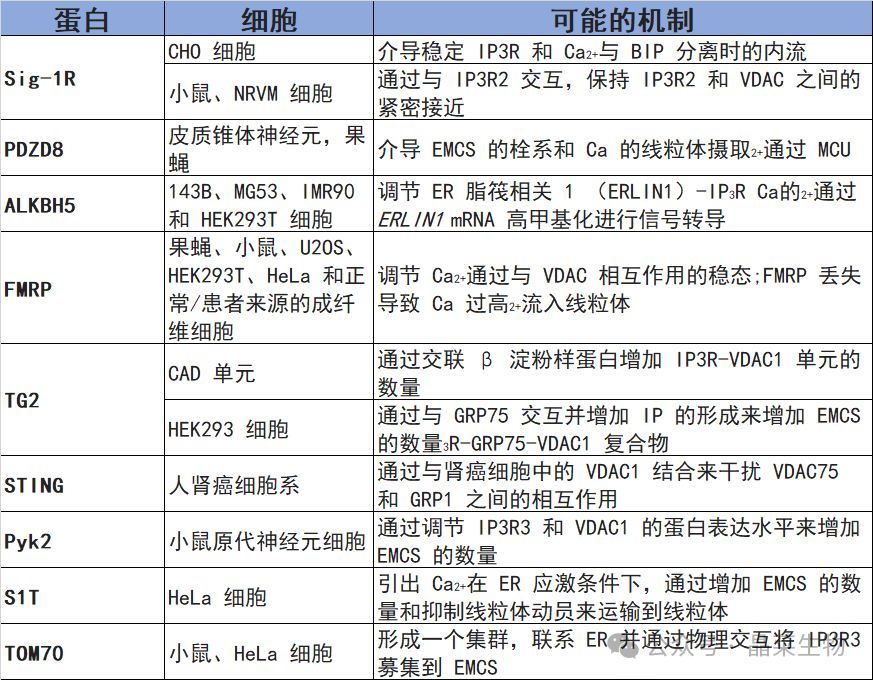
ER 和线粒体之间物理拴系位点的大多数蛋白质,称为线粒体相关 ER 膜 (MAM),对细胞内生理学至关重要。MAM 蛋白参与钙稳态、脂质代谢和线粒体动力学的调节,并与细胞内应激条件相关的过程相关,例如氧化应激和未折叠的蛋白质反应。越来越多的证据表明,由于它们广泛参与细胞稳态,ER-线粒体轴的改变是肿瘤的病因之一。
代表性的 MAM 蛋白及其调节多种细胞功能的机制
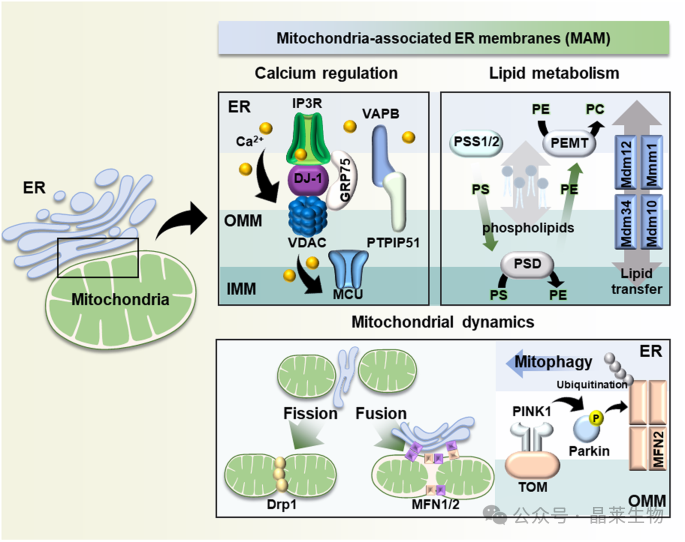
① 钙调节主要受 MAM 中的 IP3R-GRP75-VDAC-MCU 和 VAPB-PTPIP51 复合物的调节。
② 脂质合成和转移由 PSS1/2、PSD 和 PEMT 酶以及 Mdm12-Mmm1-Mdm34-Mdm10 复合物介导。
③ Drp1 和 MFN1/2 分别参与线粒体裂变和融合。PINK1/Parkin 通路介导线粒体自噬。
ER-线粒体接触调节氧化应激
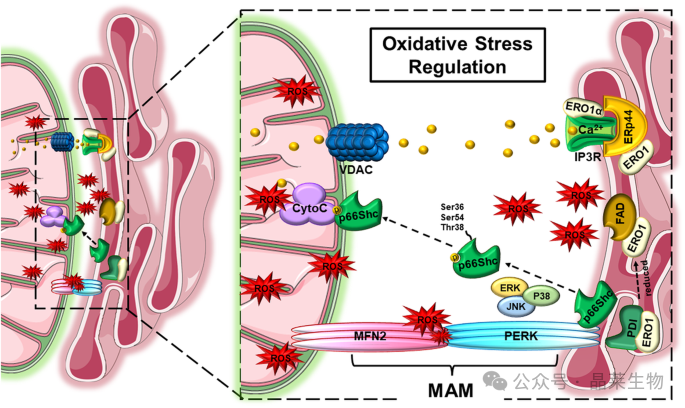
线粒体 ER 膜中存在的几种蛋白质对活性氧 (ROS) 产生的调节。还原的 ERO1 通过与 FAD 的相互作用生成 ROS。ERO1a 是 ERO1 亚型之一,通过与 IP3R 的相互作用调节 ROS 的产生,方法是将钙离子释放到线粒体中,从而诱导慢性 ER 应激。此外,p66Shc 通过 ERK、JNK 和 P36 在 Ser54、Ser38 和 Thr38 位点的磷酸化来调节 ROS 的产生。最后,MFN2 通过与 PERK 的相互作用,以依赖于其表达水平的方式调节 ROS 的产生。
癌细胞需要大量的能量来快速增殖和获得恶性表型,并使用各种方法,例如增加葡萄糖摄取和糖酵解活性(一种称为 Warburg 效应的现象)、脂质合成和脂肪分解以及 Ca 的调节2+信令,以满足这些要求。因此,MAMs 在癌细胞功能和代谢中起着重要作用,因为它们调节上述通路。
癌症中线粒体相关 ER 膜 (MAM) 的代表性特征及其治疗靶点
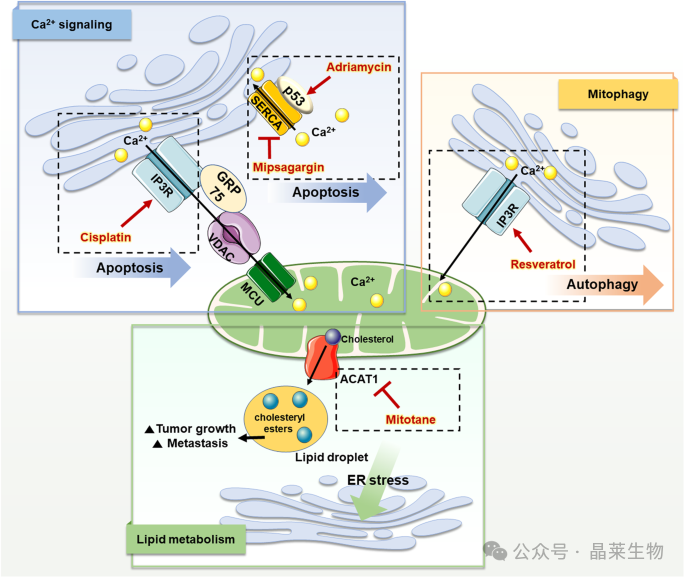
该图从三个角度显示了癌细胞中 MAM 的代表性改变 (Ca2+信号传导、线粒体自噬和脂质代谢)和靶向它们的治疗药物。
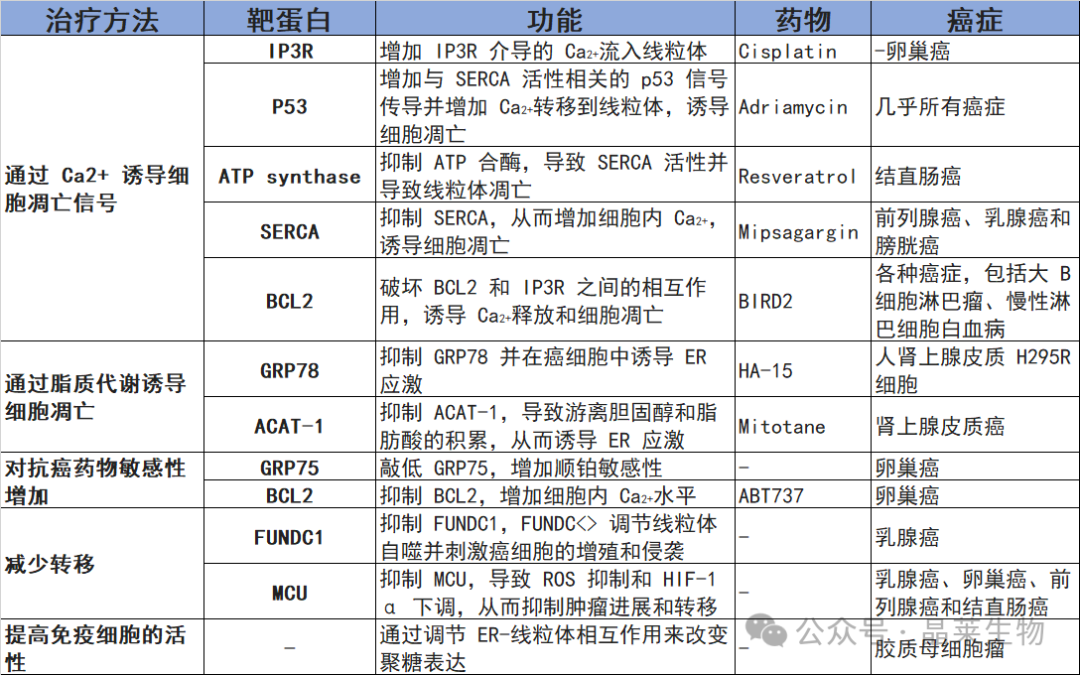
在癌症中,IP3R-GRP75-VDAC 复合物的功能受损,从而限制了 Ca2+运输到线粒体并诱导对线粒体细胞凋亡的抵抗。顺铂靶向 IP3R 并促进其复合物的活性,从而激活 Ca 的流入2+进入线粒体并诱导细胞凋亡。
此外,已在多种癌症中检测到 p53 突变,这些突变导致 Ca 的抑制2+流入 ER,从而导致细胞死亡。阿霉素增加 MAM 中的 p53 水平并促进 Ca2+通过 SERCA 流入 ER,促进癌症细胞凋亡。Mipsagargin 抑制 SERCA 活性并增加细胞内 Ca2+水平,可触发癌细胞死亡。
白藜芦醇促进 Ca2+通过 IP3R 信号传导,导致自噬诱导的癌细胞死亡。ACAT-1 产生胆固醇酯,诱导脂滴积累,导致肿瘤生长和转移。Mitotane 抑制 ACAT-1 并导致 ER 中的游离胆固醇积累,导致 ER 应激介导的癌细胞凋亡。
癌症中靶向 MAM 蛋白的治疗策略
细胞器之间的相互作用参与许多细胞功能。本文特别关注 ER 和线粒体之间的接触位点,称为 MAMs。各种 MAM 蛋白在 Ca 的调节中起重要作用2+信号传导、脂质代谢、线粒体动力学、氧化应激和 ER 应激。
因此,MAM 蛋白的改变可导致这些机制的变化,从而导致细胞凋亡的抑制和对抗癌药物的耐药性增加。
参考文献:
Relevance of the endoplasmic reticulum-mitochondria axis in cancer diagnosis and therapyGaram An, Junho Park, Jisoo Song, Taeyeon Hong, Gwonhwa Song & Whasun Lim Experimental & Molecular Medicine volume 56, pages40–50 (2024).
关于晶莱
