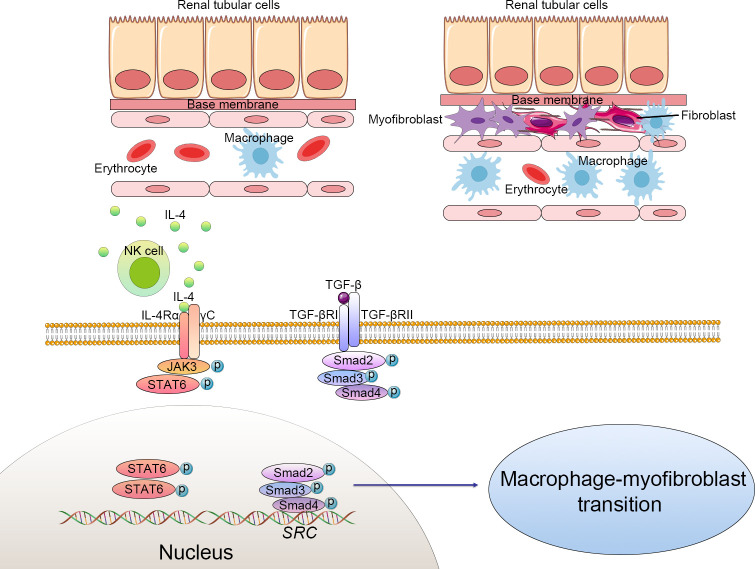
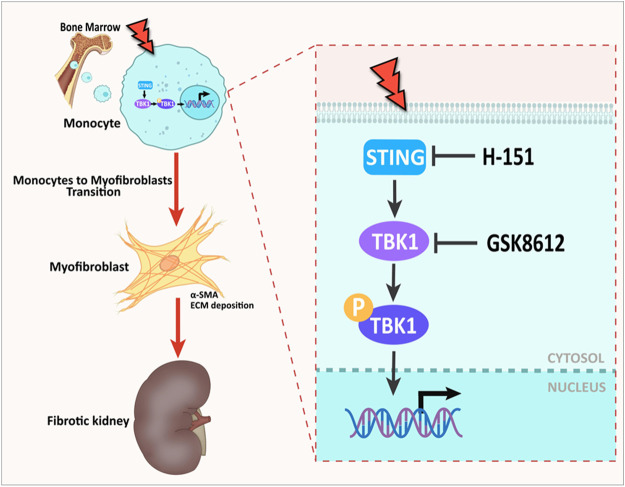
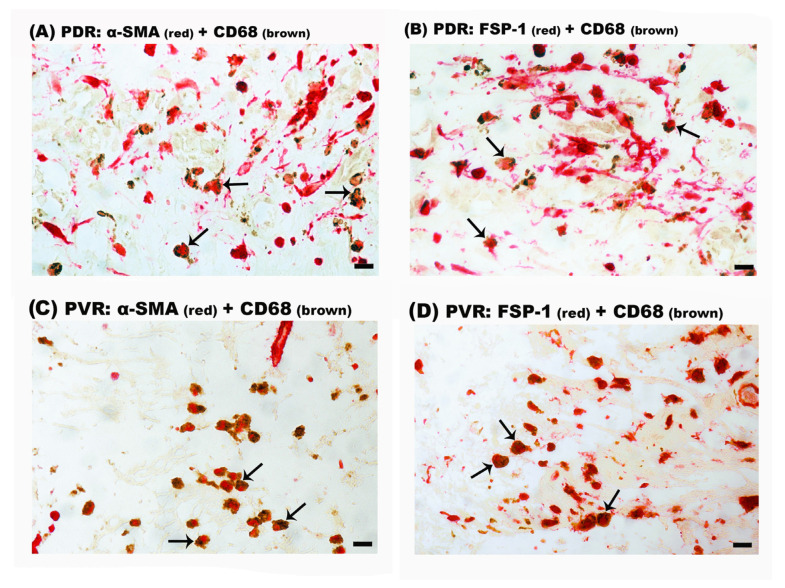
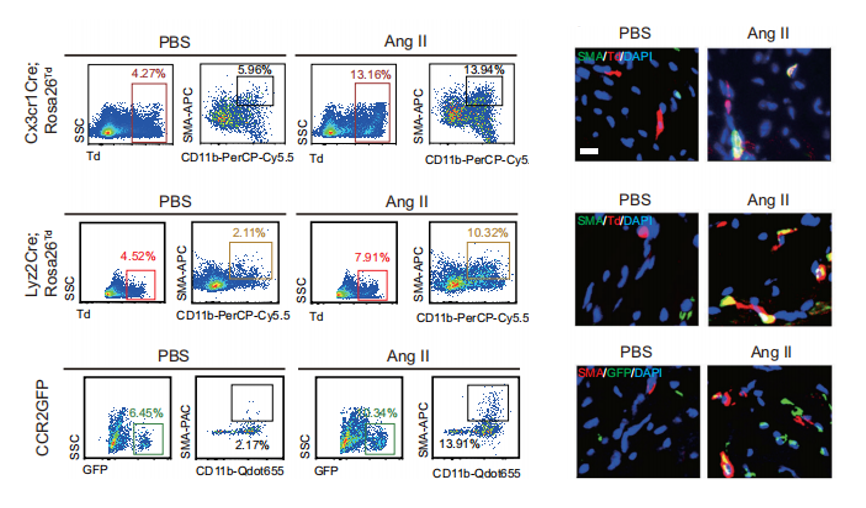
在探讨免疫细胞研究的最新趋势时,巨噬细胞作为国自然项目中的明星细胞,持续吸引着大量科研人员的关注。这些研究不仅深入剖析了巨噬细胞在维持免疫稳态、调控炎症反应(如M1-M2极化平衡)以及影响血管与组织重构等关键生理病理过程中的角色,还不断拓展至新的研究领域,其中巨噬细胞向肌成纤维细胞转化(MMT, Macrophage-to-Myofibroblast Transition)便是近年来备受瞩目的热点之一。 1.MMT基本概念 MMT是指巨噬细胞在特定微环境信号刺激下,经历一系列形态与功能上的转变,最终获得肌成纤维细胞特性的过程。这一过程不仅涉及细胞表型的显著变化,还伴随着基因表达谱的重编程,使转化后的细胞能够分泌大量细胞外基质成分,参与组织修复或病理性纤维化的进程。 ① 检测指标:包括但不限于细胞形态学观察(如肌动蛋白应力纤维的形成)、特定基因表达水平的检测(如α-平滑肌肌动蛋白α-SMA、纤维连接蛋白Fibronectin等)以及功能评估(如细胞收缩能力、细胞外基质沉积能力等)。 ② 相关通路:MMT的触发和调控涉及多条信号通路,如TGF-β/Smad、Notch、Wnt/β-catenin以及炎症相关的NF-κB和JAK/STAT等,这些通路间的交互作用共同调控着MMT的发生与发展。 ① 确认触发因素:探索不同疾病模型或实验条件下,哪些外部信号(如细胞因子、损伤信号等)能够诱导MMT的发生。 ② 解析分子机制:深入研究这些信号如何通过特定的信号通路影响巨噬细胞的转录调控网络,进而促进MMT。 ③ 功能评估:评估MMT在疾病模型中的具体作用,如是否促进组织修复或加剧纤维化进程。 ④ 干预策略:基于MMT的分子机制,开发针对MMT的干预手段,如靶向特定信号通路的小分子抑制剂或基因治疗策略,以期在疾病治疗中发挥积极作用。 类似于上皮间质转分化(EMT)等表型转换过程,MMT的检测主要为巨噬细胞和肌成纤维细胞的标志物: 1.巨噬细胞标记物: ①通用型:CD68、CD11b、F4/80(小鼠)。 ②M1型:CD80、CD86、MHC II、iNOS、IL-1β、IL-6、TNF-α、IL-12、IL-23等。 ③M2型:CD163、CD206、Arginase-1、IL-10、TGF-β等。 2.肌成纤维细胞标记物:α-SMA、FSP-1、Collagen I、FAP1α等。 通过巨噬细胞标志物的下降和肌成纤维细胞标志物的升高,判断MMT的发生。 这里我们主要介绍三条主要的信号通路:TGF-β、JAK/STAT和STING/TBK1: 1.TGF-β信号通路 目前MMT的调控机制研究最多的是TGF-β1/Smad3信号通路,通过激活Smad依赖和非Smad依赖的信号通路来促进MMT:TGF-β结合到其受体后,激活Smad2/3,导致其磷酸化并与Smad4形成复合物,随后转位到细胞核中调控目标基因的表达,包括肌成纤维细胞的标志性蛋白,如α-SMA、胶原蛋白和纤连蛋白等。 肾纤维化中MMT的细胞变化和TGF-β与JAK3/STAT6信号通路 1.生信分析 通过单细胞测序,检测同时表达巨噬细胞和肌成纤维细胞标记物的中间转化细胞群体。 2.多重免疫组化(mIHC) mIHC作为一种可以在组织切片中同时检测多个标记物的技术,适用于研究MMT。通过使用多重标记物(如巨噬细胞标志物CD68、CD206和肌成纤维细胞标志物α-SMA、FSP-1),可以精确定位并鉴定中间转化细胞群体,从而分析MMT在不同病理条件下的发生情况。 ① 标记循环单核细胞来源的巨噬细胞: ② 标记组织驻留巨噬细胞(如心脏、肝脏等): ③ 分析细胞标记和转变: 1.明确疾病中MMT的发生 利用单细胞RNA测序技术(scRNA-seq)分析患者或动物模型中的相关组织样本,通过标记物(如巨噬细胞标记物CD68、CD11b,肌成纤维细胞标记物α-SMA、Tagln等)的共表达,确认巨噬细胞在病理过程中向肌成纤维细胞的转变。 2.潜在调控基因的筛选 通过比较正常和病变组织中MMT相关细胞的基因表达差异,借助生物信息学工具筛选出与MMT过程密切相关的基因。利用基因富集分析和信号通路分析,可以缩小候选基因范围,并确定可能影响MMT的关键分子。 3.基因A对MMT过程的影响 通过基因敲除或过表达系统,验证基因A在MMT过程中的功能。 4.解析基因A对MMT过程的调控机制 ①信号通路分析:通过Western blot和磷酸化蛋白质组学,研究基因A对已知MMT相关信号通路(如TGF-β/Smad)的影响。 ②转录和表观遗传调控:利用DNA pulldown和ChIP-Seq等技术,鉴定基因A是否直接结合并调控MMT相关基因的启动子区域。同时,研究基因A是否通过影响DNA甲基化或组蛋白修饰来调控MMT相关基因的表达。 ③蛋白质相互作用:通过免疫共沉淀(Co-IP)和质谱分析,识别与基因A相互作用的蛋白伙伴,构建调控网络。 ④代谢重编程:通过代谢组学分析和代谢通量测定分析基因A是否通过调节细胞代谢(如糖酵解、脂肪酸氧化等)来影响MMT的进程。 1.案例文章 案例①:ALKBH5-mediated m6A modification of IL-11 drives macrophage-to-myofibroblast transition and pathological cardiac fibrosis in mice. Nat Commun. ALKBH5通过介导IL-11的m6A去甲基化,增加了其稳定性和蛋白水平,促进巨噬细胞向肌成纤维细胞转化,导致病理性心脏纤维化和功能障碍。 案例②:P2Y12 inhibitor clopidogrel inhibits renal fibrosis by blocking macrophage-to-myofibroblast transition. P2Y12通过TGF-β/Smad3信号促进巨噬细胞向肌成纤维细胞转化,导致肾纤维化发生发展。 案例③:GSDMD-dependent neutrophil extracellular traps promote macrophage-to-myofibroblast transition and renal fibrosis in obstructive nephropathy. GSDMD通过促进中性粒细胞NETs形成,激活巨噬细胞向肌成纤维细胞转化,导致梗阻性肾病中的肾纤维化。 2.基金案例 案例1:上皮细胞源性外泌体NFYA调控巨噬细胞-肌成纤维细胞转化在草酸钙晶体肾损伤后纤维化中的作用及机制研究。 案例2:P物质诱导巨噬细胞-肌成纤维细胞转化促进脓毒症心室重构的机制研究。 案例3:染色质重塑蛋白Arid1a表观调控巨噬-肌成纤维细胞转化在肥胖相关肩袖再撕裂中的作用和机制研究。 案例4:Tenascin-C促进巨噬细胞向肌成纤维细胞转化在肾脏纤维化中的作用机制研究。 案例5:MBD2/TBC1D16/Rab介导的巨噬细胞向肌成纤维细胞转化在梗阻性膀胱重塑中的作用及机制研究。 案例6:RNA聚合酶Ⅱ第五亚基调节蛋白(RMP)调控巨噬细胞向肌成纤维细胞转化在心梗后纤维化重塑中的作用和机制研究。 参考文献 [1]Abu El-Asrar AM, De Hertogh G, Allegaert E, Nawaz MI, Abouelasrar Salama S, Gikandi PW, et al. Macrophage-Myofibroblast Transition Contributes to Myofibroblast Formation in Proliferative Vitreoretinal Disorders. Int J Mol Sci 2023, 24(17). [2]Wei J, Xu Z, Yan X. The role of the macrophage-to-myofibroblast transition in renal fibrosis. Front Immunol 2022, 13: 934377. [3]Zeng H, Gao Y, Yu W, Liu J, Zhong C, Su X, et al. Pharmacological Inhibition of STING/TBK1 Signaling Attenuates Myeloid Fibroblast Activation and Macrophage to Myofibroblast Transition in Renal Fibrosis. Front Pharmacol 2022, 13: 940716. [4]Tang PC, Chung JY, Xue VW, Xiao J, Meng XM, Huang XR, et al. Smad3 Promotes Cancer-Associated Fibroblasts Generation via Macrophage-Myofibroblast Transition. Adv Sci (Weinh) 2022, 9(1): e2101235. [5]Zhuang T, Chen MH, Wu RX, Wang J, Hu XD, Meng T, et al. ALKBH5-mediated m6A modification of IL-11 drives macrophage-to-myofibroblast transition and pathological cardiac fibrosis in mice. Nat Commun 2024, 15(1): 1995. [6]Meng XM, Wang S, Huang XR, Yang C, Xiao J, Zhang Y, et al. Inflammatory macrophages can transdifferentiate into myofibroblasts during renal fibrosis. Cell Death Dis 2016, 7(12): e2495. 关于晶莱2.检测指标与相关通路
3.研究思路