

糖酵解是指在氧气不足条件下,葡萄糖或糖原分解为乳酸的过程,此过程中伴有少量ATP的生成。这一过程是在细胞质中进行,不需要氧气,每一反应步骤基本都由特异的酶催化。在缺氧条件下丙酮酸则可在乳酸脱氢酶的催化下,接受磷酸丙糖脱下的氢,被还原为乳酸。

研究表明,糖酵解成瘾的癌细胞通过mTORC1激活表现出代谢重线。持续的 mTORC1 激活通过将葡萄糖通量引导至磷酸戊糖途径来绕过糖酵解。代谢重新布线,包括糖酵解失调、ATP 产生升高和细胞死亡逃逸机制,是癌细胞治疗耐药性的罪魁祸首。
癌细胞中的细胞内ATP水平也与转移和干性有关。因此,靶向糖酵解或细胞内/细胞外ATP水平是使癌细胞对化疗敏感的一种有前途的策略。几项研究报告称,糖酵解抑制剂可提高癌症治疗的疗效,并且糖酵解抑制剂与其他治疗方式联合使用时是一种很有前途的策略。与此一致,抑制糖酵解酶己糖激酶(HK)、丙酮酸激酶(PK)和乳酸脱氢酶(LDH)已显示出对几种化疗药物的致敏作用。
靶向糖酵解调节癌症治疗机制
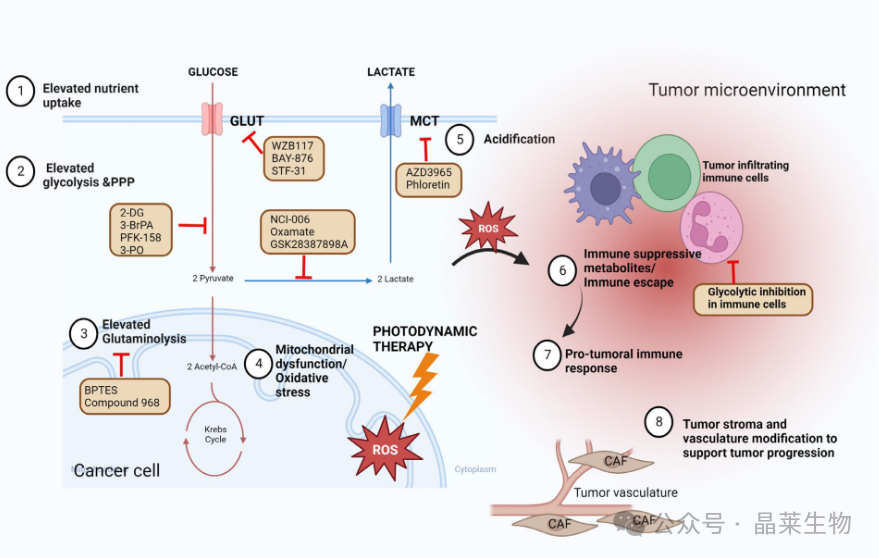
癌细胞表现出对糖酵解的增强依赖性,糖酵解可能被靶向提高传统癌症治疗方式的治疗效果,包括化疗、放疗、免疫治疗、激素治疗和光动力疗法。糖酵解代谢可以通过限制葡萄糖摄取(靶向葡萄糖转运蛋白)、靶向糖酵解酶、靶向谷氨酰胺分解、靶向乳酸合成、靶向 MCT 或靶向线粒体复合物来潜在靶向。癌细胞中糖酵解的增加增加了乳酸向肿瘤微环境的释放,使其酸化并使其具有促癌和免疫抑制作用。肿瘤浸润免疫细胞也显示出类似的向葡萄糖代谢的转变,增加了肿瘤微环境中对葡萄糖的竞争。调节免疫细胞中的糖酵解可以潜在地改善免疫治疗。
靶向糖酵解以增强免疫治疗
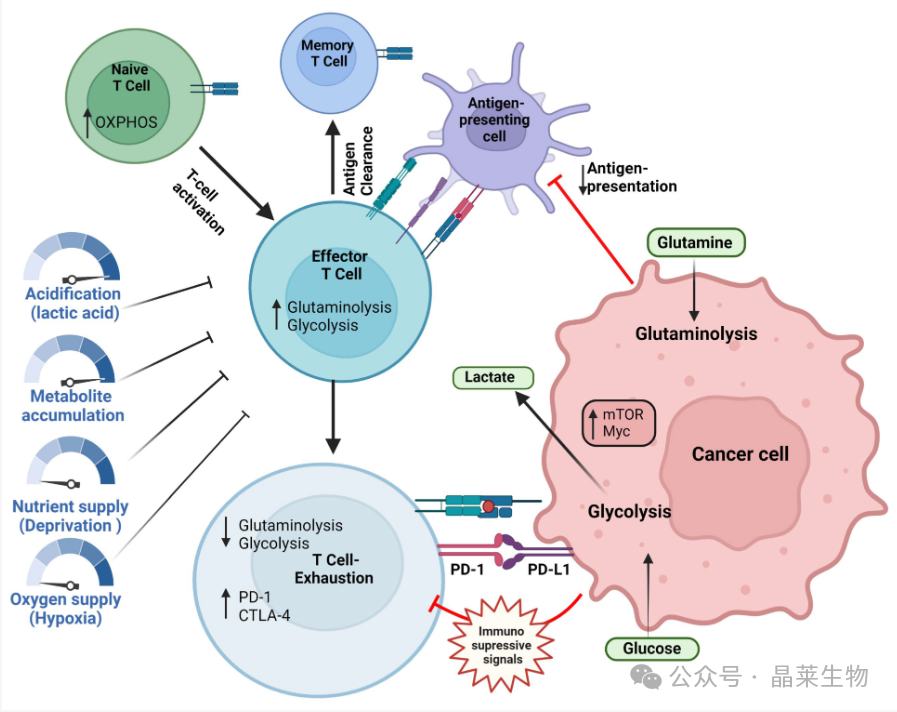
以上总结了低氧水平、高水平乳酸和葡萄糖高竞争可能导致肿瘤微环境中 T 细胞功能障碍的机制。
T细胞激活后,效应T细胞增加糖酵解以支持其功能。在抗原清除时,效应T细胞进入记忆状态。在抗原持久性方面,与长期肿瘤消除一样,抑制性受体(如 PD-1 和 CTLA4)会重新编程 T 细胞代谢,导致代谢障碍。耗竭的 T 细胞表现出糖酵解和谷氨酰胺分解的减少以及脂肪酸氧化的依赖性。低氧水平、高水平乳酸和对葡萄糖的高度竞争可能导致肿瘤微环境中的 T 细胞功能障碍。该图像是使用 Biorender 应用程序创建的。
优化T细胞代谢是改善癌症免疫治疗的一种有前途的策略。代谢修饰可以潜在地增加干性和长期记忆,增强效应功能,并减少T细胞耗竭。未来的研究应确定癌细胞和免疫细胞中不同调控的关键代谢转变和调控步骤,并制定有效的靶向策略,以增强代谢调节和癌症免疫治疗的协同作用。
靶向糖酵解以增强激素治疗癌症
激素疗法作为依赖激素的癌症的治疗策略已显示出显着的进步,尤其是在乳腺癌、前列腺癌和其他妇科癌症中。芳香化酶抑制剂(aromatase inhibitors, AI)、雌激素受体(estrogen receptor, ER)拮抗剂、ER调节剂、抗雌激素药物和GnRH激动剂是有效的治疗药物,在激素敏感的复发或转移性妇科恶性肿瘤患者中显示出较高的成功率。
大多数ER+转移性BC和去势抵抗性PC(castration-resistance PC, CRPC)患者总是对激素治疗产生耐药。
在PC中,雄激素水平升高会增加葡萄糖摄取并上调GLUT的表达,这意味着雄激素信号转导和糖酵解途径之间存在串扰,这是一种保护PC细胞免受葡萄糖剥夺诱导的氧化应激的机制。
在大多数表现出耐药性的癌细胞中经常观察到代谢重新布线,并且使用成熟的糖酵解抑制剂靶向葡萄糖代谢已被证明可以增强乳腺癌和 PC 模型中对内分泌治疗的敏感性。葡萄糖代谢和雄激素受体/内质网信号传导之间的相互作用意味着内分泌治疗与代谢调节剂的联合方法可能是克服耐药性的标准治疗。调节葡萄糖代谢的饮食干预也被证明是逃避治疗耐药性的有趣策略。迫切需要精心设计的临床试验来阐明上述策略的临床效用,并开发代谢药物作为临床环境中内分泌耐药癌症患者的常规标准护理。
靶向糖酵解以改善光动力疗法
光动力疗法(Photodynamic therapy, PDT)是一种相对较新的微创治疗程序,它依赖于癌细胞中光敏化合物的选择性积累,在适当波长的光激发下,该化合物会在癌细胞内产生ROS(主要是单线态氧),并最终杀死癌细胞,对周围组织的损害最小。尽管PDT被广泛用于治疗多种癌症,但其疗效受到多种因素的限制,包括对深层组织的有效照射。
因此,一些研究试图通过将 PDT 与其他化疗药物联合使用来提高 PDT 的疗效。研究表明,糖酵解抑制剂会破坏癌细胞代谢,提高细胞ROS水平,破坏线粒体,导致细胞死亡。因此,当与PDT联合使用时,糖酵解抑制剂理论上可以提高细胞ROS的水平,从而引发癌细胞死亡的增加。
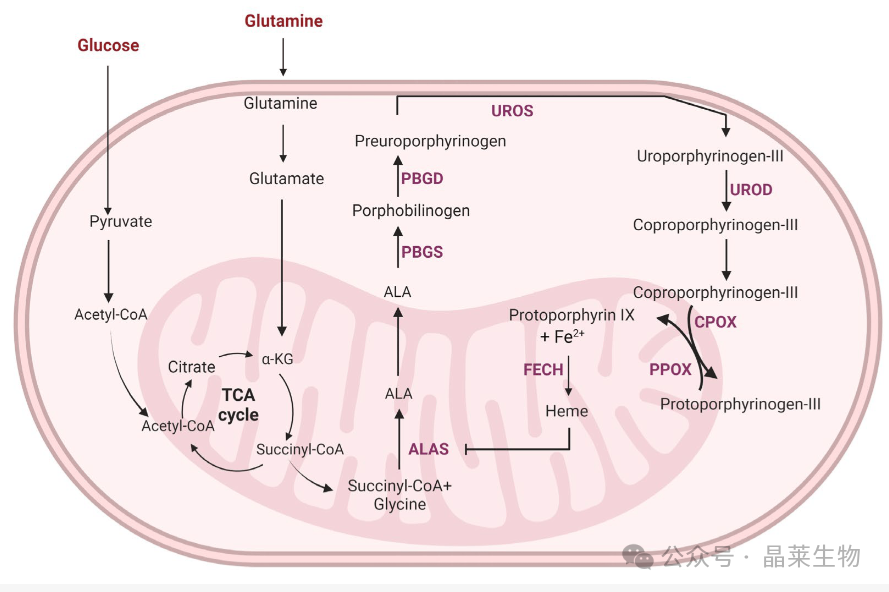
血红素的生物合成与葡萄糖和谷氨酰胺代谢有关。癌细胞中糖酵解和谷氨酰胺分解的增强可能有助于癌症中血红素合成速率的升高和几种血红素生物合成途径酶的上调。添加外源性 5-ALA 绕过了 ALAS 的反馈抑制,并增加了癌细胞中原卟啉 IX (PpIX) 的积累。PpIX的积累增加被用于荧光引导的癌症检测(光动力诊断)。此外,用光照射 PpIX 积累的癌细胞会产生单线态氧和 ROS,从而杀死癌细胞,对周围组织的损害最小(光动力疗法;PDT)。葡萄糖代谢和血红素合成途径的相互依赖性表明,靶向糖酵解可以调节癌细胞中 PpIX 的积累。
肿瘤细胞的代谢特征与正常细胞不同,这使得肿瘤细胞能够适应增加的能量和代谢物需求。在所有癌症中,葡萄糖代谢重编程没有普遍的机制。在大多数癌细胞中观察到葡萄糖代谢升高、缺氧诱导的 GLUT、LDH-A 和 PFKFB3 过表达以及 AKT 和 c-Myc 介导的 HK2 转录激活,这些代谢变化可用于开发有效的治疗方法。代谢重布线的肿瘤微环境调节和免疫抑制作用也是癌细胞进展、存活和耐药的关键因素。
除了糖酵解调节、线粒体功能障碍、ROS生成升高和TCA失调外,循环酶还参与致癌信号传导和肿瘤进展。
参考文献:
Modulating Glycolysis to Improve Cancer Therapy.by Chaithanya Chelakkot, Vipin Shankar Chelakkot,ORCID,Youngkee Shin ,ORCID and Kyoung Song. Int. J. Mol. Sci. 2023, 24(3), 2606.
关于晶莱
