

炎症性肠炎(IBD)受环境多个因素影响,病理过程复杂,一般认为是由遗传和环境诱因使患者消化道微生物组分发生变化,肠道屏障完整性被破坏,同时患者伴有免疫系统失调,肠黏膜中的效应细胞和调节细胞之间失衡,错误攻击自身健康细胞,从而导致持续的炎症。目前仍没有找出最具说服力的主要致病机理。这导致IBD的临床治疗手段相对有限。且IBD具有极高的复发率。因此,目前IBD患者仍有着巨大的未满足临床需求,迫切需要开发有效的治疗方法来解决这一全球健康问题。
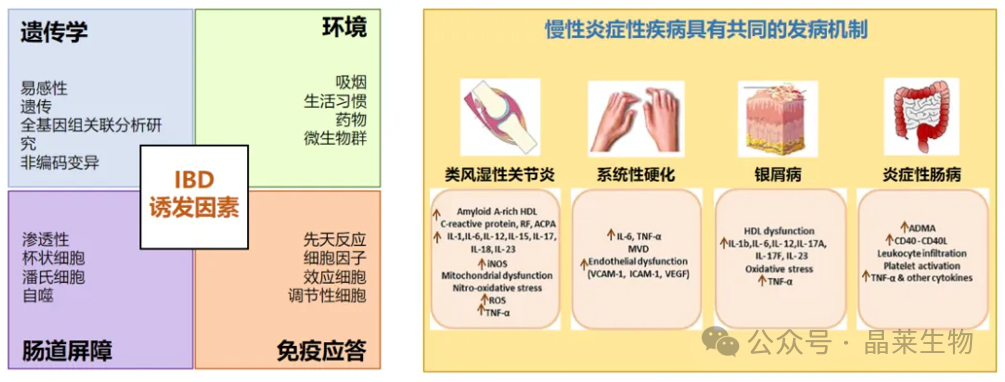
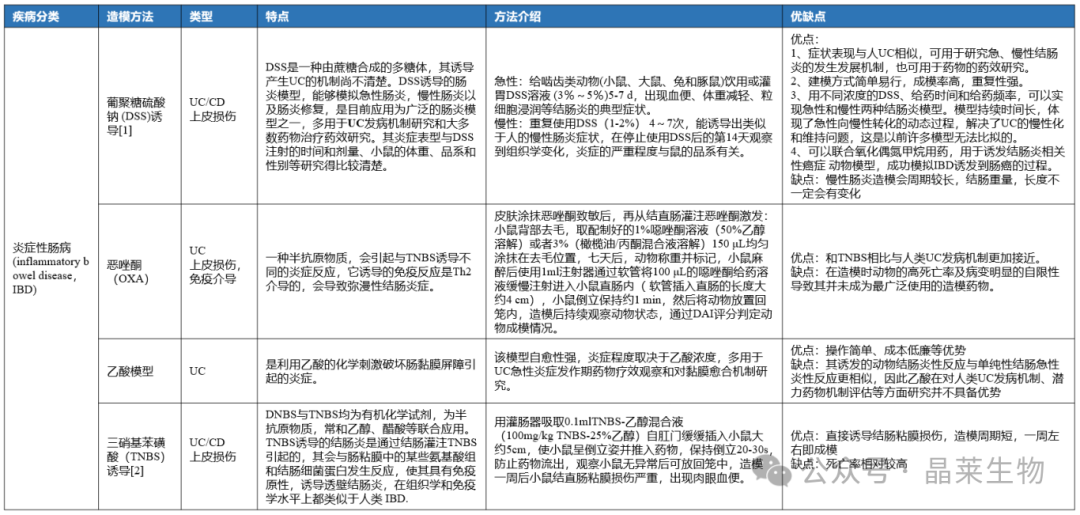
炎症性肠病是一种主要累及胃肠道的慢性复发性免疫相关性炎症性疾病,包括克罗恩病 (Crohn's Disease,CD)和溃疡性结肠炎(Ulcerative Colitis,UC)两个亚型。
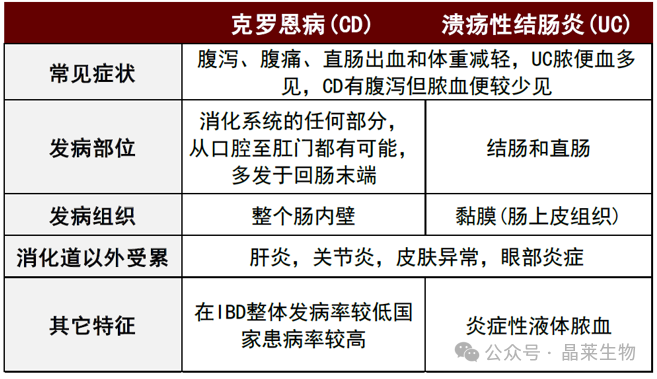
•溃疡性结肠炎(UC):一般只影响乙状结肠和直肠,形成连续性炎症斑块,损伤肠壁最内层,形成溃疡和息肉。
•克罗恩病(CD):通常发生在结肠和下端小肠,会影响到整个胃肠道,包括多个独立的炎症区域,会损伤整个肠壁,形成穿孔。
炎症及免疫系统疾病在目前的药物开发中所占的地位越来越重要。2023年全球销售额前20名的药物中,炎症和免疫系统药物占据了20%(4款),与肿瘤和代谢疾病并驾齐驱。从销售额角度来看,排名前20的药物中,炎症和免疫疾病药物销售总额达到446.1亿美元,仅次于肿瘤学药物的526.5亿美元。
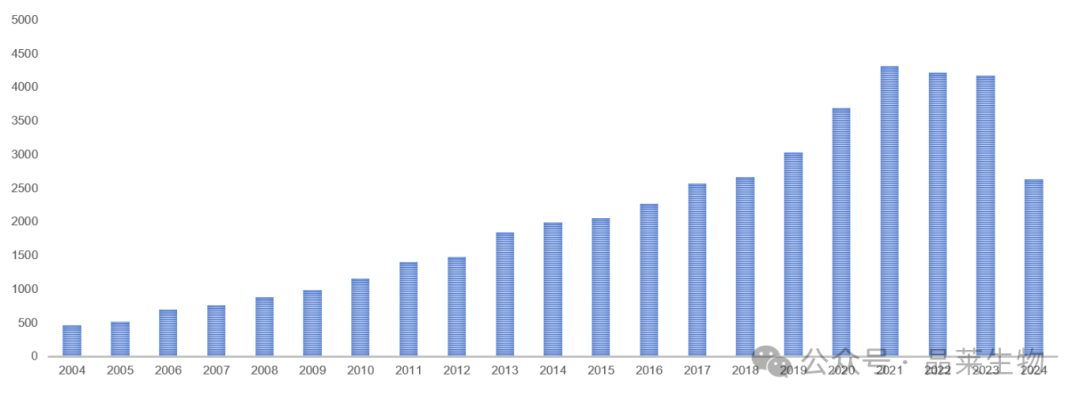
2004年至2024年至今,PubMed上收录有关“IBD”的文章数量达到38496 篇,文章数量近5年呈现快速增长趋势。
靶点
全球IBD治疗赛道的研发靶点繁多,包括一众细胞因子(如IL-23、IL-6、IL-36等)、TNF、JAK家族(泛JAK、TYK2等)、整合素(α2β2、α4β1和α4β7等)、PDE、TNF样配体1A(TL1A)等等。
发表期刊
2018-2023年间,SCI收录的IBD研究文章分布于200余种期刊中,期刊平均影响因子(impact factor,IF)较其他领域相对偏低,其中IF最高的为The Lancet(17篇,IF:168.9)及The New England Journal of Medicine(19篇,IF:158.5),高分文章大部分为新型治疗药物的临床试验。
IBD研究领域发表文章最多的期刊为Inflammatory Bowel Diseases,发文量1639篇,第2是Journal of Crohns & Colitis(1089篇),第3是Alimentary Pharmacology & Therapeutics(730篇),其他发文量较多的IF大于10分的期刊主要包括Clinical Gastroenterology and Hepatology(544篇),Gastroenterology(463篇)及The American Journal of Gastroenterology(323篇)。
其中中国IBD研究发表数量前5的期刊为Inflammatory Bowel Diseases(133篇),Frontiers in Pharmacology(128篇),Frontiers inImmunology(120篇),Medicine(98篇)及World Journal of Gastroenterology(74篇)。
发表机构
2018-2023年间,IBD研究发文量前10的机构分别为加利福尼亚大学(779篇)、哈佛大学(755篇)、西奈山伊坎医学院(650篇)、法国国家健康与医学研究院(627篇)、梅奥医疗国际(535篇)、伦敦大学(481篇)、CIBER生物医学研究中心(447篇)、特拉维夫大学(441篇)、克利夫兰医学中心(441篇)、巴黎西岱大学(433篇),其中半数为美国医学研究机构,为IBD领域作出了重要贡献。
我国近6年发文排名前5的机构分别为中山大学(338篇)、浙江大学(272篇)、上海交通大学(238篇)、南京医科大学(178篇)以及南京中医药大学(164篇)。
案例分析-溃疡性结肠炎-DSS 诱导模型
1. 实验材料
① 动物 :雄性 C57 BL/6 小鼠,8 周龄,20-22g
② 材料:无菌水配制DSS溶液
2. 实验方法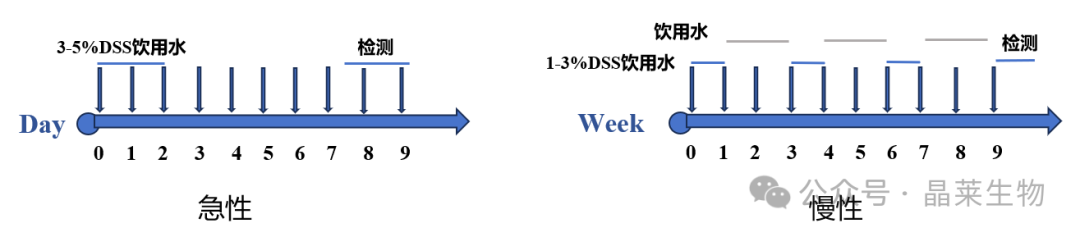
① 急性:称重并标记各组小鼠。造模小鼠饮用3-5% DSS水溶液,未处理组小鼠饮用正常水;隔天给予造模小鼠更换新鲜3-5%DSS饮用水。
② 慢性:称重并标记各组小鼠。待造模小鼠饮用1-3% DSS水溶液,未处理组小鼠饮用正常水,一周后恢复正常水喂养2周,再次更换DSS喂养1周,如此重复3-4次。
3. 模型评价
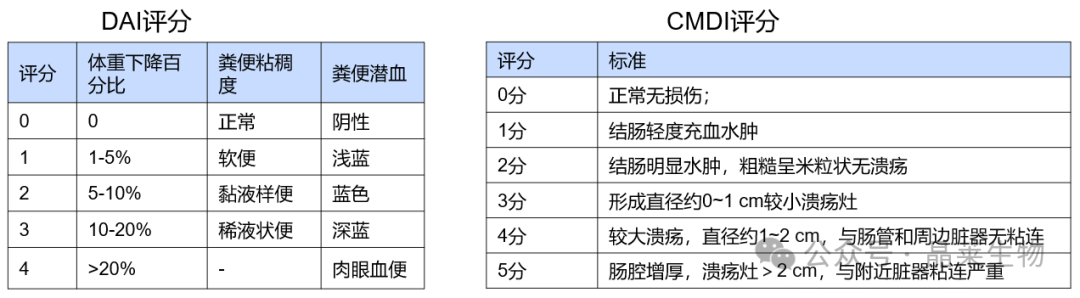
① DAI评分:疾病活动指数(Disease activity index DAI)是结合患者的体重下降百分率、大便黏稠度和大便出血三种情况进行综合评分,将3项结果的总分除以3即得到DAI值。
② 大体取材与结肠评价:取结肠进行称重和测量长度,比较结肠长度;计算结肠重量与体重比值,结肠重量与结肠长度比值。结肠组织损伤指数(colonic injury index,CMDI)评分。
③ 组织病理学。将动物结肠组织经HE染色后,光学显微镜下观察结肠结构破坏、炎性细胞浸润等情况并进行综合评分,从而评估造模效果。
④ 标志因子检测。
使用小鼠、大鼠、仓鼠、豚鼠或猪、兔等动物均可造模,通过给予动物自由饮用不同浓度的DSS水溶液,根据用药时间及用药周期可制成急性和慢性两种结肠炎模型。该模型症状表现与人类UC极为相似,主要表现为腹泻、黏液样便、粪便潜血、肉眼血便、重量减轻、活动度减少,毛色变差等。
5. 注意事项
① 通常选用分子量36000~50000不等,含硫量为17%-20% 的DSS,实验周期较长,注意药物批次保持一致。
② DSS需用无菌水配制,并用滤膜过滤,现用现配,每1-2天更换一次
③ 每日清洗饮水瓶,定期检查是否漏水,动物会有腹泻情况,需更加频繁更换垫料;
④ 每笼饲养动物不要过多,建议2-3只,不要超过5只。
⑤ 前期死亡率不高,给药时间延长,浓度太大,浓度不耐受,动物会重度腹泻,有一定死亡率。
6. 常见问题
1. 提高DSS造模成功率的关键因素有哪些?
DSS浓度、分子量、给药剂量和方式、给药时间,动物种属对造模成功率都会有影响。对此可以通过筛选合适的品系、年龄性别以及严格把控实验操作流程,优化造模方法,确保模型建立的稳定性。
2. 结果发现组内差异比较大是为什么?
可能是饮水量差异较大,需要尽最大可能保持小鼠饮水的均匀,没笼2-3只小鼠甚至更少,多关注饮水瓶的余量,避免堵塞漏水现象。
3. 慢性结肠炎造模过程中,为什么第二阶段诱导总是慢于第一阶段?
第一阶段诱导后DSS耐受水平会提高,症状出现缓慢或较轻是常见的。若想要缩短第二阶段诱导周期,可以适当提高DSS浓度。
肠易激综合征(IBS)
肠易激综合征(IBS)被公认为人类发病率最高的一种全球性功能性疾病,在全球,IBS大约影响着5%~20%人群,每年IBS的发病率大约在每100000人中有196~260人,且女性发病率高于男性,其诊断有年轻化的趋势,多见于年龄小于50岁人群。
虽然IBS没有被认为与某些严重疾病或者更高的死亡率相关,但已有大量的研究表明IBS对患者生活质量的损害程度与某些慢性疾病,诸如糖尿病、充血性心力衰竭、肾功能衰竭及肝硬化等大体相同。
IBS在临床上可分为以下三种亚型,即腹泻型肠易激综合征(IBS-D)、便秘型肠易激综合征(IBS-C)、混合型肠易激综合征(IBS-M)。
造模方法
大鼠结肠内灌入1 mL 40 mL/L乙酸,并用1 mL PBS冲洗结肠。处理完后,将大鼠放回笼中自由活动,正常饮食;
造模第11 d给予大鼠束缚刺激(限制其肢体活动),每天束缚2 h,每天一次,束缚应激一周;
造模第20 d开始束缚应激加灌胃番泻叶煎剂(0.6 g/mL)2 mL/100g造模,连续一周;
造模第28 d开始撤去束缚应激,每只灌胃给予番泻叶煎剂,连续给药31 d。
于束缚应激一周后,测定大鼠腹壁撤退反射和避水应激排便;于束缚应激加番泻叶灌胃一周后,测定大鼠稀便级数,判断模型是否成功。
模型评价指标
① 腹壁撤退反射评估:乙酸灌肠和束缚应激一周后,与正常大鼠相比,模型大鼠腹壁撤退反射明显升高(p<0.05, 0.01);
② 避水应激排便评估:模型大鼠避水应激排便粒数明显增加(p<0.05);
③ 稀便级数评估:模型大鼠稀便级数明显增加(p<0.01);
④ 血浆生化指标及结肠组织生化指标测定。
参考文献:
[1] Eichele DD, Kharbanda KK. Dextran sodium sulfate colitis murine model: An indispensable tool for advancing our understanding of inflammatory bowel diseases pathogenesis. World J Gastroenterol. 2017 Sep 7;23(33):6016-6029.
[2] Silva I, Pinto R, Mateus V. Preclinical Study in Vivo for New Pharmacological Approaches in Inflammatory Bowel Disease: A Systematic Review of Chronic Model of TNBS-Induced Colitis. J Clin Med. 2019 Oct 1;8(10):1574.
[3] BUTZNER J D, PARMAR R, BELL C J, et al. Butyrate Enema therapy stimulates mucosal repair in experimental colitis in the rat[J]. Gut, 1996, 38(4): 568-573.
[4] Wirtz S , Popp V , Kindermann M , et al. Chemically induced mouse models of acute and chronic intestinal inflammation[J]. Nature Protocols, 2017, 12(7):1295-1309.
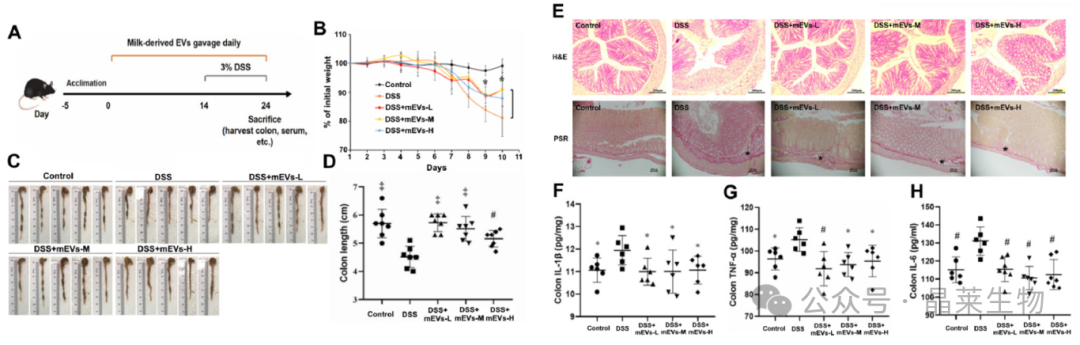
[5] Tong L , Hao H , Zhang Z ,et al.Milk-derived extracellular vesicles alleviate ulcerative colitis by regulating the gut immunity and reshaping the gut microbiota[J].Theranostics, 11(17):8570-8586[2024-07-16].
[6] Windsor J W , Kaplan G G .Evolving Epidemiology of IBD[J].Current gastroenterology reports, 2019, 21(8):40.
[7] Liu J, Di B, Xu LL. Recent advances in the treatment of IBD: Targets, mechanisms and related therapies. Cytokine Growth Factor Rev. 2023 Jun-Aug;71-72:1-12.
[8]Cohen NA, Rubin DT. New targets in inflammatory bowel disease therapy: 2021. Curr Opin Gastroenterol. 2021 Jul 1;37(4):357-363.
[9] Cooper HS, Murthy SN, Shah RS, Sedergran DJ. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab Invest. 1993;69(2):238–249.
[10] Bonetto, S., Fagoonee, S., Battaglia, E., Grassini, M., Saracco, G. M., & Pellicano, R. (2021). Recent advances in the treatment of irritable bowel syndrome. Polish Archives of Internal Medicine, 131(7-8), 709-715.
[11] Camilleri, M. (2021). Diagnosis and treatment of irritable bowel syndrome: a review. Jama, 325(9), 865-877.
[12] Basnayake, C. (2018). Treatment of irritable bowel syndrome. Australian Prescriber, 41(5), 145.
