

乳酰化 (Kla)是一种 PTM 蛋白,于 2019 年首次报道。随后的研究进一步证实,Kla 在乳酸方面具有重要功能,并参与肿瘤增殖、神经系统调节和代谢调节等重要活动。
蛋白质翻译后修饰 (PTM) 被公认为与致癌作用和免疫调节直接相关,并已成为癌症检测和治疗的重要靶点。
乳酰化 (Kla) 是一种与细胞代谢相关的新型 PTM,存在于多种细胞中,与组蛋白和非组蛋白相互作用。与其他表观遗传学变化不同,在目前的所有研究中,Kla 都与不良的肿瘤预后有关。组蛋白 Kla 可影响肿瘤和免疫细胞中的基因表达,从而促进恶性肿瘤和免疫抑制。非组蛋白还可以通过 KLA 调节肿瘤进展和治疗耐药性。
无论是在厌氧还是好氧条件下,糖酵解都会产生乳酸。越来越多的证据表明,乳酸是一种多功能信号分子,除了作为连接糖酵解和氧化磷酸化的关键代谢物外,还产生非代谢活性。
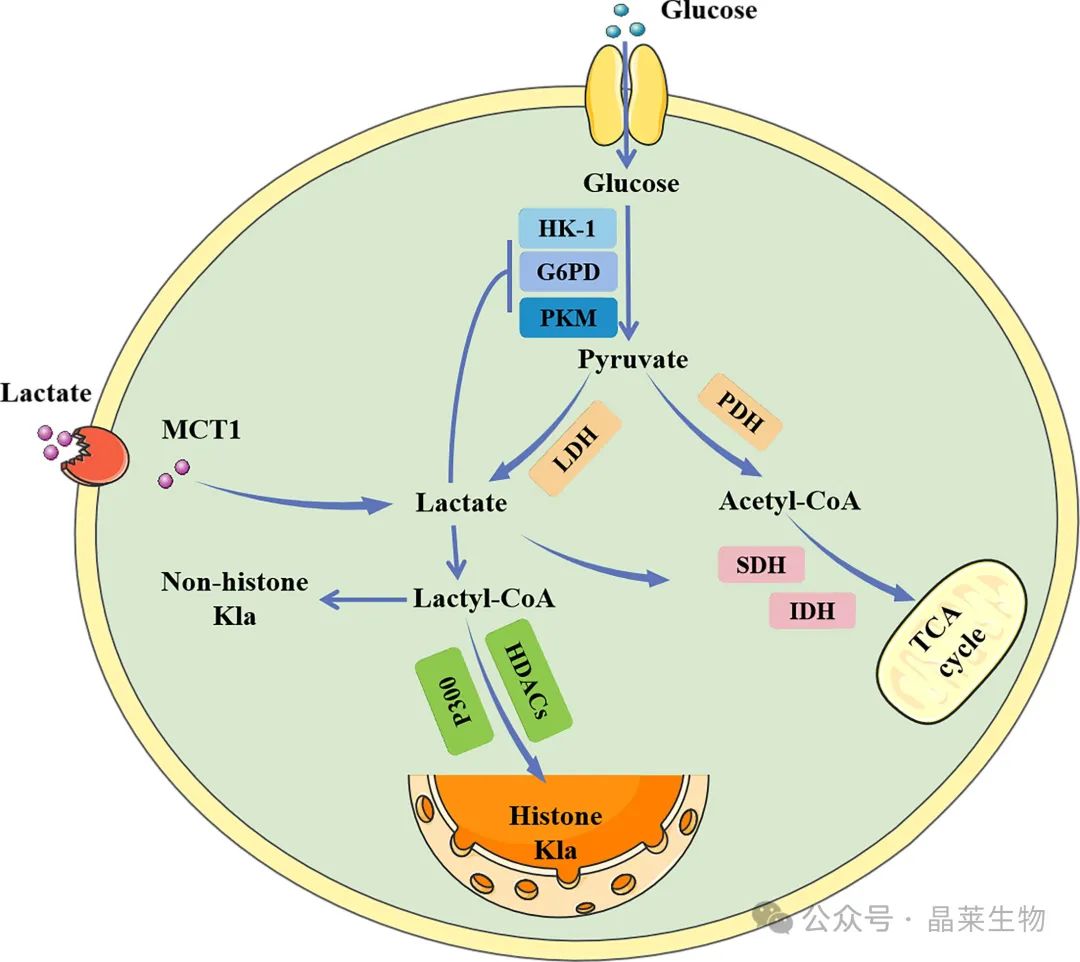
乳酸可以通过 LDH 催化的糖酵解在细胞内产生,也可以通过 MCT1 从外部吸收。细胞内乳酸抑制糖酵解酶,同时促进三羧酸循环,产生负反馈回路。乳酸也可以转化为乳酰辅酶 A,乳酰辅酶 A 参与组蛋白和非组蛋白的乳酰化。
Kla 及其相关酶的研究为靶向癌症治疗提供了新的前景,并具有广阔的实际应用前景。随着越来越多的组蛋白 Kla 位点被鉴定出来,Kla 在非组蛋白中的作用越来越被理解和认可。在糖酵解酶中,已发现 Kla 广泛存在。相关研究表明:
① 醛缩酶 A 的 Kla (ALDOA) 存在于许多人类肿瘤细胞系中,并且可以通过控制代谢酶的活性来控制糖酵解。
② 通过彻底分析肿瘤和附近的肝脏,相关研究确定了 9,275 个 Kla 位点,其中 9,256 个是在组蛋白以外的蛋白质上发现的,这表明 Kla 是一种广泛的改变,超出了组蛋白和转录调控。且表明在肝细胞癌 (HCC) 中,p53 通路受腺苷酸激酶 2 (AK2) Kla 控制,这会导致预后不良。
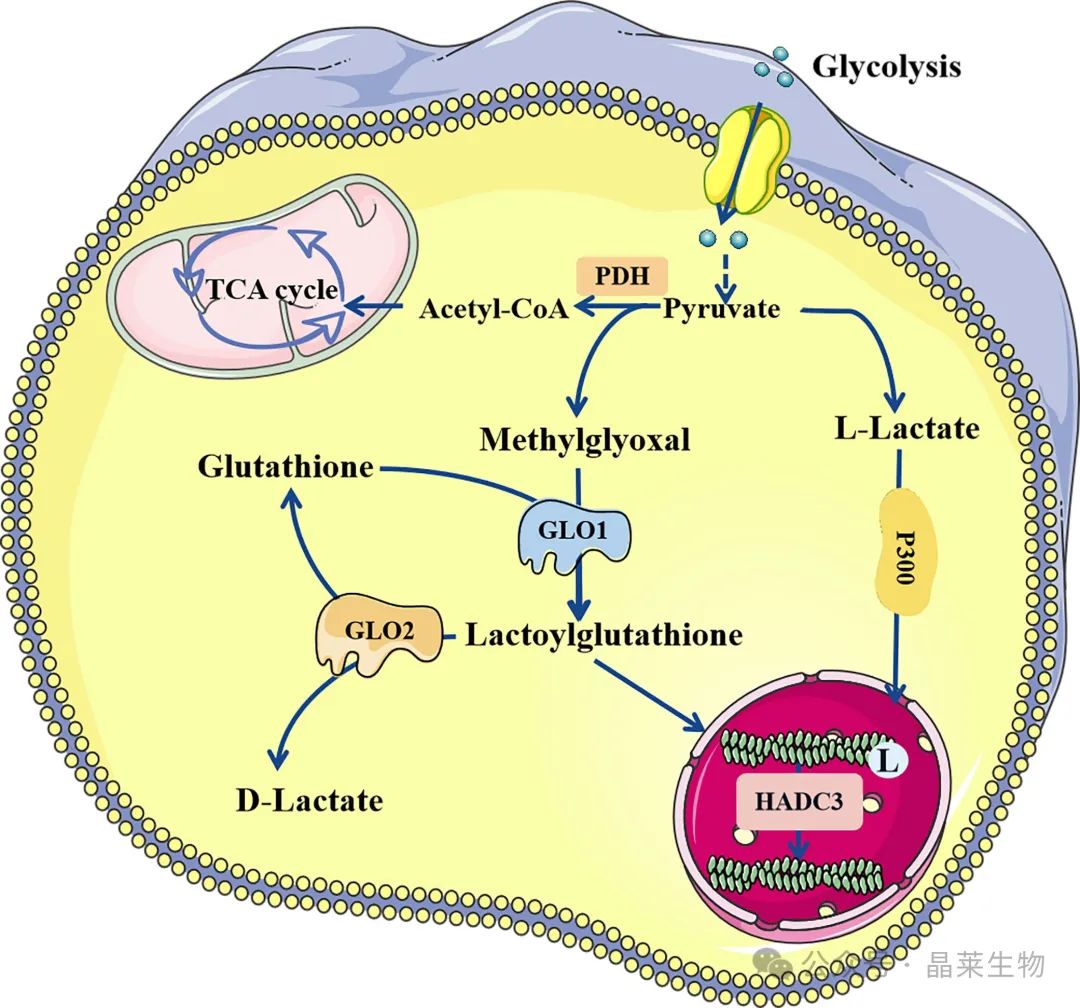
乳酰化有两种已知的修饰途径。L-乳酸可形成乳酰辅酶 A,在 P300 的催化下介导乳酰化。此外,甲基乙二醛可在 GLO1 的催化下形成 LGSH,LGSH 还可以介导蛋白质的乳酰化,不需要酶催化。LGSH 可在 GLO2 的作用下分解成谷胱甘肽和 D-乳酸。L 和 D-乳酸介导的乳酸化均被 HDAC3 消除。
已发现 TAM 中组蛋白赖氨酸 Kla 的程度高于其他组织,这意味着 Kla 在 TME 中起着重要的调节作用,这可能为肿瘤免疫治疗、抗血管生成治疗和靶向治疗提供新的方向。
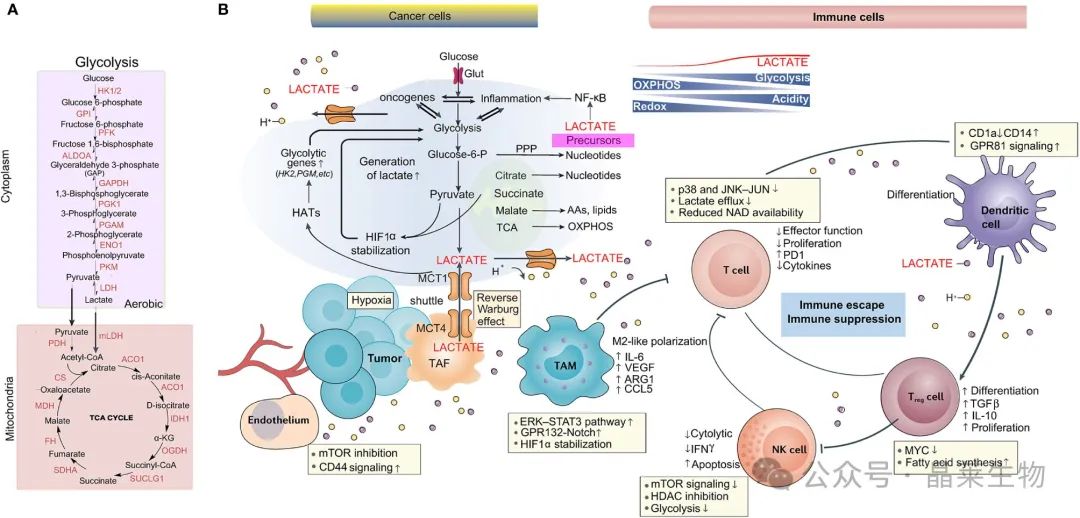
(A) 乳酸生成中的主要生化参与者:糖酵解途径和 OXPHOS。(B) 乳酸在 TME 中的作用,包括肿瘤、基质、免疫细胞、血管和乳酸等细胞代谢物。由于 Warburg 效应和乳酸穿梭,乳酸积累诱导酸中毒、血管生成、免疫抑制以及肿瘤细胞增殖和存活。
乳酰化调节免疫细胞的功能以介导免疫抑制,乳酰化与肿瘤的免疫抑制密切相关。
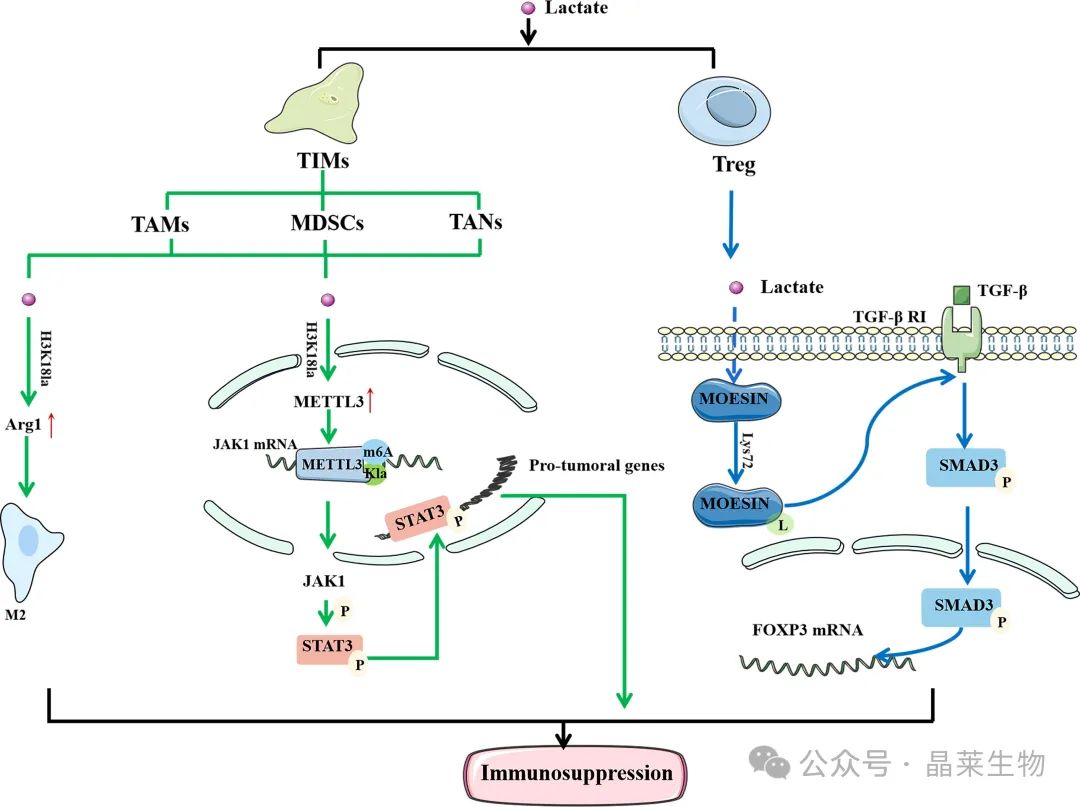
在 TAM 中,组蛋白乳酸化将导致 M2 表型相关基因的上调,从而介导 M2 极化。在 TIM 中,组蛋白乳酸化促进 METTL3 的表达,METTL3 介导 JAK6 mRNA 的 m1A 修饰。同时,METTL3 中还有乳酰化位点,使其能够与靶 RNA 结合。
Moesin 可以降低 TGF-β 受体的表达并抑制 Treg 细胞的产生,以恢复抗肿瘤免疫。乳酸可通过促进 Lys72 位点乳酰化来抑制 moesin 的功能,介导 Treg 细胞的生成并促进肿瘤细胞的免疫逃逸。
乳酸调节肠道菌群的增殖并具有致癌作用。
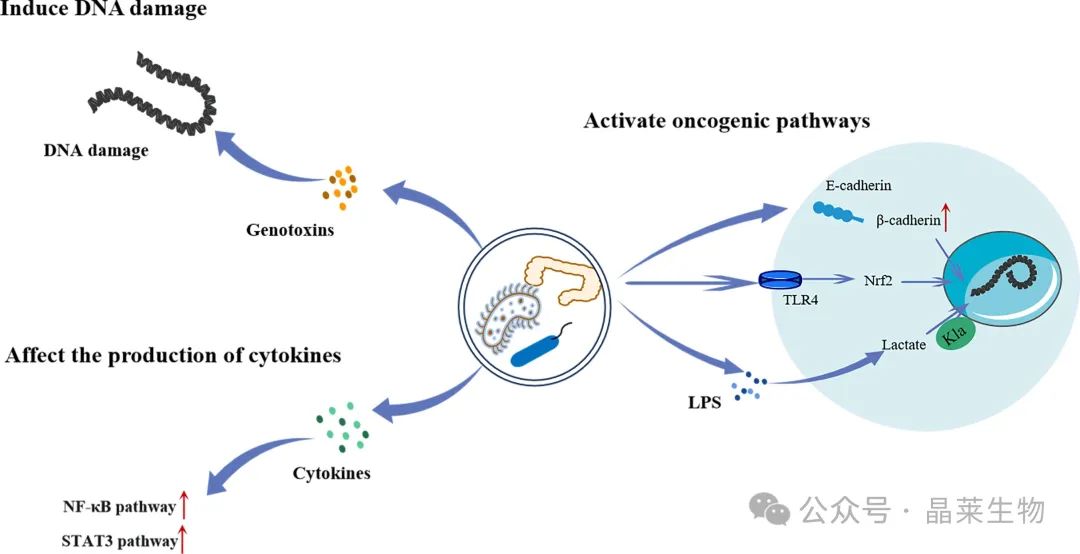
肠道细菌可通过产生基因毒素直接引起细胞内 DNA 损伤,或通过促进细胞因子分泌促进肿瘤发生来激活 NF-κB 和 STAT3 通路。肠道细菌还可以激活一系列致癌途径。
通过降解 E-钙粘蛋白/β-catenin 复合物,β-catenin 释放和易位到细胞核中增加,导致与各种癌症相关的 WNT 信号转导异常激活。此外,它们可以通过激活 TLR4/Keap1/NRF2 信号传导导致癌症的侵袭和转移。
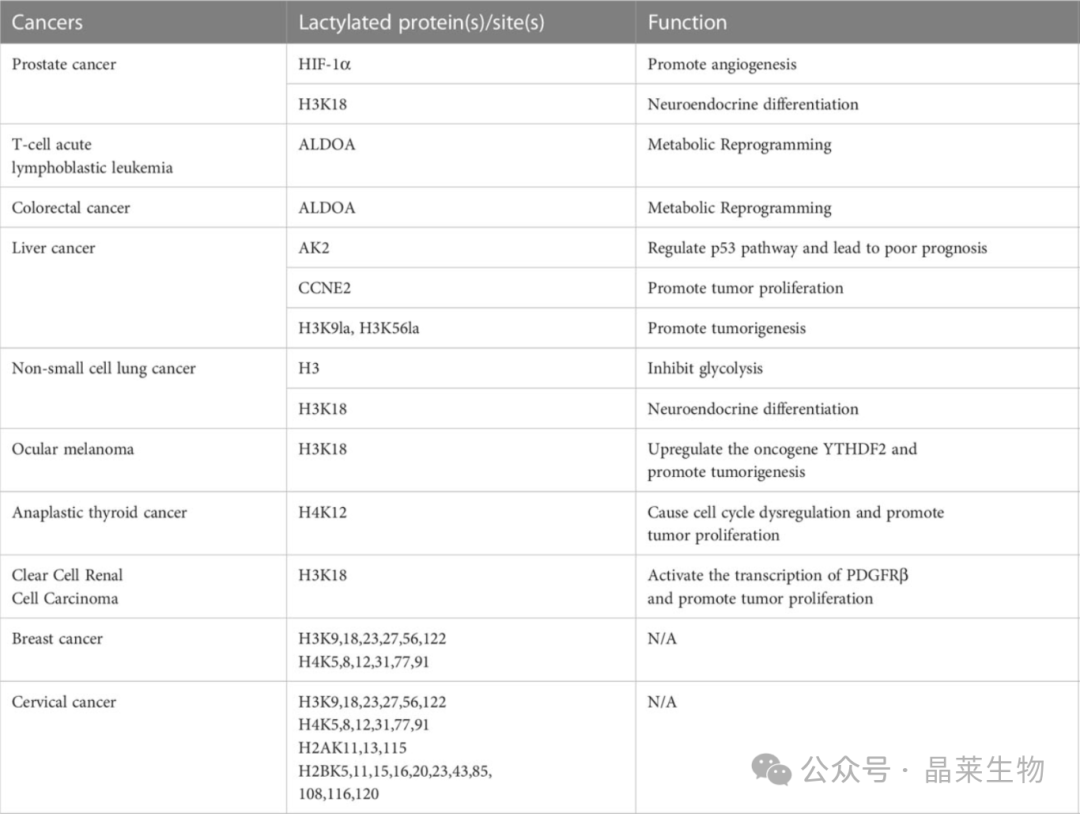
1. 癌细胞中乳酰化的调节
2. 免疫治疗的乳酰化
Kla 在免疫疗法中至关重要。程序性细胞死亡蛋白 1 (PD-1) 阻断疗法的治疗效果取决于 TME 中表达 PD-1 的 CD8+ T 细胞和 Treg 细胞的再激活竞争。
① 研究表明,乳酸可以促进 PD-L1 在巨噬细胞和中性粒细胞上的表达,以介导免疫抵抗。
② 研究表明,将 MCT1 抑制剂AZD3965与抗 PD-1 疗法联合使用可降低乳酸释放到 TME 中,并增强抗肿瘤免疫力。
③ 研究发现,对抗 PD-1 治疗有反应的 HCC 患者 Treg 细胞中的 Kla 水平较低。此外,抗 PD-1 药物和乳酸脱氢酶抑制剂的组合比单独使用抗 PD-1 药物具有更强的抗肿瘤作用。这表明 Kla 抑制与免疫疗法相结合可能有效治疗肿瘤。
Kla 在肿瘤代谢重编程、血管生成、免疫逃逸和肠道菌群调节中起重要作用。它也与恶性肿瘤的发生和进展有关。然而,Kla 靶向技术和临床转化仍处于起步阶段。希望这篇文章能对读者有所帮助,为他们提供新的研究思路。
参考文献:
[1]Functions and mechanisms of lactylation in carcinogenesis and immunosuppression.Jing Su, Zhuangzhuang,Zheng, Chenbin,Bian, Sitong Chang, Jindian Bao, Huiyuan Yu, Ying Xin,Xin Jiang. Immunol., 14 August 2023. Sec. Cancer Immunity and Immunotherapy.
[2]Lactylation, a Novel Metabolic Reprogramming Code: Current Status and Prospects.An-Na Chen,Yan Luo,Yu-Han Yang,Jian-Tao Fu,Xiu-Mei Geng,Jun-Ping Shi,Jin Yang, Immunol., 10 June 2021.Sec. Molecular Innate Immunity.
关于晶莱
