

肝缺血再灌注损伤( HIRI)是指在一段时间内肝脏血液供应不足或甚至完全阻断后,恢复血液供应导致的再灌注损伤,这是肝外伤、切除和肝移植期间不可避免的并发症。HIRI是手术期间常见的事件,可能导致器官损伤、衰竭或急性/慢性组织排斥。因此,HIRI严重限制了肝切除的适应症、边缘肝脏供体的应用,甚至是肝移植的应用和治疗效果。
HIRI是一个两阶段现象,即缺血阶段和再灌注阶段。缺血阶段通常缺乏肝脏血液补充,导致组织缺氧和细胞损伤。再灌注阶段是由于恢复血流触发补体级联反应,随后导致二次损伤。
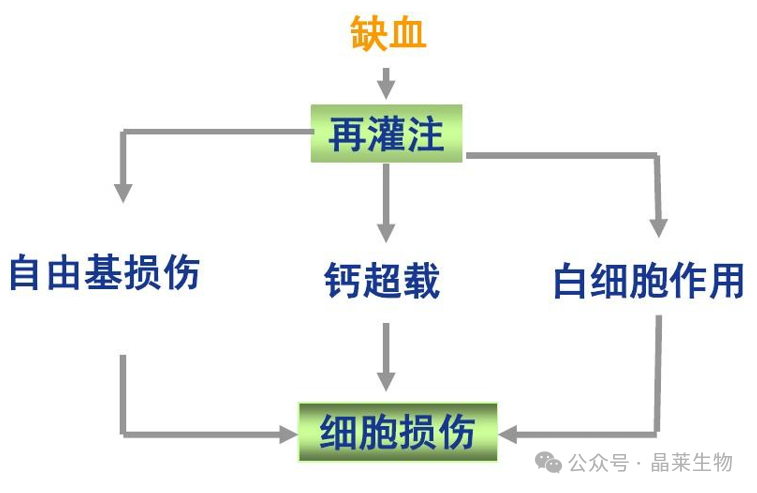
1. 缺氧通常对肝细胞产生显著的负面影响,导致线粒体通透性变化和线粒体代谢紊乱,例如呼吸链断裂、细胞内烟酰胺腺嘌呤二核苷酸(NADH)/NAD+增加、三磷酸腺苷(ATP)耗竭、钙离子(Ca2+)的调节失衡或环磷酸腺苷(cAMP)的显著增加,这些因素调节糖代谢。
2. 过量的活性氧(ROS)主要来源于再灌注后肝细胞,导致氧化应激,这可能导致DNA损伤、蛋白质氧化、线粒体功能障碍和脂质过氧化,最终导致包括凋亡、焦亡和铁死亡在内的不同类型肝细胞死亡。
3. 细胞死亡导致损伤相关分子模式(DAMPs)的大量释放,如高迁移率族蛋白盒1(HMGB1)或白介素-33(IL-33),改变其他正常肝细胞代谢,激活免疫细胞,甚至影响肝窦微环境中其他细胞的命运,共同形成正反馈,进一步加速HIRI的进展。
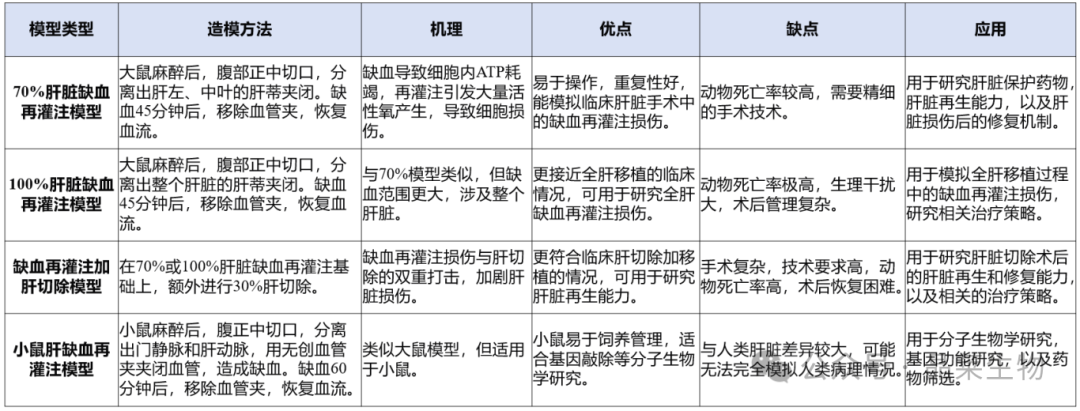
1. 动物准备
选择适宜的小鼠(如SPF级Balb/c小鼠,雄性,周龄为6-8周,体重为20-25g)。术前12小时禁食,自由饮水。
2. 手术操作
① 小鼠通过腹腔注射麻醉剂(如3%异氟烷气体或戊巴比妥钠)进行麻醉。
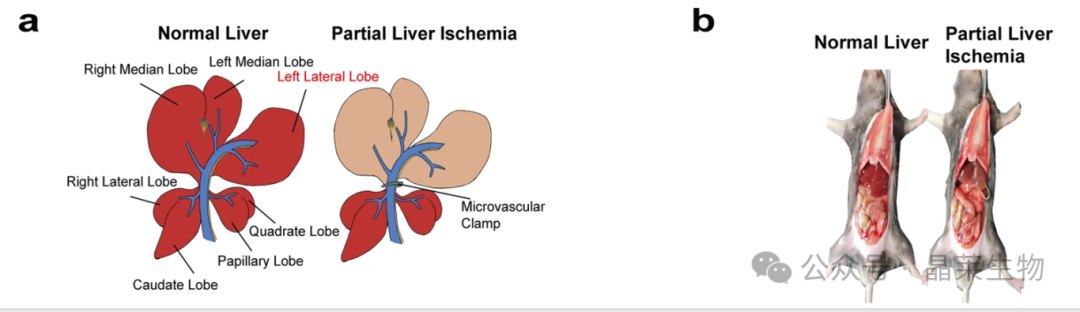
② 腹部正中切口,打开腹腔,小心分离出肝脏左、中叶的肝蒂(包括门静脉和肝动脉)。
③ 用无创血管夹夹闭中叶和左叶的门静脉和肝动脉,造成约70%肝脏缺血。
④ 0.5min后,与非阻断的右叶相比,肉眼可见阻断叶明显变白,说明阻断成功,用止血钳夹闭皮肤切口临时关闭腹腔,同时将小鼠放在37℃恒温加热垫上保温。手术间歇期用湿棉垫覆盖切口防止体液丧失。
⑤ 持续缺血一段时间后,迅速去除血管夹,观察到肝组织色泽变红润证实血液复流。
⑥ 再灌注一段时间后,留取肝脏组织和血清组织标本待检测用。
3. 术后处理
① 将小鼠放置在37°C恒温加热垫上保温。
② 关腹前腹腔内补液1ml,有利于术后恢复。
4. 注意事项
① 术中注意不要损伤其他组织,尤其是肝蒂下方的下腔静脉。
② 缺血时间可以根据实验需要调整,一般30/45/60min不等。
③ 术后应密切观察小鼠的恢复情况和生存状况。
④ 记录实验动物在术后一定时间内的存活情况。高生存率通常表明模型成功率高,动物能够耐受手术操作和缺血再灌注的生理压力。
5. 模型评价
① 生化指标:通过测定血清中的丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)水平来评估肝细胞损伤的程度。这些酶在肝细胞损伤时会释放到血液中,其血清水平的升高通常与肝损伤程度成正比。
② 氧化应激指标:测定血清或肝脏组织中的丙二醛(MDA)水平和超氧化物歧化酶(SOD)活性。MDA是脂质过氧化的终产物,其水平升高表明氧化应激加剧;SOD是体内清除超氧阴离子的酶,其活性下降表明机体抗氧化能力减弱。
③ 炎症因子水平:测定血清中的肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等炎症因子的水平,反映炎症反应的程度。
④ 免疫印记法:检测自噬及凋亡相关蛋白表达。
⑤ 细胞凋亡:通过末端脱氧核糖核酸转移酶介导的dUTP缺口末端标记(TUNEL)法或caspase-3染色等方法检测肝细胞凋亡的情况。
⑥ 肝脏微循环评估:直接观察或通过影像学技术如超声、CT等检查肝脏的血流情况,评估肝脏微循环状态。
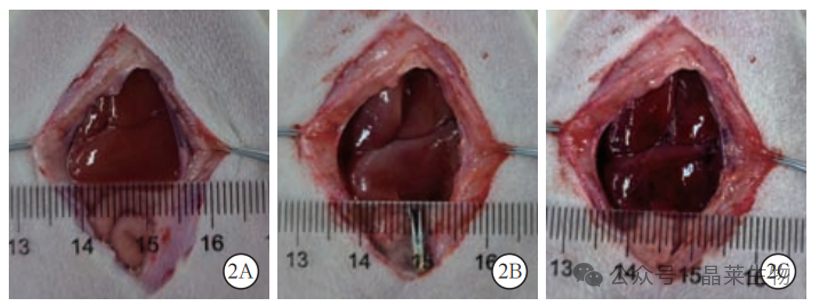
以 A30 组为例大鼠肝缺血 / 再灌注损伤(IRI)前后肝组织大体表现开腹后暴露肝脏,可见肝叶颜色鲜红表面光滑,无肿胀(A);
夹闭血管后,可见肝左叶、中叶颜色变为紫黑色,被膜紧 张,呈淤血状(B);
缺血 30min 后松开动脉夹,可见缺血肝叶颜 色逐渐转为鲜红,说明肝缺血 30min 再灌注模型制备成功(C)
⑦ 组织学评分:通过苏木素-伊红(HE)染色和免疫组化巨噬细胞染色,从病理学角度分析肝组织结构损伤情况。
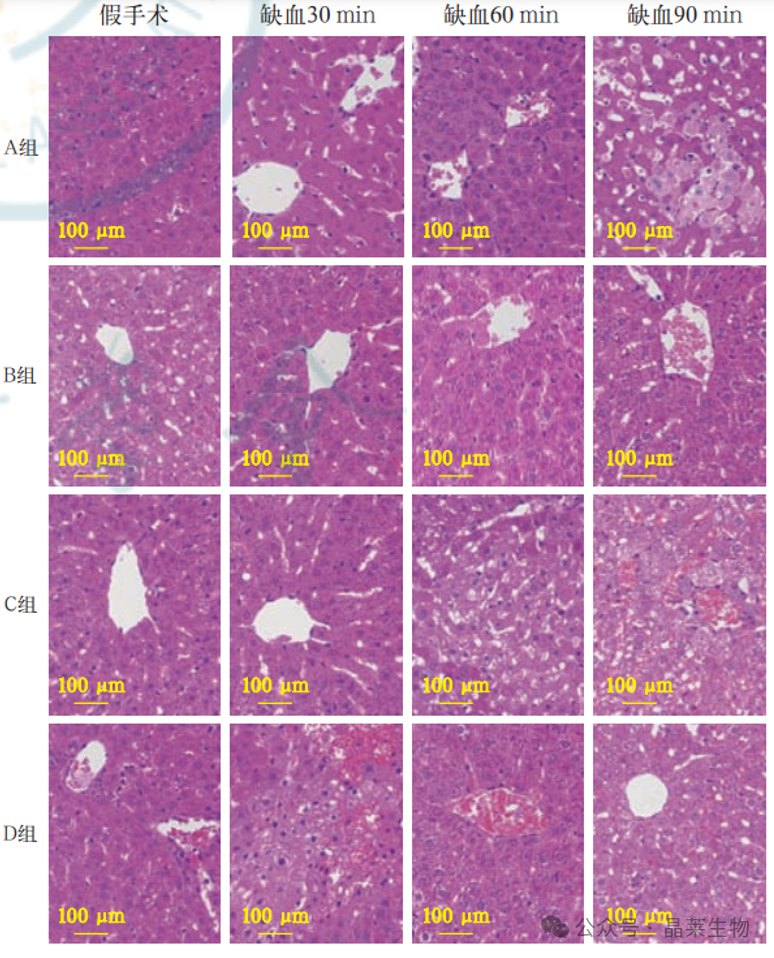
光镜下观察 4 种肝缺血 / 再灌注损伤(IRI)模型大鼠肝组 织病理形态与结构变化 A 组(70%IRI 30min)、B 组(100% IRI 30min)、C 组(70%IRI+30% 肝切除)、D 组(100% IRI+30% 肝切 除)中的假手术组肝组织结构清晰,细胞完整,排列整齐,其余各 组可见细胞结构破坏,出现断裂或塌陷,细胞水肿,部分细胞有 核固缩、胞质深染,脱落坏死,间质有炎症细胞浸润。

1. 肝脏IRI的治疗策略
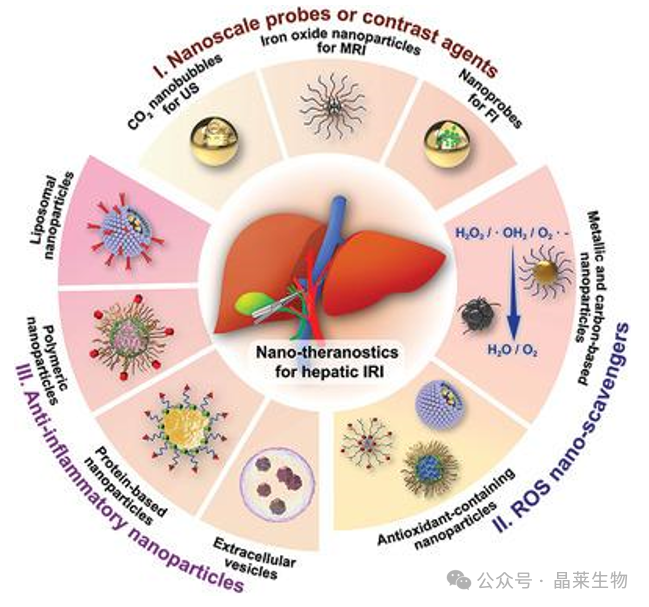
① 药物预处理:使用药物如抗氧化剂、抗炎药物、钙通道阻断剂等来减轻肝脏IRI。
② 缺血预处理:通过短暂的缺血和再灌注周期来提高肝脏对后续长时间缺血的耐受性。
③ 基因治疗:通过基因敲除或RNA干扰来抑制肝脏IRI中的关键分子,如NLRP3炎症体。
④ 机械灌注:在器官移植中使用机械灌注技术来维持肝脏的血流和功能。
⑤ 调节自噬-KLF2通路:通过激活自噬和KLF2通路来保护肝脏内皮功能,减轻肝脏损伤。
2. 应用方向

参考文献:
1.赵丽, 崔子林, 张雅敏, 等. HMGB1-RAGE信号轴在肝脏缺血再灌注损伤中作用的研究进展 [J] . 国际生物医学工程杂志, 2022, 45(2) : 166-170,185. DOI: 10.3760/cma.j.cn121382-20211012-00213.
2.Xin, J., Yang, T., Wu, X. et al. Spatial transcriptomics analysis of zone-dependent hepatic ischemia-reperfusion injury murine model. Commun Biol 6, 194 (2023).
3.罗嘉琪,王莉荔,陈阜东,等. 4种急性肝缺血/再灌注损伤大鼠模型的建立及适用性比较[J]. 中华危重病急救医学,2023,35(06):604-609.
4.孙萍萍,陈杰,袁芳,等.大鼠肝缺血再灌注模型建立与评价[C]//2014年广东省药师周大会论文集.2014. 5
.Xie K , Liu L , Chen J ,et al.Exosomal miR‐1246 derived from human umbilical cord blood mesenchymal stem cells attenuates hepatic ischemia reperfusion injury by modulating T helper 17/regulatory T balance[J].IUBMB Life, 2019, 71.DOI:10.1002/iub.2147.
6.Li S L , Wang Z M , Xu C ,et al.Liraglutide Attenuates Hepatic Ischemia-Reperfusion Injury by Modulating Macrophage Polarization[J].Frontiers in immunology, 2022, 13:869050.DOI:10.3389/fimmu.2022.869050.
7.Zhang S , Feng Z , Gao W ,et al.Aucubin Attenuates Liver Ischemia-Reperfusion Injury by Inhibiting the HMGB1/TLR-4/NF-κB Signaling Pathway, Oxidative Stress, and Apoptosis[J].Frontiers in Pharmacology, 2020, 11:544124.DOI:10.3389/fphar.2020.544124.
8.李伟男, 彭慈军, 舒德军, 梅永, 李雄雄, 谢万桃. 肝脏缺血再灌注损伤的研究进展. 世界华人消化杂志 2015; 23(22): 3554-3559
9.Cannistrà, Marco, Ruggiero M , Zullo A ,et al.Hepatic ischemia reperfusion injury: A systematic review of literature and the role of current drugs and biomarkers[J].International Journal of Surgery, 2016:S57-S70.DOI:10.1016/j.ijsu.2016.05.050.
10.Wang L , Duan C , Wu X ,et al.ADAR1 regulates macrophage polarization and is protective against liver ischemia and reperfusion injury[J].Immunobiology, 2024, 229(1).DOI:10.1016/j.imbio.2023.152777.
11.Current status and perspective on molecular targets and therapeutic intervention strategy in hepatic ischemia-reperfusion injury. Clin Mol Hepatol. 2024;30 (4): 585-619. Doi:https://doi.org/10.3350/cmh.2024.0222
关于晶莱
